玻璃化冷冻对猪卵母细胞超微结构的影响
2015-08-08吴亚辉卢俊求王晓丽
周 悦,吴亚辉,卢俊求,蒋 艳,王晓丽
(广西大学动物科学技术学院,广西 南宁 530005)
随着生物医学的发展,人们逐渐意识到建立卵母细胞保存库的重要性。玻璃化冷冻是一种简便快速的冷冻方法,成为低温生物学领域的研究热点之一。冷冻解冻后卵母细胞的发育潜力明显受损,这与冷冻过程造成卵母细胞损伤密切相关。猪卵母细胞含有大量的脂滴,对低温的耐受性差,这给猪卵母细胞的冷冻造成了很大的困难[1-5]。关于猪卵母细胞冷冻保存研究尚处于探索阶段,特别是玻璃化冷冻对猪卵母细胞的超微结构的影响等方面的研究,目前国内报道较少,本研究利用透射电镜技术对玻璃化冷冻前后的GV期和MII期猪卵母细胞超微结构变化进行了研究,旨在为研究猪卵母细胞的玻璃化冷冻机制提供理论依据。
1 材料与方法
1.1 卵母细胞的收集和体外成熟培养 猪卵巢由广西大学猪场获得。卵巢取出后迅速放入35℃~37℃的0.9%NaCl溶液(添加75 mg/L青霉素和50 mg/L链霉素)中,1 h内送到实验室。用18号针头的10 mL注射器选取直径3~8 mm的卵泡抽取卵丘卵母细胞复合体(COCs),放入10 mL离心管置于39℃恒温槽中静置沉淀,待15 min后,弃去上清液,用TCM-199液稀释沉淀,倒置显微镜下捡出胞质均匀,有多层卵丘细胞包裹的卵丘卵母细胞复合体。成熟液洗3次后的COCs放入39℃,5%CO2和100%湿度的培养箱培养44 h获得成熟卵母细胞。
1.2 方法
1.2.1 冷冻液与解冻液的配置 基础液(HM):TCM199+20%FCS(胎牛血清);冷冻平衡液:HM+7.5%(DMSO+EG);冷冻液:HM+17%(DMSO+EG)+0.4M Su;HM+15%(DMSO+EG)+0.5 mol/L Su;解冻液I:HM+0.5 mol/L Su;解冻液II:HM+0.25 mol/L Su;解冻液Ⅲ:HM。
1.2.2 卵母细胞的冷冻与解冻 卵母细胞经7.5%μg/mL的CB液孵育15 min后,移入平衡液预处理3~5min,形态恢复正常后,放入冷冻液处理30 s内装入半麦管,直接投入液氮中保存。解冻时,取出半麦管,快速将含卵母细胞端浸入已平衡好的解冻液I中5 min,移入解冻液II,解冻液III中分别5 min,洗涤数次,放入培养箱中恢复培养待用。
1.2.3 透射电镜样品制备 卵母细胞经PBS清洗数次,2.5%戊二醛4℃条件下固定2 h后,PBS洗涤3次。用2%琼脂聚集卵母细胞,锇酸固定2 h,PBS洗涤3次。梯度乙醇脱水,环氧丙烷置换,纯Epon 812中包埋。显微镜下修块,半薄切片,进行定位,超薄切片,200目铜网捞片,干燥,醋酸双氧铀-柠檬醋酸双重染色,透射电镜下观察并拍照。
1.3 数据统计分析 每组试验重复5次,数据采用SPSS软件统计分析,进行X2显著性检验。
2 结果及分析
2.1 GV期卵母细胞超微结构观察 GV期卵母细胞与透明带连接紧密,微绒毛(Mv)呈细长状伸入透明带(ZP)中,长短不一,皮质区分布大量的线粒体(Mi)(图1a)。质膜下极少见皮质颗粒,皮质区还可见大量成簇的长管状结构(图1b)。皮质区散在高尔基体(Ga)及囊泡样结构(图1c)。线粒体一般呈圆形,椭圆形,少数呈不规则形,大小不规律,线粒体清晰的双层膜结构,电子密度较高。细胞质内可见许多脂滴(LD),可分为两种,一种为灰色脂滴(GLD),一种为深色脂滴(DLD),且脂肪滴的周围由内质网不连续包裹着,线粒体与脂滴相伴出现(图1d)。
2.2 MII期卵母细胞超微结构观察 MII期卵母细胞达到成熟的第一特点排出第一极体,极体的细胞核包围大量的粗面内质网使其呈现指纹状,极体位于透明带及卵母细胞之间,与卵母细胞紧密相连(图1e)。MII期卵母细胞达到成熟的第二特点为排列在质膜下的大量的皮质颗粒(CG),皮质颗粒为黑色圆形颗粒(图1e)。皮质区微绒毛(Mv)缩短成矮柱状,线粒体(Mi)散在分布且贴近细胞膜,呈现向细胞内逐渐增多的趋势(图1f)。透明带与细胞间形成较大的卵周隙(PVS)(图1g)。线粒体呈圆形,内膜形成的嵴清晰可见,细胞内部线粒体聚集存在。深色脂滴和灰色脂滴由内质网形成边界,可观察到线粒体及内质网伴随脂滴分布,皮质区主要分布深色脂滴,且比灰色脂滴体积要大(图1h)。
2.3 玻璃化冷冻后GV期卵母细胞超微结构的变化 玻璃化冷冻后GV期卵母细胞透明带、细胞膜损伤,微绒毛(Mv)消失(图1i),皮质区有成簇的线粒体(Mi)群,线粒体肿胀,基质不均、嵴不明显(图1j),脂滴(LD)主要为深色脂滴,包围脂滴的内质网(ER)不完整、电子密度较高(图1k),伴随脂滴有肿胀的线粒体分布。胞质内溶解为絮状,有大量空泡,未见高尔基体(Ga)(图1l)。
2.4 玻璃化冷冻后MII期卵母细胞超微结构的变化 玻璃化冷冻后MII期卵母细胞透明带(ZP)损伤,边缘不平整,微绒毛、细胞膜损伤甚至消失(图1m)。皮质颗粒排列在质膜下,但数量减少(图1n)。皮质区以深色脂滴为主,脂滴外围包裹的内质网破损或消失(图1o)。细胞内部以灰色脂滴为主,但脂滴部分溶解,相互连接(图1p),脂滴周围伴随大量肿胀呈圆形的线粒体,大小不一,线粒体嵴不明显,有的线粒体电子密度增大(图1p)。
3 讨论
合理选择冷冻保护剂,运用适当的冷冻方法可以有效提高冷冻保护作用,减少冷冻损伤。细胞松弛素B(CB)[6]是一种细胞骨架稳定剂,可以通过调节细胞骨架柔韧性达到降低卵母细胞低温敏感的效果。目前CB已经成功应用于牛[7]、猪[8]、山羊[9]等多种动物的卵母细胞冷冻保护中并起到了积极的保护作用。对于猪卵母细胞的冷冻前处理还有离心去脂,化学去脂等,但尚未得到一致有效结果。因此为获得良好的冷冻效果,本研究采用了CB冷冻前预处理卵母细胞。
卵母细胞中线粒体分布广泛,容易受到发育环境的影响。老年小鼠的MII期卵母细胞线粒体的异常定位率显著高于青年小鼠[10],说明卵母细胞的后续发育能力受线粒体的正确空间定位的支配。戴建军[11]用罗丹明123对猪卵母细胞冷冻后的线粒体进行观察,发现线粒体变得模糊粗糙,线粒体嵴减少或者消失,冻融后线粒体的正常率只有50%左右,说明线粒体的损伤是造成卵母细胞解冻后发育能力减弱的因素之一。朱淑文等[12]采用平皿-玻璃化冷冻猪卵母细胞,结果发现,猪卵母细胞经冷冻后对线粒体的损伤并不严重,只有少部分线粒体电子致密度下降、体积膨大和嵴消失,显示平皿-玻璃化冷冻猪卵母细胞对线粒体损伤较轻。本研究发现,半麦管法玻璃化冷冻对成熟前后的卵母细胞的线粒体都有严重损伤,说明不同的冷冻方法和不同的冷冻载体对线粒体冷冻损伤程度不同。
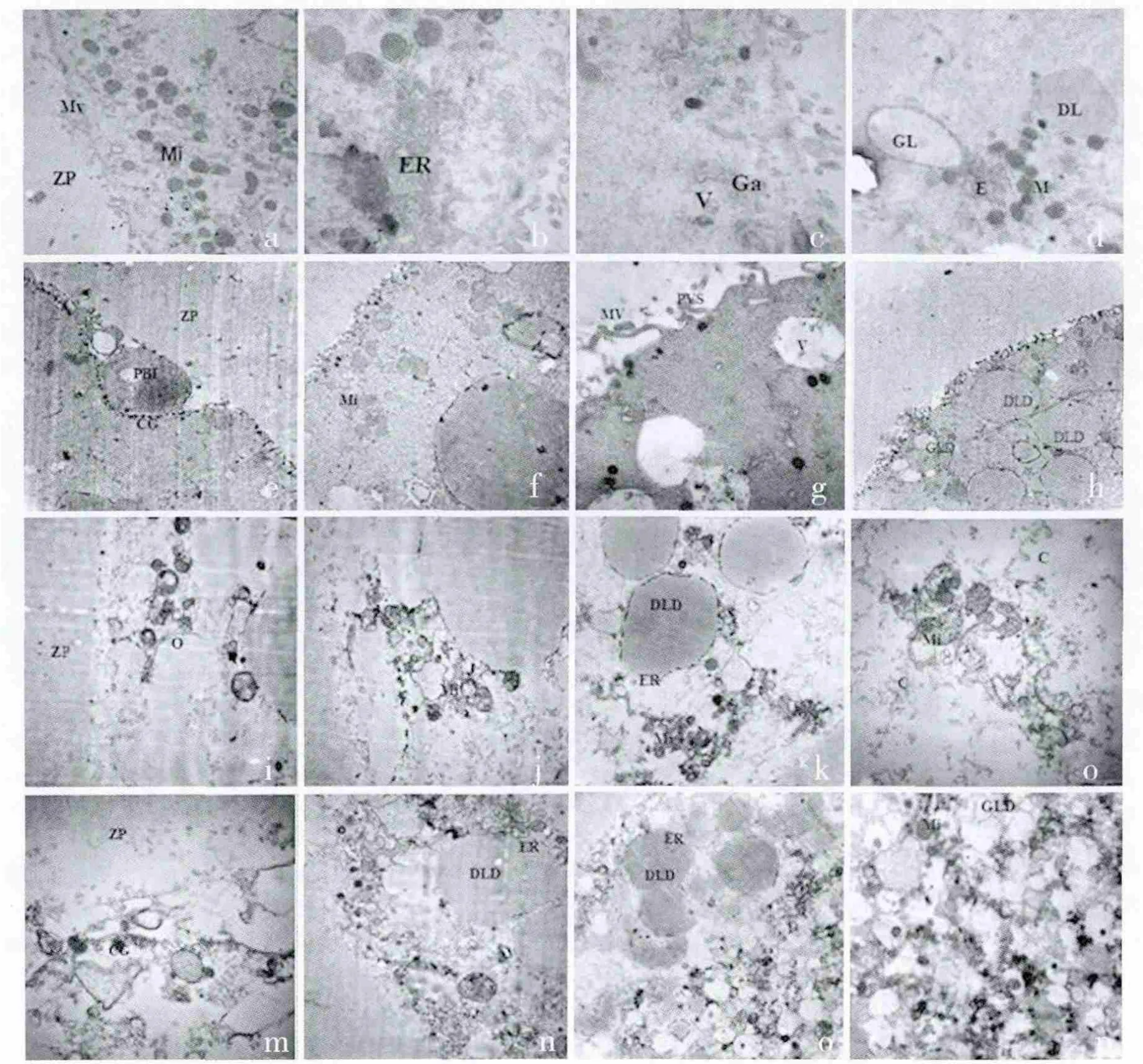
图1 玻璃化冷冻对猪卵母细胞超微结构的影响
透明带由少数几种糖蛋白组成,是包裹在哺乳动物卵母细胞外侧,负责调控和调节受精的各个步骤。因为精子要先结合到透明带上,引发顶体反应从而穿透透明带,才可以与卵质膜的特异受体相融合,进而正常受精,当精质膜与卵质膜融合后才会释放皮质颗粒[13]。有研究表明,玻璃化冷冻会造成透明带硬化,影响卵母细胞受精作用[14-15]。张德福[16]用0.5%链酶蛋白酶处理胚胎后,发现透明带消化虽然没有提高存活率,但显著提高了囊胚率。说明冻融后透明带结构的改变制约了胚胎的发育能力。冻融后卵母细胞微绒毛减少,消失可能会减弱卵母细胞的发育能力[17]。而武彩红[18]的研究却发现,用链酶蛋白酶消化透明带的时间显著低于新鲜卵母细胞,并提出冷冻未造成透明带硬化。但该研究仅对消化时间进行统计,并未进行发育能力的研究。
猪的卵母细胞的特点是含有大量的脂滴,脂滴分为深色脂滴和褐色脂滴两种,通常脂滴周围由内质网包裹。不同动物所含脂滴含量有所区别,猪和狗卵母细胞内所含脂滴较多,鼠类卵母细胞所含脂滴较少[19]。近年来的研究,也围绕如何克服脂滴的低温敏感性而大量展开。陆文昊[20]采用化学去脂法和离心法处理MII期卵母细胞发现,化学去脂后的卵母细胞进行玻璃化冷冻可以获得较高的卵裂率和囊胚率,化学去脂对提高MII期卵母细胞的玻璃化冷冻效果是有效的。说明脂滴的冷冻损伤是导致卵母细胞玻璃化冷冻后发育能力减弱的因素之一。本研究发现冻融后的卵母细胞脂滴形态破坏,形成空泡化,内质网与脂滴的联系损坏,与上述研究结果相一致。
卵母细胞还具有一个特殊的细胞器是皮质颗粒,当卵母细胞未成熟时,皮质颗粒分泌较少且散在分布于细胞质中,当卵母细胞逐渐成熟皮质颗粒开始向质膜迁移,卵母细胞达到成熟后,皮质颗粒在质膜下呈单层连续排列。皮质颗粒在皮质下的单层排列也是卵母细胞达到成熟的一大标志[13-14],说明本研究所观察的MII期卵母细胞已达成熟。本研究发现在冷冻解冻后的卵母细胞中很少见到皮质颗粒,可能是冷冻剂的处理和低温造成皮质颗粒提前释放,这与Myers等[19]报道的由于冷冻保护剂中渗透压的作用导致皮质颗粒发生胞吐作用及质膜的破损基本一致,也与朱淑文等[12]采用平皿-玻璃化冷冻猪卵母细胞对皮质颗粒影响一致。
[1]朱捷,张忠诚,刘泽泉.猪卵母细胞在玻璃化冷冻液中的培养效果[J].中国畜牧杂志,1995,31(5):8-9.
[2]戴建军,吴彩凤,张廷宇,等.3种冷冻方法对猪MII期卵母细胞线粒体分布和损伤的影响[J].畜牧兽医学报,2012,43(10):1525-1530.
[3]朱淑文,张菁,华修国,等.玻璃化冷冻对猪卵母细胞超微结构的影响,上海交通大学学报(农业科学版),2006,24(2):121-126.
[4]刘跃男,朱虎山,金一,等.冷冻保存对猪卵母细胞超微结构及发育潜力的影响[J].国外畜牧学-猪与禽,2007(06):79-80.
[5]张德福,戴建军,吴彩凤,等.猪胚胎玻璃化冷冻保存技术的优化[J].生物工程学报,2009,25(7):1095-1100.
[6]王磊.猪卵母细胞孤雌激活及玻璃化冷冻的研究[D].南京:南京农业大学,2009.
[7]卞桂华,陈自洪,杨娟,等.细胞松弛素B(CB)对水牛卵母细胞玻璃化冷冻保存的影响[J].黑龙江畜牧兽医,2008(07):34-36.
[8]刘跃男,金一,方南洙,等.抗冻剂、CB和离心极化对猪GV期卵母细胞冷冻效率的影响[J].西北农林科技大学学报(自然科学版),2009,37(01):29-33.
[9]刘凤军,张玉玲,赵明涛,等.CB处理和胞质去除对山羊孤雌胚体外发育的影响[J].农业生物技术学报,2006(05):31-36.
[10]岳明星,朱士恩,侯云鹏,等.老龄化对昆明系小鼠卵母细胞发育能力影响的研究[C].中国畜牧兽医学会动物繁殖学分会第十六届学术研讨会,哈尔滨:2012.
[11]刘海军,张美佳,侯蓉,等.OPS玻璃化冷冻对山羊卵母细胞超微结构的影响[J].西北农林科技大学学报(自然科学版),2001,29(3):9-12.
[12]Carroll J,Depypere H,Matthews C D.Freeze-thaw-induced changes of the zona pellucida explains decreased rates of fertiliza⁃tion in frozen-thawed mouse oocytes[J].Reprod Fertil,1990,90:547-553.
[13]武彩红.猪卵母细胞的超低温冷冻保存及影响其冻后发育能力的机理研究[D].南京:南京农业大学,2006.
[14]武彩红,李玲,张斌,等.冷冻对猪体外成熟卵母细胞透明带消化时间和皮质颗粒分布的影响[J].江苏农业科学,2010(05):280-281.
[15]邱志芳.牛早期卵母细胞和成熟前后的超微结构变化[D].合肥:安徽农业大学,2006.
[16]陆文昊.猪MⅡ期卵母细胞玻璃化冷冻的研究[D].合肥:安徽农业大学,2010.
[17]Loos F.Structural aspects of bovine oocyte maturation in vitro[J].Mol Reprod Dev,1992,31:208.
[18]De Loos F,Van Vliet C,van Maurik P V,et al.Morphology of im⁃mature bovine oocytes[J].Gamete research,1989,24(2):197-204.
[19]Myers S P,Lin T T,Pitt R E,et al.Cryobehavior of immature bo⁃vine oocytes[J].Cryo-Lett,1987,8:260-275.
