C-fos对体外培养仔猪睾丸间质细胞睾酮分泌的影响
2015-08-08吕双阳袁冬梅史亚利吕朋沙方志超郑小波
吕双阳,袁冬梅,许 洁,史亚利,肖 榕,吕朋沙,方志超,郑小波
(西南大学荣昌校区动物医学系,重庆 荣昌 402460)
睾丸间质细胞(interstitialcell)又称leydig cell,它是合成分泌雄性激素等物质的内分泌细胞,分布于睾丸生精小管间的疏松结缔组织中[1]。睾丸间质细胞还具有调节功能,通过自分泌作用影响支持细胞从而间接作用于生殖细胞调节精子的生成[2]。因此,睾丸间质细胞能够促进和发挥多种生理功能。探讨睾丸间质细胞的作用,可以促进对精子发生机制和雄性生殖生理功能的研究。
C-fos是一种核内原癌基因,用免疫组织化学和原位杂交等方法发现在LC有原癌基因C-fos的表达[3]。许多研究已证实LC分泌睾酮伴有某些原癌基因表达的变化,特别是一些即早基因(如C-jun、C-fos等)表达的变化。况海斌,方立异等证实反义C-fos ASODNs能呈剂量相关方式抑制HCG诱导的大鼠间质细胞睾酮的产生,而无义tat ODNs由于与C-fos无同源互补序列,未观察到类似的作用[4]。Schultz等研究证实,C-fos参与调控生精上皮更新期间生精细胞增殖、分化活动[5]。从文献中可以看出,国内外的学者对C-fos的早期研究主要集中于体外培养的细胞,近年来转向体内,并且主要集中在人和鼠睾丸间质细胞睾酮分泌的量和对睾酮合成途径各关键酶的影响上,很少涉及到C-fos对猪及C-fos对睾丸间质细胞睾酮分泌的影响。作者以荣昌仔猪为材料,通过反义核酸技术观察C-fos对仔猪睾丸间质细胞睾酮分泌的影响,为深入研究雄性睾酮分泌的机制提供依据。
1 材料与方法
1.1 主要试剂 RPMI-1640培养基(GIBCO公司);胎牛血清(HyClone公司);HCG、Ⅱ型胶原酶(Sigma公司)、仔猪睾酮ELISA检测试剂盒(上海泛柯生化试剂公司)。C-fos ASODNs稀释:稀释前12000 r/min(4℃)离心5 min,使C-fos ASODNs聚集至管底,小心开启管盖,加入适量稀释液,并盖好管盖,于漩涡混合器上使其充分溶解,稀释浓度分别为0.125、0.25、0.5、1、2μmol/L,分装并-20℃保存。
1.2 试验动物 健康3周龄的荣昌公猪。
1.3 试验方法
1.3.1 C-fos ASODNs的合成 通过对荣昌仔猪C-fos基因序列的扩增,选取高度亲和力、基于mRNA高级结构模拟、自由能计算合理、基因组中无同源性序列按要求设计C-fos ASODNs及无义核酸。然后由TaKaRa公司合成,分别对首位3个碱基进行硫代磷酸化修饰。引物序列如下:
反义寡核苷酸:5′-CGGTGAGTGGTAGTAGGA GAGA-3′,无义核酸:5′-GTGTCGGTAGGACTGTG⁃GTATG-3′。
1.3.2 仔猪睾丸间质细胞的分离和培养 无菌条件下采集3周龄的仔猪睾丸,放入冰浴的PBS中(PBS中抗生素浓度加倍),尽快送回实验室。首先用酒精棉球对睾丸表面进行消毒,并置于灭菌平皿中,然后用PBS和双抗清洗睾丸,重复3次,用眼科剪、眼科镊去除睾丸表面结缔组织,剥去被膜和鞘膜。再将睾丸移入另一个灭菌平皿中,用不完全培养基清洗3遍,并将睾丸组织剪碎至1 mm3的小块,加入完全培养基,收集组织液,1000 r/min离心5 min,保留沉淀组织并重复3次,将沉淀组织移入烧杯中,加入5 mL不完全培养基和5 mL 0.5 mg/mL胶原酶消化液,37℃消化60 min,收集消化液,用适量完全培养基稀释后并1000 r/min离心5 min,弃上清,重复2次,向沉淀中加入适量完全培养基,并用移液枪反复吹吸使之均匀散开,然后用200目铜网筛过滤得到单细胞悬液,通过台盼蓝染色观察细胞活力,3β-HSD酶活性检测细胞纯度。根据计数结果将间质细胞稀释至所需浓度,37℃,5%CO2,饱和湿度下培养。
1.3.3 不同浓度C-fos ASODNs和无义tatODNs影响基础状态下间质细胞睾酮合成 按照1.3.2培养间质细胞。将试验组培养的细胞分为6组,分别加入不同浓度的C-fos ASODNs,即0、0.125、0.25、0.5、1、2μmol/L,每个处理设3个重复。37℃培养24 h后,培养液离心(1500 r/min离心5 min),收集培养液待测。无义tat ODNs作对照组,处理方法与试验组相同。
1.3.4 不同浓度C-fos ASODNs在HCG诱导下影响间质细胞睾酮合成 按照1.3.2培养间质细胞。将试验组培养的细胞分为6组,分别加入50 IU/mL的HCG以及不同浓度的C-fos ASODNs,即0、0.125、0.25、0.5、1、2 mol/L,每个处理设三个重复。37℃培养24 h后,培养液离心(1500 r/min离心5 min),收集培养液待测。对照组无义tat ODNs代替C-fos ASODNs,处理方法与试验组相同。
1.4 检测方法 取出酶标板,依照次序对应分别加入50μL的标准品于空白微孔中;分别标记样品编号,加入50μL样品于空白微孔中;在标准品孔和样品孔中加入100μL的酶标记溶液;37℃孵育反应60 min;浓缩洗液与医用蒸馏水1∶20倍稀释后清洗酶标板5次,每次静置10 s~20 s;每孔加入底物A、B液各50μL;37℃下避光孵育反应15 min;每孔加入50μL终止液,终止反应。在波长450 nm的酶标仪上测定OD值,通过标准曲线得出睾酮浓度值(相关系数0.812)。
1.5 统计学分析 采用Excel、SPSS11.5 For Win⁃dows等统计软件进行数据分析,组间计量资料的比较采用非配对t检验,P<0.05时有统计学意义。
2 结果
2.1 体外培养仔猪睾丸间质细胞的功能
2.1.1 台盼蓝细胞活性检测 采用红细胞计数方法计算无色透明的细胞数量,在倒置显微镜下观察经台盼蓝染色的细胞悬液,活细胞呈无色透明,蓝色为死细胞,其存活率为(91.0±4.6)%(n=5)。
2.1.2 3β-HSD细胞纯度检测 在倒置显微镜下观察经3β-HSD染色的细胞悬液,细胞质中含有蓝色颗粒细胞即为睾丸间质细胞,间质细胞百分率为(84.9±3.5)%(n=5)。
2.2 不同浓度C-fos ASODNs和无义tat ODNs对基础状态下仔猪睾丸间质细胞睾酮分泌的影响 仔猪睾丸间质细胞(1×108细胞/mL)与不同浓度的C-fos ASODNs(0,0.125,0.25,0.5,1,2 μmol/L)在37 ℃条件下共同培养24 h。间质细胞分泌的睾酮随着C-fos ASODNs浓度的增加而降低,两者呈明显的负相关关系(R=-0.611,P<0.01)。在0.125μmol/L C-fos ASODNs时可显著抑制睾酮产生(P<0.01)。随着C-fos ASODNs浓度增加对睾酮分泌抑制作用增加,呈计量依赖关系。而1μmol/L C-fos ASODNs以后的浓度,睾酮分泌处于相对稳定水平,而无义tat ODNs无此关系(图1)。
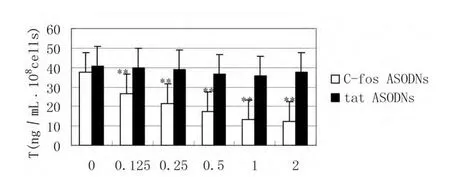
图1 不同浓度C-fosA S O D Ns与基础状态下仔猪睾丸间质细胞睾酮分泌的关系
2.3 不同浓度C-fos ASODNs对HCG诱导仔猪睾丸间质细胞睾酮分泌的影响 通过对仔猪睾丸间质细胞(1×108细胞/mL)、50 IU/mL HCG和不同浓度的C-fos ASODNs(0,0.125,0.25,0.5,1,2 μmol/L)在37℃条件下共同培养24 h,结果显示睾酮分泌随着C-fos ASODNs浓度的增加而降低,两者呈明显的负相关关系(R=-0.776,P<0.01),C-fos ASODNs浓度增加对睾酮分泌的抑制作用增强。在0.125μmol/L C-fos ASODNs时可显著抑制睾酮产生(P<0.01)。而无义tat ODNs无此关系(P>0.05)(图2)。
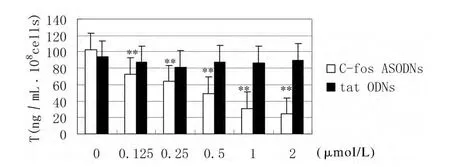
图2 C-fosA S O D Ns和HCG诱导仔猪睾丸间质细胞睾酮分泌的关系
3 讨论
原癌基因(proto-oncogene),又称细胞癌基因,是广泛存在于细胞基因组的正常成分,常与正常细胞的生长调控直接相关。有资料表明,原癌基因参与性腺功能的调控[6]。c-fos原癌基因属于myc家族,在促进性腺激素、生长因子等方面有重要作用,能即刻、短暂表达,故被称为即刻早期反应基因[7]。
睾丸间质细胞主要功能是分泌睾酮,分泌活动受丘脑下部、垂体及自身的调节。动物体内95%左右的睾酮是睾丸间质细胞分泌的。睾酮被运输到身体各处的靶器官,通过与受体结合发挥重要的生理功能[8]。有文献表明,C-fos的表达能促进小鼠的睾丸间质细胞分泌睾酮。这种作用是C-fos表达后,其产物与AP-1位点结合,诱导某些晚期基因转录,后经过一系列酶的作用,促进睾酮的合成和分泌[4]。在荣昌仔猪的睾酮分泌中,基础状态下间质细胞分泌的睾酮随C-fos ASODNs浓度的增加而降低,而对照组的无义tat ODNs,睾酮的分泌量变化不大。这说明C-fos能促进仔猪睾丸间质细胞睾酮的生成,即C-fos ASODNs浓度增加,睾丸间质细胞抑制增加,睾酮分泌下降。
近年来研究显示,HCG引起睾丸间质细胞睾酮分泌的同时伴有C-fos原癌基因表达的增强[9]。当HCG浓度为50 IU/mL时,大鼠睾丸间质细胞睾酮的分泌最强,那么在HCG诱导的荣昌仔猪睾酮分泌中作用如何呢?本试验利用反义核酸技术,以目的基因C-fos序列为蓝本,合成反义寡核苷酸与特定的C-fos基因序列形成特异性结合,抑制或封闭该基因的转录和表达,使其丧失功能,因而研究原癌基因C-fos对HCG诱导仔猪间质细胞睾酮生成的影响。结果发现,C-fos ASODNs呈剂量依赖性的抑制HCG诱导的仔猪间质细胞睾酮分泌,在0.125μmol/L C-fos ASODNs时可显著抑制睾酮产生,而无义tat ODNs无此关系。研究结果显示,C-fos具有促进HCG诱导的仔猪间质细胞睾酮分泌的作用。
[1] Klinefelter G,Hall P,Ewing L.Effect of luteinizing hormone de⁃privation in situ on steroidogenesis of rat Leydig cells purified by amultistep procedure[J].Biol Reprod,1987,36:769-783.
[2]况海斌,方廉.原癌基因与睾丸功能的关系[J].中华男科学,2003,9(5):377-380.
[3]郑月慧,徐斯凡,方廉.癌基因与性腺功能[J].生理科学进展,1996,27:344-346.
[4]况海斌,方廉,徐斯凡,等.C-fos对大鼠间质细胞睾酮生成的影响及其作用机理[J].江西医学院学报,2005,45:24-27.
[5]Romero C H,Meade P N,Schultz J E,et al.Epidemiological As⁃pects of Pseudorabies Virus Indigenous to Feral Swine(Sus scro⁃fa)in Florida[J].USA.2003北京国际养猪研讨会暨展览会论文集,2003,9.
[6]Suto R,Tominaga K,Mizaguchi H,et al.Dominant-negative mutant of c-jun gene transfer:a novel therapeutic strategy for colorectal cancer[J].Gene Ther,2004,11(2):187-193.
[7]Schuhz R,Kononen J,Peho-Huikko M.Induction of immediate early gene mRNAs and proteins by hCG in interstitial cells of rat testis[J].Endocrinal,1995,144(3):417-424.
[8]Dale B,Hales,Anita H,et al.Ginovo synthesis in culturedLeydig cells[J].Ocorticoid-mediated repression of P450scc mRNA and de Endocrinology,1999,124(5):2099-2103.
[9]况海斌,方廉,王斯长,等.反义C-fos寡脱氧核苷酸对HCG诱导大鼠睾丸间质细胞睾酮分泌的影响[J].基础医学与临床,2003,23(6):682-683.
