树鼩2型糖尿病模型的构建及其相关因素分析
2015-08-07黄霞潘兴华庞荣清蔡学敏阮光萍
黄霞,潘兴华,庞荣清,蔡学敏,阮光萍
树鼩2型糖尿病模型的构建及其相关因素分析
黄霞,潘兴华,庞荣清,蔡学敏,阮光萍
目的为干细胞治疗研究构建2型糖尿病(T2DM)树鼩模型,并对相关因素进行分析。方法采用高糖、高脂饲喂联合腹腔注射链脲佐菌素(STZ)100mg/kg方法构建树鼩T2DM模型。造模后第6 w腹腔注射STZ,在注射STZ前和注射后的每2 w,测定空腹血糖(FBG)、胰岛素(FINS)、C肽、胰岛素抵抗指数(HOMA-IR)、总胆固醇(TC)、甘油三酯(TG)、糖化血红蛋白(HbA1c)、口服葡萄糖耐量试验(OGTT)等指标;自造模后的第8、16 w,观察胰腺、肝、肾脏的病理组织形态变化,检测血清TNF-α、IL-6表达水平。结果造模后,FBG持续升高,FINS、C肽先升高后下降,出现胰岛素抵抗;TG和TC在造模后持续升高,12 w后稳定在较高水平;肝、肾、胰腺器官表现为特征性的病理变化,且血清中TNF-α和IL-6增高。结论饲喂高糖、高脂饲料+腹腔注射STZ成功构建树鼩T2DM模型,出现T2DM特征性病理变化,炎症细胞因子可能参与了T2DM的病理过程。
树鼩;2型糖尿病;链脲佐菌素;模型
2型糖尿病(T2DM)是以胰岛素抵抗、胰岛素敏感性下降和糖、脂代谢紊乱为特征的代谢性疾病[1]。研究发现,链脲佐菌素(Streptozocin,STZ)有针对性地破坏胰岛β细胞,可诱导糖尿病的产生[2]。目前对T2DM进行了大量的研究,但结果差异较大。树鼩是灵长类动物的近亲[3],易于模拟人类T2DM的病理过程。本研究拟通过注射STZ来创建树鼩T2DM模型,并动态观察模型树鼩一般情况、生化、病理及细胞因子与临床的符合程度,分析相关因素,以期为干细胞治疗研究提供较稳定的树鼩T2DM模型。
1 材料与方法
1.1 动物健康树鼩48只,由中国科学院昆明动物研究所实验动物中心提供,为中缅树鼩滇西亚种,体重120~140 g。动物房内常年保持通风换气、清洁。
1.2 材料与仪器STZ(Sigma公司);Human IL-6 ELISA Kit和Human TNF-αELISA Kit(联科生物技术有限公司);微量血糖仪(罗氏公司G10592137型)。
1.3 试剂配制方法A液:柠檬酸4.2 g加水至200m l;B液:柠檬酸钠5.88 g加水至200 ml;A液和B液按56%和44%的比例混合,调节pH值在4.2~4.3,0.22μm过滤器除菌,4℃冰箱储存备用。基础饲料和高糖、高脂饲料均由昆明医科大学动物室研究配置。
1.4 T2DM模型制作动物适应性喂养2 w,检测HbA1c、空腹血糖水平(FBG)、空腹胰岛素水平(FINS)、C肽、TC、TG及胰岛素抵抗指数(HOMAIR)正常后纳入实验。将48只动物随机分为2组,对照组8只、实验组40只。对照组以基础饲料喂养;实验组每天上午8点开始定时定量饲喂高糖、高脂饲。两组均一日三餐,中间加喂1次苹果,定量饮水。饲喂6 w后,实验组禁食不禁水12 h,然后腹腔注射STZ 100mg/kg,对照组注射等量生理盐水。注射后72 h测FBG,实验组低于11.1mol/L者再腹腔注射STZ(100mg/kg)1次。自造模起观察记录树鼩精神状态、活动度、毛色、饮食、排泄等情况。
1.5 检测指标
1.5.1 FBG自造模后第6 w开始,每隔2 w,动物禁食12 h,次日尾尖取血,罗氏微量血糖仪测量FBG。另外,采集1ml尾静脉血,由本院检验科测定TC、TG、FINS、HbA1c、C肽水平。HOMA-IR=FBG(mmol/L)×FINS(m IU/L)/22.5。
1.5.2 口服葡萄糖耐量试验(OGTT)自造模后第8、16 w,两组均禁食12 h,测定FBG;称体重后,用50%葡萄糖3.59 ml/kg灌胃,灌胃后15、30、60、90min树鼩尾尖采血测定血糖水平。
1.5.3 IL-6、TNF-α两组均于第8、16 w尾静脉釆血1 ml,离心收集血清,按ELISA试剂盒说明书方法操作,测定IL-6、TNF-α水平。
1.6 病理组织学分析造模后16 w,两组动物各脱颈处死2只,分别取胰腺、肝脏、肾脏组织,4%多聚甲醛固定,常规石蜡切片,HE染色,光镜下观察并照相。
1.7 统计学处理采用SPSS 17.0统计软件进行统计学分析,结果以均数±标准差表示,组间比较采用两独立样本t检验,组内采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 T2DM模型制作情况在腹腔注射STZ 1~2次后,造模成功率90%。对照组8只动物状态良好,无死亡;实验组40只动物有4只死亡,并可见多饮、多食、多尿、消瘦,毛无光泽,晚期尾部、腿部有溃疡形成。
2.2 两组FBG、FINS、C肽、HOMA-IR、TG、TC、体重、OGTT的变化实验组FBG在注射STZ后持续升高(12.5~22.9 mmol/L),与对照组比较差异显著(P﹤0.05),对照组整个研究过程中FBG变化不大(2.9~3.0mmol/L);FINS、C肽、HOMA-IR在实验组显著升高,第6 w时达到高峰,之后逐渐降至接近对照组水平(P﹤0.05);与对照组比较,实验组TG和TC在造模后持续升高(P﹤0.05),12 w后稳定在较高水平;体重在造模后先上升(P﹤0.05)后下降,到16 w时低于对照组(P﹤0.05),符合T2DM模型的特点。见图1。

高糖、高脂喂养8 w、16 w时检测OGTT,实验组血糖顶峰均在5 min出现,对照组血糖高峰在10 min出现,而后迅速下降,90min后降至正常水平;与对照组比较,实验组8 w时血糖顶峰过后迅速下降,16 w血糖顶峰过后下降稍缓慢,90 min后两组血糖均未下降到正常水平。见图2。
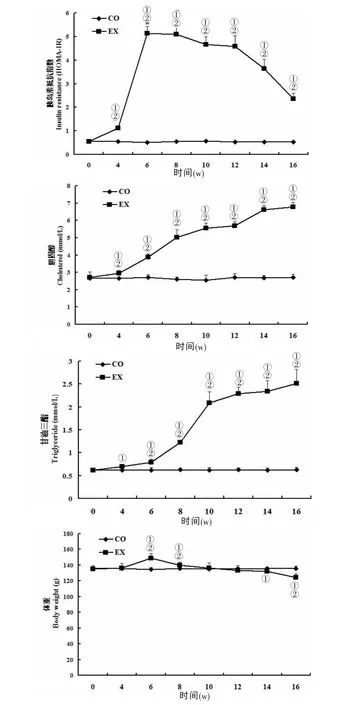
图1 两组FBG、FINS、C肽、HOMA-IR、TG、TC、体重的动态变化
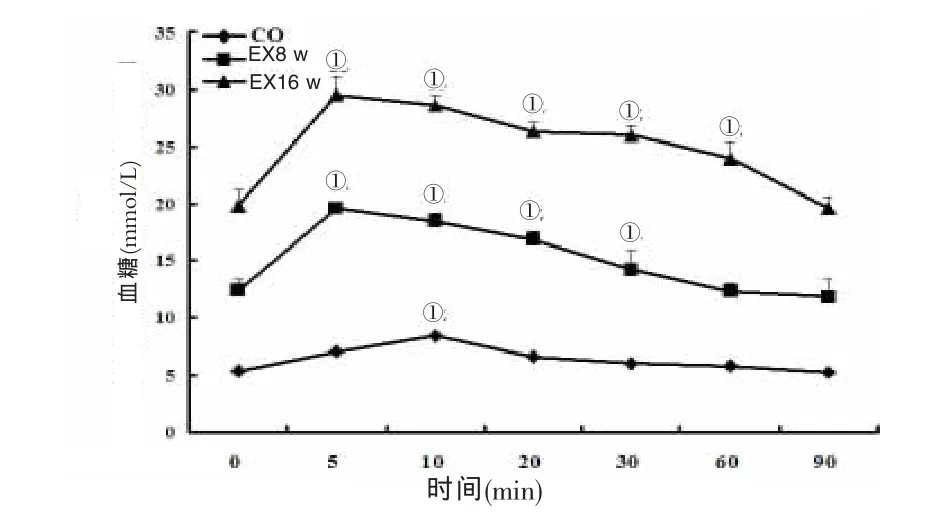
图2 两组OGTT的动态变化
2.3 T2DM树鼩HbA1c的变化HbA1c在临床实践中被用作糖尿病患者血糖控制的金标准,其优势在于可反映受检者近2~3个月的平均血糖。在造模前0 w和造模后16 w,对照组HbA1c分别为(4.71±0.22 )mmol/L和(4.39±0.49)mmol/L,均<5mmol/L,实验组HbA1c分别为(4.95±0.80)mmol/L和(8.01±0.50)mmol/L,均>7 mmol/L,说明实验动物在造模前无自发性糖尿病存在,而实验组16 w时,发生糖尿病。
2.4 T2DM树鼩肝脏、肾脏及胰腺的病理学变化与对照组比较,实验组树鼩肝脏肝索混乱、肿胀、萎缩,呈脂肪变性和空泡变性,嵴断裂,可见点状坏死,汇管区有炎细胞浸润。肾小球体积增大、髓袢腔扩张、系膜增生和硬化、基底膜增厚、内皮细胞泡沫样变,出入球动脉透明样变以及间质血管损伤,毛细血管基底膜增厚,肾小囊腔狭窄。实验组胰岛萎缩,形态极不规则,胰岛细胞数目减少,周围结缔组织和基膜不完整,胰岛细胞肿胀,空泡增多,细胞核固缩,染色质分布不均、部分细胞核缺失,细胞容积减低,胞浆变浅,胞核固缩,部分胰岛细胞坏死。见图3。
2.5 TNF-α及IL-6在T2DM树鼩血清中的变化
实验组8 w及16 w的TNF-α及IL-6的表达均较对照组升高(P﹤0.05,图4)。
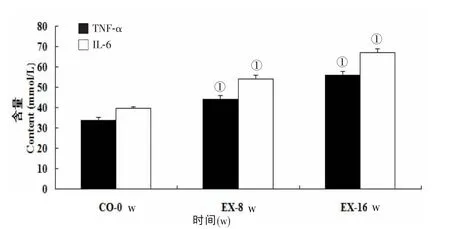
图4 两组不同时间血清TNF-α及IL-6的比较
3 讨论
糖尿病与细胞免疫和体液免疫异常有很高的关联度[4]。本研究所采用的高糖高脂饲料喂养联合腹腔内注射STZ的方法,成模率高达90%,病程接近自然,病死率低,模型稳定,STZ腹腔注射保证了动物模型的成功率[5]。本研究实验组动物喂养6 w后,已经出现明显的胰岛素抵抗,此时给予STZ腹腔注射,在后续的相关因素观察中,未出现倾向于T1DM及病死率增加,这与之前的研究有所出入,可能是物种的不同对高糖、高脂饲料的反应不同所致[6]。另外,长期高糖、高脂能诱导动物产生胰岛素抵抗,其机制可能是高脂、高胆固醇、高糖饮食导致体内葡萄糖和脂质代谢的紊乱,降低胰岛素敏感性,联合小剂量STZ腹腔内注射可导致胰腺分泌胰岛素功能的进一步障碍,诱发高血糖,导致T2DM[7]。
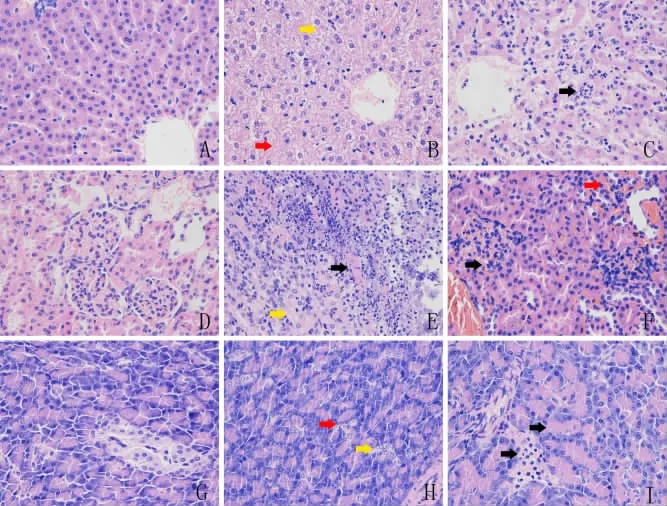
图3 树鼩肝脏、肾脏及胰腺的病理学变化(HE染色×400)
T2DM的特点包括胰岛素抵抗和糖代谢紊乱,以及脂肪和蛋白质代谢紊乱。本研究发现,造模后,动物血糖显著升高,而胰岛素、C肽呈先升高后下降的变化,出现有明显的胰岛素抵抗。同时,总胆固醇、甘油三酯持续升高,12 w后稳定在一个较高的水平。另外,肝脏、肾、胰腺均出现较明显的T2DM对靶器官的损伤。这些均提示T2DM造模成功。C肽可作为评定胰岛功能的指标,弥补单独应用血糖的不足,较胰岛素更能准确反映β细胞的分泌能力,可作为检测胰岛素内源性分泌评价指标[8]。脂代谢紊乱是T2DM糖代谢异常的始动因素,机制可能是T2DM胰岛素的降低及IR使脂蛋白脂肪酶活性低下,肝脏合成TG的速度大于释放的速度,进入血液循环中的TG不能被及时消除,导致TG在肝内堆积而形成高甘油三酯血症[9]。本研究也发现,血糖、总胆固醇及甘油三酯虽然高峰不在同一时间点上,但总体水平均随T2DM的进展而不断升高,它们之间存在相互促进、互为因果的关系。
近年来认为,T2DM是一种先天性免疫和低度慢性炎症性疾病[10]。TNF-α与IL-6作为最具代表性的细胞因子,在炎症和免疫反应中起核心调节作用。在DM的发病过程中,TNF-α与IL-6反应性升高可导致包括胰岛在内的全身性炎症反应和加速胰岛β细胞的破坏。本实验也发现,这两个因子在实验组较对照组显著升高。
本研究建立的树鼩T2DM模型的血液生化指标、细胞因子及肝、肾、胰腺结构变化与临床T2DM的病变特点及病理过程相符合,与人类T2DM高度相似,可作为干细胞治疗T2DM的动物模型。
[1]Halperin F,Lopez X,Manning R,et al.Insulin augmentation of glucose-stimulated insulin secretion is impaired in insulinresistant humans[J].Diabetes,2012,61(2):301-309.
[2]朱超,朱莹莹.Ⅱ型糖尿病动物模型的构建[J].中国实验动物学报,2013,21(2):84-88.
[3]Schmelting B,Corbach-Sohle S,Kohlhause S,et al.Agomelatine in the tree shrew model of depression:effects on stress-induced nocturnal hyperthermia and hormonal status[J].Eur Neuropsychopharmacol,2014,24(3):437-447.
[4]Yang W,Lu J,Weng J,et al.Prevalence of diabetes amongmen and women in China[J].N Engl JMed,2010,362(12):1090-1101.
[5]De Oliveira AC,Andreotti S,Farias Tda S,et al.Metabolic disorders and adipose tissue insulin responsiveness in neonatally STZ-induced diabetic rats are improved by long-term melatonin treatment[J].Endocrinology,2012,153(5):2178-2188.
[6]吴晓云,李昀海,常青,等.链脲佐菌素诱导树鼩2型糖尿病[J].动物学研究,2013,34(2):108-115.
[7]王春田,王莉,石岩.2型糖尿病动物模型制备方法探讨[J].实用中医内科杂志,2011,25(4):27-30.
[8]Fu F,Tian F,Zhou H,et al.Semen cassiae attenuatesmyocardial ischemia and reperfusion injury in high-fat diet streptozotocininduced type 2 diabetic rats[J].Am J Chin Med,2014,42(1): 95-108.
[9]Hussein AA,Abdel-Aziz A,Gabr M,et al.Myocardial and metabolic dysfunction in type 2 diabetic rats:impact of ghrelin [J].Can JPhysiol Pharmacol,2012,90(1):99-111.
[10]Donath MY,Shoelson SE.Type 2 diabetes as an inflammatory disease[J].Nature Reviews Immunology,2011,11(2):98-107.
Construction of type 2 diabetesmellitusmodel of tree shrews and analysis of related factors
Huang Xia,Pan Xinghua,Pang Rongqing,Cai Xuemin,Ruan Guangping Cell Biological Therapy Center of Kunming General Hospital of Chengdu Military Command/Clinical College of Kunming General Hospital,Kunming Medical University/The Nation and Region Integrated Engineering Laboratory of Stem Cell and Immunocyte Biological Technology/Key Laboratory of Cell Therapeutic Transforming Medicine of Yunnan Province/Stem Cell Engineering Laboratory of Yunnan Province/Kunming Key Laboratory of Stem Cell and Regenerative Medicine,Kunming,Yunnan,650032,China
Objective To establish tree shrew type 2 diabetesmellitus(T2DM)model for the research on stem cell therapy,and to analyze the related factors.Methods T2DM model was established by the feeding with high sugar and fat combined with intraperitoneal injection with 100mg/kg streptozotocin(STZ).The intraperitoneal injection with STZ was carried out at the 6th week after themodeling,and every two weeks before and after the injection,fasting blood glucose(FBG),FINS,C peptide,HOMA-IR,total cholesterol,triglyeride,glycosylated hemoglobin,and oral glucose tolerance were detected.Since the 8th and 16th week after the modeling,observation was made in the changes in the pathological tissues of pancreas,liver,and kidney,and TNF-αand IL-6 expression levelswere detected.Results After themodeling,FBG continuously increased,while FINSand C peptide firstly increased and then decreased.Insulin resistance occurred.Meanwhile,TG and TC continuously increased after themodeling and reached to a stable high level after 12 weeks.Liver,kidney,and pancreas all showed distinctive pathological changes,and TNF-αand IL-6 increased in serum.Conclusion T2DM model is successfully established by the feeding with high sugar and fat combined with intraperitoneal injection with STZ.T2DM distinctive pathological changes occur.Inflammatory factorsmay be involved in the T2DM pathological process.
tree shrew;type 2 diabetes;streptozotocin;model
R 587.1
A
1004-0188(2015)08-0834-04
10.3969/j.issn.1004-0188.2015.08.008
2015-03-26)
国家973计划项目(2012CB5181060);国家自然科学基金项目(31172170);云南省科技计划重点项目(2013CA005)
650032昆明,成都军区昆明总医院细胞生物治疗中心,昆明医科大学昆明总医院临床学院,干细胞与免疫细胞生物医药技术国家地方联合工程实验室,云南省细胞治疗技术转化医学重点实验室,云南省干细胞工程实验室,昆明市干细胞与再生医学研究重点实验室
潘兴华,E-mail:xinghuapan@sohu.com.cn
