多次贴壁法高效制备人脐带间充质干细胞
2015-08-07何洁赵晶王金祥蔡学敏庞荣清潘兴华
何洁,赵晶,王金祥,蔡学敏,庞荣清,潘兴华
多次贴壁法高效制备人脐带间充质干细胞
何洁,赵晶,王金祥,蔡学敏,庞荣清,潘兴华
目的建立一套简单、高效、稳定、规范的人脐带间充质干细胞体外制备与鉴定技术,为人脐带间充质干细胞库建设及临床应用提供技术规范。方法改进前期技术方法,重复验证,建立规范化技术方法。无菌采集足月剖宫产分娩胎儿脐带,采用不剥离血管和包膜组织贴壁法培养脐带间充质干细胞。待原代细胞长出时,收集原本换液应丢弃的组织块,进行二次贴壁培养,如此反复,待二次贴壁组织块长出细胞时,收集组织块进行三次贴壁培养。对三次贴壁培养长出的第三代细胞进行生物学特性分析。结果首次组织贴壁后10~12 d可见成纤维样细胞从组织块爬出,二次、三次贴壁后第2 d就可见成纤维细胞样细胞爬出,且生长状况好,细胞形态更为均一。三次贴壁培养的第三代细胞都高表达CD29、CD44、CD90和CD105,不表达CD34和CD45。细胞生长曲线呈“S”型,均具有成脂、成骨、成软骨分化的能力。结论采用多次贴壁法制备的人脐带间充质干细胞充分利用了脐带组织块,且得到的原代细胞数量翻倍,其生物学特性稳定。
脐带间充质干细胞;分离;贴壁培养
脐带间充质干细胞(umbilical cord mesenchymal stem cell,UC-MSC)可广泛用于各种损伤和退变性疾病治疗,因其具有材料来源丰富、适于标准化制备、临床应用免疫原性低等特点,将成为未来干细胞临床应用的理想选择。Mitchell等[1]首次从脐带华通胶中分离出成纤维样细胞,并且证实具有多向分化潜能后,人们采用组织块法、酶消化法和两者结合的酶组织法均分离得到UC-MSC,并且已证明在体外能分化为成骨细胞、软骨细胞、脂肪细胞、心肌细胞、神经细胞等多种细胞[2-3]。通过比较后分析,3种方法各有利弊。涉及UC-MSC的临床应用,必须建立简单、高效、稳定、规范的原代UC-MSC制备与鉴定技术,获得足够数量并符合临床要求的标准化UC-MSC,才能保证临床应用的安全性和有效性。本研究通过对前期建立的UC-MSC制备技术进行改进和重复实验,建立了组织块二次、三次贴壁培养法,充分利用了脐带组织块,大大提高了原代细胞的产量,缩短了培养时间,为临床研究和应用提供了充足的标准化种子细胞和技术。
1 材料与方法
1.1 材料来源在征得产妇和家属知情同意的情况下,在本院妇产科产房取健康足月剖腹生产的新生儿脐带。产妇无传染性疾病、遗传病史,胎儿无先天性疾病。
1.2 主要试剂和设备DMEM/F12培养液为Hyclone公司产品,胎牛血清(FBS)和0.25%trypsin-EDTA均为BI公司产品;MTS检测试剂盒为Promega公司生产;流式单抗CD29-FITC、CD34-PE、CD44-FITC、CD45-PC5、CD90-FITC和CD105-PE均为Beckman公司生产;成脂、成骨、成软骨分化诱导试剂盒均是GIBCO公司产品;流式细胞仪为Beckman公司生产。
1.3 UC-MSC的分离培养在无菌条件下,将采集的脐带用含100 U/ml青霉素、100 mg/ml链霉素的PBS液反复冲洗,去掉残留的血液。然后将脐带分解为1 mm3的组织块,转移至培养瓶中,加入少许含有10%FBS的DMEM/F12使其均匀分布,于5%CO2、37℃的培养箱中静置培养。5 d后初次换液,而后3~4 d换液,观察组织贴壁生长状况。待细胞从组织块爬出且生长至80%~90%融合状态时,用0.25%trypsin-EDTA消化传代,并将洗脱下来的组织块继续接种新的培养瓶培养;待第二次组织块贴壁爬出的细胞生长至80%~90%融合状态时,用0.25%trypsin-EDTA消化传代,并将第二次组织贴壁培养后洗脱下来的组织块继续接种新的培养瓶培养,进行第三次组织贴壁培养。对三次组织块贴壁培养出的细胞进行生物学特性鉴定。
1.4 增殖能力检测取三次贴壁培养后各自的第三代细胞(P3),按照2×103/孔接种96孔板,100μl/孔,置于5%CO2、37℃的培养箱中静置培养。每隔24 h,每孔加入20μl MTS孵育2 h后,用酶标仪(490 nm)测定各孔吸光度值,连续观察10 d后,以时间为横轴,吸光度值为纵轴绘制生长曲线。
1.5 免疫表型检测消化收集三次贴壁培养的P3代细胞,生理盐水洗涤3次,分成每管含1×106个细胞,分别加入CD29-FITC、CD34-PE、CD44-FITC、CD45-PC5、CD90-FITC、CD105-PE和同型对照10μl,4℃避光孵育30min,磷酸盐缓冲液洗涤弃除未结合抗体后,上流式细胞仪检测表面抗原标志的表达水平。
1.6 分化潜能检测成脂诱导分化:消化收集三次贴壁培养的P3代细胞,按照1×104个/cm2接种到12孔板中静置培养,至细胞100%甚至是过度融合时,丢弃10%FBS的DMEM/F12培养液,加入成脂分化诱导液培养,每隔3 d换液。培养14 d后,4%多聚甲醛固定后加入油红O染色。
成骨分化:将P3代细胞按照5×103/cm2接种到12孔板中静置培养,至细胞60%融合状态时,丢弃培养液,加入成骨诱导液连续培养,每隔3 d换液。培养21 d后,4%多聚甲醛固定后加入茜素红染色。
成软骨分化:收集P3代细胞,调整密度为1× 107/ml,取5μl接种至12孔板中,置于5%CO2、37℃的培养箱中静置培养2 h后,缓慢加入预热好的成软骨分化培养液静置培养,每隔3 d换液。培养14 d后,4%多聚甲醛固定、石蜡包埋软骨细胞小球、病理切片,脱蜡后加入阿新蓝染色,生物显微镜下观察拍照。
2 结果
2.1 UC-MSC的分离培养不剥离血管和包膜组织贴壁法培养,最早7 d后就可以在倒置相差显微镜下观察到有细胞从边缘爬出,呈细小梭形(图1A),12 d可见大量细胞呈克隆状生长(图1B)。将洗脱下的组织块进行第二次、第三次贴壁时,第2 d就可以看见细胞爬出(图1C),5 d就可见克隆样生长(图1D),其产量为以前的3倍,且传代后生长速度快、活性好,大量的成纤维细胞样细胞呈旋涡状生长(图1E)。

图1 脐带组织块贴壁法培养UC-MSC的形态观察(×10)
2.2 UC-MSC的增殖能力细胞刚接种前2 d处于滞留期,增殖不明显;3~7 d进入对数增殖期,细胞生长旺盛,活力最佳;第8 d进入平台期。三次贴壁后培养的UC-MSC生长曲线均呈典型的“S”型,无明显差异。
2.3 UC-MSC的免疫表型对三次贴壁培养的P3代细胞进行流式检测,结果均显示:低表达或不表达CD34、CD45,高表达CD29、CD44、CD90,而CD105的表达随着再次贴壁培养而升高(表1),说明第二、三次贴壁培养的细胞也是UC-MSC,且纯度更高。

表1 贴壁培养的P3代细胞UC -MSC流式检测结果(%)
2.4 UC-MSC的分化潜能成脂分化:三次贴壁培养的细胞成脂分化诱导14~21 d后,经油红O染色,胞浆内可见红色脂滴(图2);成骨分化:诱导14~21 d后,钙质结节可被茜素红染成红色(图3);成软骨分化:诱导14~28 d后,石蜡包埋切片,可见软骨胶原基质被阿甲新蓝染成蓝色(图4)。三次贴壁培养的细胞均有向脂肪、骨和软骨分化的潜能。
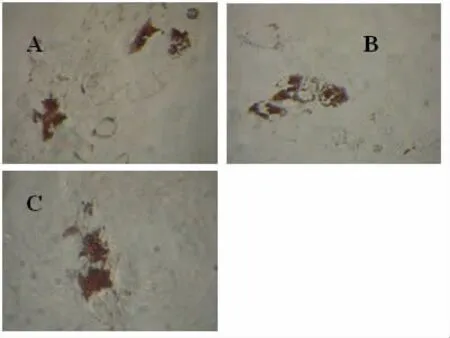
图2 UC-MSC成脂分化

图3 UC-MSC成骨分化
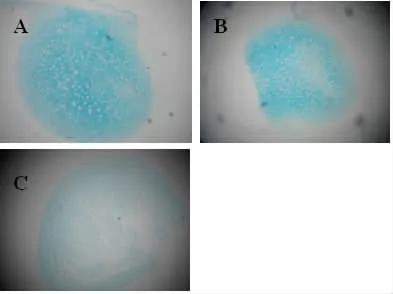
图4 UC-MSC成软骨分化
3 讨论
已经证实,间充质干细胞应用于治疗脊髓损伤、脑缺血、多发性硬化症等涉及创伤、缺血、中毒、退变诱导的组织细胞变性、坏死、缺失等疾病均有一定治疗意义[4-5]。因脐带为胎儿分娩时的废弃物,比起骨髓来源的间充质干细胞取材更为方便,不容易受到供体年龄的限制[6]而受到广泛的关注。
通常对于脐带原代组织的培养方法主要有酶消化法、组织贴壁法以及两者结合的酶组织法。酶消化法成本高,消化时间难于控制,消化液黏稠而不易分离,而且胶原酶对细胞有直接损伤作用。传统的组织贴壁法较为简单,成本低,但是细胞爬出时间过长,通常需要10 d左右,两者结合的酶组织法为贴壁培养酶消化后的组织块,方法虽也简易,细胞易于爬出,但是操作步骤比较繁琐,细胞接触东西比较多,容易污染。基于3种分离培养方法的基础上,庞荣清等[7]用一种不剥离血管和包膜直接剪碎贴壁培养的方法,也培养出活性好且稳定的脐带间充质干细胞,此法更为简易可行。本研究在此基础上进行改良,用已爬出细胞时本应丢弃的组织块进行二、三次贴壁,充分利用组织块,不造成浪费,且经过第一次贴壁后组织块中的华通胶更为暴露易于培养,接种的第2 d就能看见细胞爬出,第5 d就有大片的克隆样生长,产量为之前的3倍,提高了利用率的同时,也提高了原代细胞的产出效率。与第一次贴壁培养的细胞相比,第二、三次贴壁培养的细胞免疫表型分析结果显示,与间充质干细胞比较相关的表面标记CD90、CD105表达稍微增高,说明经过第一次贴壁培养后,淘汰了杂细胞,后面再次贴壁养出的细胞纯度更高。
本研究还对比了三次贴壁培养后的生长曲线,群体倍增时间以及多向分化潜能,结果显示生长曲线形态相似,都具有向骨、软骨和脂肪分化的能力,根据间充质干细胞的鉴定标准[8],可以判定这些贴壁生长的细胞就是脐带间充质干细胞。
总之,本研究采用反复贴壁培养的方法,建立了相对规范的UC-MSC制备与鉴定技术方法,不仅操作简单,而且得到的原代细胞数量翻倍,缩短了脐带离体后到接种的时间,大大保持了其活性,避免了过多的与外来物质的接触,降低了变异的几率,值得广泛应用。
[1]Mitchell KE,Weiss ML,Mitchell BM,et al.Matrix cells from Wharton's jelly form neurons and glia[J].Stem Cells,2003,1: 50-60.
[2]Kang XQ,Zang WJ,Song TS,et al.Rat bone marrow mesenchymal stem cells differentiate into hepatocytes in vitro[J]. World JGastroenterol,2005,11(22):3479-3484.
[3]Sanchez-Ramos JR.Neural cells derived from adult bonemarrow and umbilical cord blood[J].JNeurosciRes,2002,69(6):880-893.
[4]Herzog EL,Chai L,Krause DS.Plasticity ofmarrow-derived stem cells[J].Blood,2003,102(10):3483-3493.
[5]Deans RJ,Moseley AB.Mesenchymal stem cells:biology and potential clinical uses[J].Exp Hematol,2000,28(8):875-884.
[6]Wang L,Tran I,Seshareddy K,et al.A comparison of human bone marrow-derived mesenchymal stem cells and human umbilical cord-derived mesenchymal stromal cells for cartilage tissue engineering[J].Tissue Eng Part A,2009,15(8):2259-2266.
[7]庞荣清,何洁,李福兵,等.一种简单的人脐带间充质干细胞分离培养方法[J].中华细胞与干细胞杂志,2011,1:30-33.
[8]Jones BJ,McTaggart SJ.Immunosuppression by mesenchymal stromal cells:from culture to clinic[J].Exp Hematol,2008,36(6): 733-741.
Efficient preparation of human umbilical cordmesenchymal stem cells bymultiple adherencemethod
He Jie,Zhao Jing,Wang Jinxiang,Cai Xuemin,Pang Rongqing,Pan Xinghua Cell Biological Therapy Center of Kunming General Hospital of Chengdu Military Command/Clinical College of Kunming General Hospital,Kunming Medical University/The Nation and Region Integrated Engineering Laboratory of Stem Cell and Immunocyte Biological Technology/Key Laboratory of Cell Therapeutic Transforming Medicine of Yunnan Province/Stem Cell Engineering Laboratory of Yunnan Province/Kunming Key Laboratory of Stem Cell and Regenerative Medicine,Kunming,Yunnan,650032,China
Objective To establish a simple,efficient,stable,and standardized human umbilical cord mesenchymal stem cell preparation and identification technology in vitro,and to provide technological specification for the establishment and clinical application of human umbilical cord mesenchymal stem cell bank.Methods The technique and method in the early time were improved and repeatedly verified.A standardized technicalmethod was established.The umbilical cords of fetuses taking cesarean delivery at full term were aseptically collected.The umbilical cord mesenchymal stem cells were cultured by the method of not stripping the vessel and coated vascular tissue adherentmethod.When the primary cells grew,the tissue blocks which should be discarded at firstwere collected and adherently cultured for the second time.Repeatedly like that,the tissue blockswere collected for the third time adherent culture until the cells grew out in the blocks cultured at the second time.The cells of the third generation cultured during the three times of adherent culture were analyzed for the biological characteristics.Results Fibroblast-like cells could be seen climbing out 10-12 d after the first time adherence and on the third day after the second and third time of adherence.The growing condition was good,and the cell shape wasmore uniform.CD29,CD44,CD90,and CD105 were all highly expressed in the cells of the third generation cultured during the three times of adherent culture.However,CD34 and CD45 were not expressed.The cell growth curve was S type,and the cells could be induced to differentiate into adipocytes,osteogenesis,and chondrocytes.Conclusion The preparation of human umbilical cord mesenchymal stem cells by the method of multiple adherence method fully takes advantage of the umbilical cord tissue blocks and gets the number of primary cells doubled,and its biological characteristics is stable.
umbilical cordmesenchymal stem cell;isolation;adherent culture
R 318.1
A
1004-0188(2015)08-0828-04
10.3969/j.issn.1004-0188.2015.08.006
2015-03-26)
国家科技支撑计划(2014BI01B0);云南省战略性新兴产业专项(2013DA004);云南省科技创新平台建设项目(2013DA004)
650032昆明,成都军区昆明总医院细胞生物治疗中心,干细胞与免疫细胞生物医药技术国家地方联合工程实验室,云南省细胞治疗技术转化医学重点实验室,云南省干细胞工程实验室,昆明市干细胞与再生医学研究重点实验室
庞荣清,E-mail:pangrq2000@aliyun.com;潘兴华,E-mail:xinghuapan@aliyun.com
