薄荷流动性饮片制备工艺与质量标准研究
2015-08-07李晨晖葛卫红蔡宝昌
李晨晖 曹 岗 葛卫红 蔡宝昌
·药学园地·
薄荷流动性饮片制备工艺与质量标准研究
李晨晖1曹 岗2葛卫红2蔡宝昌2
薄荷;流动性饮片;制备工艺;质量控制
薄荷为唇形科植物Mentha haplocalyx Briq.的干燥地上部分[1-3],味辛,性凉,具有疏散风热、清利头目、利咽、透疹、疏肝行气的功效,为临床常用的辛凉解表药。用于风热感冒、风温初起,头痛目赤、喉痹、口疮、风疹、麻疹、胸胁胀闷等的治疗[4-5]。薄荷油是薄荷中的主要化学成分,薄荷挥发油中主要成分为左旋薄荷醇,含量62%~87%;此外,还含有黄酮类、机酸、蒽醌类等其他非挥发性成分[6-7]。本文研究薄荷流动性饮片的制备工艺,并建立了薄荷抛丸的质量标准,为实现薄荷饮片自动化小包装提供依据。
1 仪器与材料
1.1 仪 器 CW-12低温超微粉碎机(烟台慧宝设备制造有限公司);HLSG-10P高效混合制粒机(乐清市中厦电子仪器厂);ZLB-800旋转式制粒机(江苏张家港市开创机械制造有限公司);WG-300离心滚丸机(重庆市科旭制药机械设备制造有限公司);DHG-9240A电热恒温鼓风干燥箱(上海一恒科技有限公司);DZF-6050真空干燥箱(上海一恒科技有限公司);Agilengt 7890A气相色谱仪。
1.2 材 料 薄荷采自杭州西湖区双灵村,甲醇(色谱纯)、薄荷脑(110728-200506)购自中国药品生物制品检定所。
2 方法与结果
2.1 工艺过程 打粉:取薄荷传统饮片500g,用低温超微粉碎机适度粉碎;制软材:将药粉倒入高效混合制粒机中,加入适量水,混合均匀;制粒:将得到的软材转入到旋转式制粒机中,筛网的孔径为1.5mm;抛丸:将湿颗粒倒入离心滚丸机中抛圆;干燥:将得到的流动性饮片放入鼓风干燥箱中30℃低温干燥10h。
2.2 工艺因素考察 《中国药典》2010年版一部薄荷药材及饮片项下均以薄荷油为含量指标,故此工艺考察以薄荷油含量为主要考察指标,考虑到薄荷油的极易挥发性,工艺首先重点考察了粉碎与干燥两个工艺环节,再进行正交优选试验。
2.2.1 粉碎工艺 薄荷为易挥发性药材,普通万能粉碎机粉碎薄荷存在两个问题:一是粉碎过程产热,致使挥发性成分大大损失;二是粉碎不均匀。因此,采用低温超微粉碎机,粉碎仓为全封闭,采用-10℃低温粉碎,粉碎粒度与粉碎时间呈正比。因为薄荷地上部分入药,分为叶和茎部分,薄荷叶很容易粉碎,而茎不易粉碎,故采取先粉碎一段时间,过4号药典筛,将不能过下去的茎再粉碎一段时间。经预实验,在保证抛丸成型的前提下采用尽可能粗的粉末,确定为以下三个水平进入正交试验:①5+4:先粉碎5min,过四号筛,将未通过部分再粉碎4min;②6+5:先粉碎6min,过四号筛,将未通过部分再粉碎5min;③7+6先粉碎7min,过四号筛,将未通过部分再粉碎6min。其中最粗粉末为5+4粒径分布如图1所示。
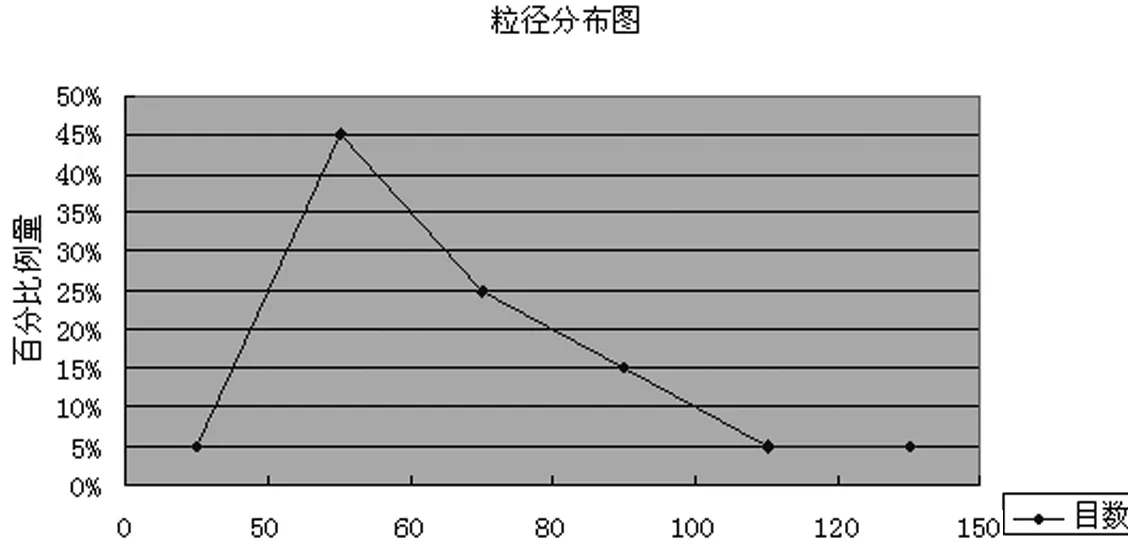
图1 5+4粉末粒径分布图
2.2.2 干燥工艺 结果表明∶鼓风干燥30℃,干燥9h,含水量刚好达到中国药典2010年一部中薄荷饮片项下对水分的要求,且薄荷油量也合格,所以本实验采用鼓风干燥30℃,干燥10h。见表1。
2.2.3 正交优选工艺参数 通过预试验可知,影响抛丸工艺的4个主要因素为:①粉碎时间;②加水量;③滚圆转速;④滚圆时间。本研究采用四因素三水平L9(34)正交试验设计,进行工艺条件的优化筛选,见表2。以圆整度、目标收率和薄荷油量为评价指标,权重系数分别为20%、20%和60%。综合评分标准:圆整度倒数×0.2+目标收率×0.2+薄荷油量×0.6。其中圆整度按照以下3.1方法考察;目标收率为中国药典1号筛与2号筛之间的成品量;薄荷油量按照《中国药典》2010年版一部附录XD挥发油测定法甲法测定。经方差分析表3和表2中直观分析结果可知:对综合评分影响的因素,大小依次为B>A>D>C,但均无显著性影响。对A因素ⅡA>ⅢA>ⅠA,B因素有ⅠB>ⅡB>ⅢB,C 因素有ⅡC>ⅢC>ⅠC,D 因素有ⅡD>ⅠD>ⅢD直观分析最佳工艺为A2B1C2D2,即粉碎时间为 6+5min,加水量为1∶1.2,滚圆时间为6min,滚圆转速为 600r/min。见表 2~4。

表1 不同干燥方式比较
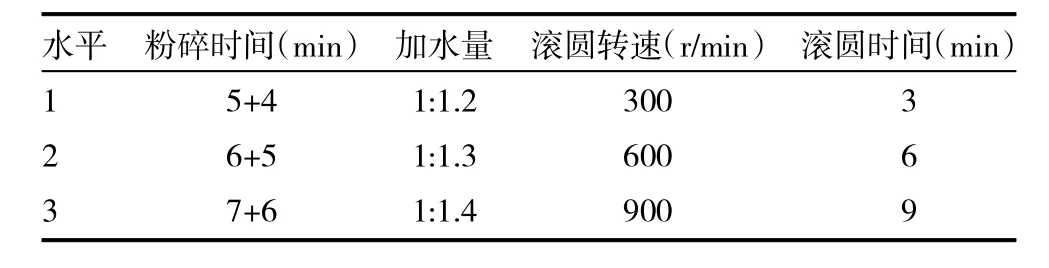
表2 因素水平表
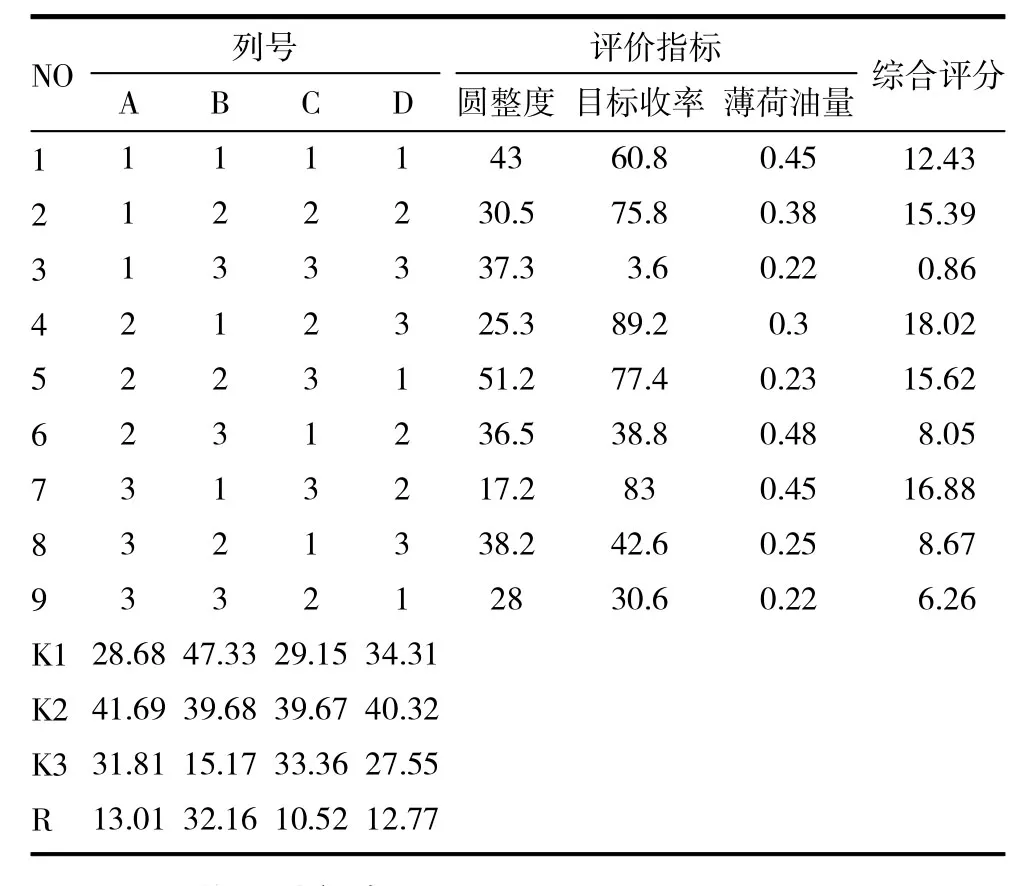
表3 L9(34)正交试验表
3 粉体学性质评价
3.1 圆整度 将一抛丸置一平板上,将平板一侧抬起,测量在抛丸开始滚动前倾斜平面与水平面的夹角,该角越小,抛丸的圆整度越好,每份样品测10次,求出平均值。见表4。
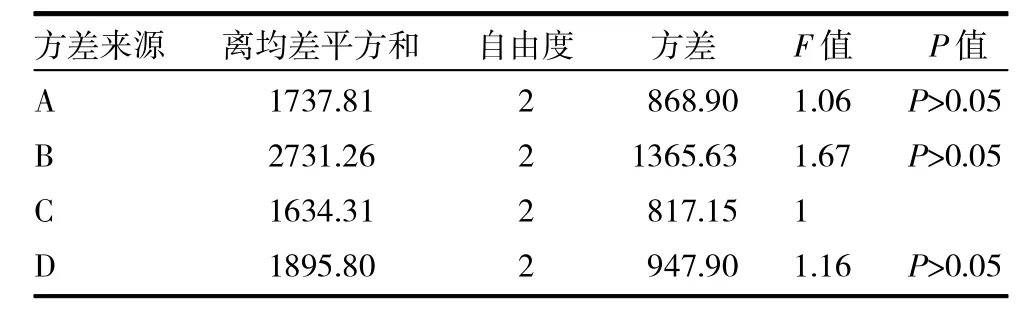
表4 方差分析
3.2 休止角 固定漏斗法,即将漏斗固定于坐标纸(纸放置于水平台上)上方一定高度,从漏斗加入物料直到形成的堆积圆锥顶部与漏斗底部刚好接触,测定圆锥直径,以漏斗底高度与圆锥半径比作为正切值计算休止角。见表5。
3.3 脆碎度 取5g用吹风机吹去脱落的粉末,精密称重,置脆碎度测定仪中,转动100次。取出,同法除去粉末,精密称重,减失重量/原重量×100%,计算脆碎度。见表5。
3.4 堆密度 称取一定量抛丸(m),置于10mL量筒中,从距离5cm处下落,连续操作3次。测定量筒体积(V),堆密度(d)由公式d=m/V求出。见表5。

表5 粉体学参数
4 抛丸薄荷脑GC含量测定
4.1 色谱条件与系统适用性试验 进样口温度:250℃;检测器温度:250℃;分流比:20∶1;载气:N2;体积流量:1.0mL/min;进样量:1μL。升温程序见表 6。

表6 升温程序
在上述色谱条件下,薄荷脑与其他成分完全分离,薄荷脑保留时间约10min,气相色谱图如图2所示。
4.2 供试品溶液的制备 取本品约2.0g,精密称定,置于150mL具塞锥形瓶,加入40mL甲醇超声30min,滤过。用少量甲醇洗涤残渣及容器3次,滤过。滤液合并至50mL量瓶中,甲醇定容,取上清液15 000r/min高速离心,上清液过0.45μm滤膜得供试液。
4.3 对照品贮备液制备 取薄荷脑对照品适量,精密称定,加甲醇制成1.36g/L薄荷脑对照品贮备液。
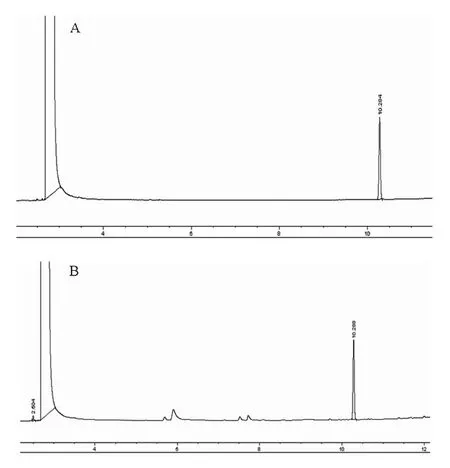
图2 薄荷脑(A)及薄荷流动性饮片(B)GC色谱图
4.4 线性关系考察 分别精密吸取一定量质量浓度为1.36g/L的薄荷脑对照品贮备液,加甲醇稀释成0.034、0.068、0.136、0.170、0.340、0.680g/L 的 一 系 列质量浓度的对照品溶液。分别吸取0.034、0.068、0.136、0.170、0.340、0.680 及 1.36g/L 对照品溶液,按“2.1”色谱条件进行测定。以峰面积积分值为纵坐标(Y),薄荷脑对照品质量浓度为横坐标(X,mg/mL),绘制标准曲线,结果Y=611.160975X+3.9237361(r=0.99979),薄荷脑进样量在0.034~1.36g/L内与峰面积线性关系良好。
4.5 精密度实验 取薄荷脑对照品溶液,进样1μL,重复进样6次,测定峰面积,计算得其RSD=0.449%。
4.6 重复性实验 取同一批供试品,平行取样6次,精密称定,照“4.2”项下方法处理,在给定的色谱条件下进行测定,结果薄荷脑峰面积的RSD=0.893%。
4.7 稳定性试验 取同一供试品溶液,分别于0、2、4、8、12、24h不同时间点进样分析,对薄荷脑的峰面积进行考察,结果薄荷脑的峰面积的RSD=1.38%,表明常温下供试品溶液在24h内稳定。
4.8 加样回收率实验 取已知薄荷脑含量的供试品粉末6份各约1.0g,精密称定,分别精密加入甲醇30mL,再精密加入对照品溶液(C=0.22007mg/mL)10mL,按上述供试品溶液制备方法制备,并按上述色谱条件进行测定,计算加样回收率,结果薄荷脑的平均回收率为99.68%,RSD为3.23%。
4.9 样品含量测定 取薄荷抛丸样品研碎粉末2g,精密称定,按“4.2”项下步骤操作,制得供试品溶液,取1μL进样测定,按标准曲线法计算供试品中薄荷脑的含量,测得薄荷脑含量为2.7318mg/g。
5 讨 论
国家中医药管理局于2008年8月公布《小包装中药饮片医疗机构应用指南》,小包装饮片的全面推广已是大势所趋。但是目前,由于中药饮片品种多样,形态各异,小包装饮片的生产形式落后,多靠手工,不能自动化生产,不符合现代工业化的发展模式。本文选取中药中质轻体大,且具挥发性的典型品种薄荷进行了工艺摸索,对于流动性中药饮片的发展奠定了一定的理论基础。
传统薄荷饮片和药材体积疏松、庞大,无法实现自动化包装,而且薄荷储存3个月左右,常有霉变现象,挥发性有效成份大量流失,切损耗大等问题,从而影响药材的质量和临床药效的发挥,所以运用现代科学技术改造传统产业将成为中药饮片生产技术发展的主要趋势[8-9]。薄荷流动性饮片是在总结薄荷现有的各种新型中药饮片优缺点的基础上,依据中医药复方配伍理论和临床应用需要,对薄荷传统饮片进行特殊加工的一种原创性的新型中药饮片。薄荷流动性饮片是在传统饮片的基础上,以水为黏合剂,不添加任何辅料,将薄荷低温粗粉运用现代化的抛丸技术制成可流动性饮片。薄荷新型饮片可以群药共煮,符合汤剂的要求,便于规范化生产,机械化生产包装等优点,尤其适用于体积大、机械化小规格包装有难度的常用草类、花类、皮类等药材。
本工艺为保持中药饮片的特色,未添加任何辅料,只选用适量水作为黏合剂,力求保持其化学性质,改变传统中药饮片的物理形态,增加其流动性,便于自动化生产包装。《中国药典》2010版仅对传统薄荷饮片中的总挥发油作了规定,而没对其挥发油中具体成分限定。为控制薄荷流动性饮片的质量,建立了GC方法直接测定薄荷中的薄荷脑,对于薄荷中薄荷脑的GC测定方法很多,多是先提薄荷油,再测定薄荷油中薄荷脑含量,本文首次创新性研究薄荷流动性饮片,并直接测定薄荷中的薄荷脑,所需样品量少,且简单易行。另外,较之前常用的内标法,我们采用了外标法,简化了操作步骤。
[1]蔡宝昌,龚千峰.中药炮制学专论[M].北京:人民卫生出版社,2009:204.
[2]国家药典委员会.中华人民共和国药典2010版一部[S].北京:中国医药科技出版社,2010:370.
[3] Liang CY,Li WL,Zhang HQ,et al.The advance on the research of chemical constituents and pharmacological activities of Mentha haplocalyx[J].Chinese Wild Plant Resources,2003,22(3):9-12.
[4] Liu Y,Zhang YH,Shi RB.Studies on the chemical constituents in herb of Mentha haplocalyx[J].Chinese Journal of Integrative Medicine,2005,30(14):1086-1088.
[5] Su Y,Wang CZ,Guo YL.Analysis of Volatile Compounds from Mentha hapioealyx Briq by GC-MS Based on Accurate Mass Measurement and Retention Index[J].Acta Chimica Sinica,2009,67(6):546-554.
[6]Qian ZM,Qin SJ,Yi L,et al.Binding study of Flos Lonicerae Japonicae with bovine serum albumin using centrifugal ultrafiltration and liquid chromatography[J].Biomedical Chromatography,2008,22(2):202-206.
[7] She GM,Xu C,Liu B,et al.Polyphenolic Acids from Mint(the Aerial of Mentha haplocalyx Briq.)with DPPH Radical Scavenging Activity[J].Journal Food Science,2010,75(4):359-362.
[8]单琪媛,曹岗,丛晓东,等.气相色谱法测定不同产地薄荷传统饮片及薄荷新型饮片中薄荷脑的含量[J].中华中医药学刊,2013,31(2):348-350.
[9]刘真.马鞭草流动性饮片及其制备工艺、质量标准研究[D].浙江中医药大学,2012:13-30.
(收稿:2014-07-20 修回:2014-09-12)
浙江省经贸委中药现代化专项(No.浙财企字[2008]268号);浙江省中医药重点研究计划(No.2008ZA002)
1杭州市第一人民医院药剂科(杭州 310006);2浙江中医药大学中药炮制技术中心(杭州 310053)
曹岗,Tel:15868486269;E-mail:caogang33@163.com
