孕中期早期孕妇血清中β-HCG、PlGF水平及比值变化预测重度子痫前期的价值
2015-08-04郑琪珍邓玉清钟世林雷桔红
郑琪珍 邓玉清 钟世林 雷桔红
(北京大学深圳医院 女性重大疾病早期诊断技术重点实验室,广东 深圳 518036)
子痫前期(preeclampsia,PE)是较为常见的产科并发症,是导致孕产妇和围产儿患病及死亡的重要原因。其中,重度子痫前期(severe preeclampsia,SPE)往往伴随更为严重的母儿不良结局,如HEELP综合征、胎盘早剥、胎儿宫内生长受限(intrauterine growth restriction,IUGR)等。PE的临床表现多样,临床机制复杂,很难用一元论解释。迄今众多研究结果一致认同,子痫前期的病理生理基础为多种原因导致的妊娠早期子宫螺旋小动脉重铸障碍,胎盘滋养细胞侵袭能力下降,进而发生胎盘血液及氧循环障碍,减少胎儿的营养供应,同时诱发胎盘表面滋养细胞的过氧化应激反应[1]。基于上述研究理论,妊娠早期胎盘功能标志物及血管源性因子水平的变化对预测PE具有较好的应用前景。
人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)是早期妊娠的标志物,并可反映胎盘功能的变化[2]。胎盘生长因子(placental growth factor,PlGF)对胎盘形成早期血管内皮细胞的生长及功能的调节起重要作用[3]。不少研究表明两者均与PE的发生存在较为密切的关系。为此,本研究对孕中期早期(孕15~20周)孕妇血清中β-HCG和PlGF的水平进行检测并计算其比值,旨在探讨孕妇血清中β-HCG和PlGF及其比值在预测SPE发生中的临床价值。
1 资料与方法
1.1 研究对象及分组 选取2014年5月至2015年6月在北京大学深圳医院行孕中期(15~20周)唐氏筛查并于该院分娩的单胎孕妇1722人。初诊时测定基础血压值并核实孕周大小。所有孕妇均已排除①染色体及结构异常者;②不明原因流产或胎死宫内者;③产前筛查已患有本次研究的产科并发症及其他内科合并症如糖尿病者;④吸烟及被动吸烟者。根据随访结果分成SPE组和正常妊娠(normal pregnancy,NP)组。所有研究对象均已签署知情同意书。
1.2 相关定义和诊断标准
1.2.1 子痫前期(PE) 参考第23版《威廉姆斯产科学》[4],指妊娠 20 周后首次出现血压 ≥140/90mmHg伴24小时尿蛋白定量>0.3g,或尿蛋白/肌酐比值≥0.3,或随机尿蛋白(+)。
1.2.2 重度子痫前期(SPE) 指子痫前期患者出现以下至少一种临床表现:①收缩压≥160mmHg和(或)舒张压≥110mmHg;②尿蛋白定性≥(++)或24小时尿蛋白定量≥2g;③中枢神经系统异常,如视觉模糊、头痛、头晕;④上腹部不适或持续性右上腹部疼痛;⑤血清转氨酶升高;⑥血小板减少(<100×109/L);⑦24小时尿量<500ml;⑧血管内溶血,凝血功能障碍,肺水肿,脑血管意外,胎儿生长受限。
1.3 研究方法
1.3.1 临床资料及随访内容 收集各组孕妇的基本临床信息,包括年龄、采血孕龄、体质量指数(body mass index,BMI)、孕产次、分娩孕周、妊娠结局及新生儿体重等。
1.3.2 母体血清中β-HCG、PlGF水平测定 对各组孕妇于15~20周行中期唐氏筛查时留取外周肘静脉血2ml,置于含有乙二胺四乙酸(EDTA)抗凝剂的试管内,-80℃储存待测。所有标本集中后,于检测前1天置于4℃冰箱缓慢融化,采用ELISA方法检测β-HCG、PlGF水平,考虑母体血清中代谢产物的浓度容易受到来自本身妊娠相关因素、实验仪器及检测试剂的影响[5],故将原始数据表示为正常妊娠组的中位数的倍数(multiple of median,MoM),以行调整。ELISA试剂盒购自上海江莱实业有限公司。实验检测由不知道研究分组及妊娠结局的专业技术人员完成,并严格按照试剂盒说明书进行操作。
统计分析采用SPSS 19.0统计学软件;ROC曲线绘制和分析采用Medcalc12.3软件。
2 结 果
2.1 病例组与对照组研究对象的一般情况 研究列队共1722例孕妇,排除不符合入选标准41例,失访52例,共1629例完成了整个研究,失访率3.0%。诊断SPE 31例,随机选择采血孕龄与SPE患者相近的正常妊娠孕妇102例作为阴性对照组。
SPE组和NP组孕妇的年龄、BMI及采血时间相比,差别均无明显统计学意义(P>0.05);SPE组的平均分娩孕周及新生儿体重均明显低于NP组,差别有统计学意义(P值均<0.05)。SPE组的平均分娩孕周为(35.9±3.9)周,较 NP组提前3+周;平均新生儿出生体重为(2237±971)g,仅约为NP组的2/3。差别有统计学意义(P值均于<0.05)。(见表1)
表1 两组中孕妇及新生儿一般情况(±s)

表1 两组中孕妇及新生儿一般情况(±s)
组别 例数(例) 年龄(岁) 初产妇比例(%) BMI(kg/m2) 采血孕周(周) 分娩孕周(周) 新生儿出生体重(g)SPE 31 31.9±4.9 55 22.6±4.1 17.4±1.3 35.9±3.92237±971 NP 102 30.0±3.7 67 22.2±2.9 17.2±1.4 39.2±1.73324±344
2.2 两组孕妇血清中β-HCG、PlGF水平及两者比值比较
2.2.1 SPE组孕妇血清中β-HCG的 MoM 值[中位数(p25,p75)]较 NP组明显升高,分别为1.24(0.80,1.58)MoM 和0.96(0.71,1.17)MoM(P=0.021)。见表2、图1。SPE组孕妇血清中PlGF的MoM 值较 NP组明显下降,分别为0.68(0.54,1.01)MoM 和1.38(0.89,2.72)MoM,差别有统计学意义(P<0.01)。见表2、图2。SPE组的β-HCG/PlGF比值明显高于 NP组,分别为1.91(1.27,3.13)和0.70(0.38,0.99),差别有统计学意义(P<0.01)。见表2、图3。

表2 两组孕妇血清中β-HCG、胎盘生长因子(PlGF)水平及二者比值结果[中位数(p25,p75)]

图1 两组孕妇血清中β-HCG(MoM)箱线图
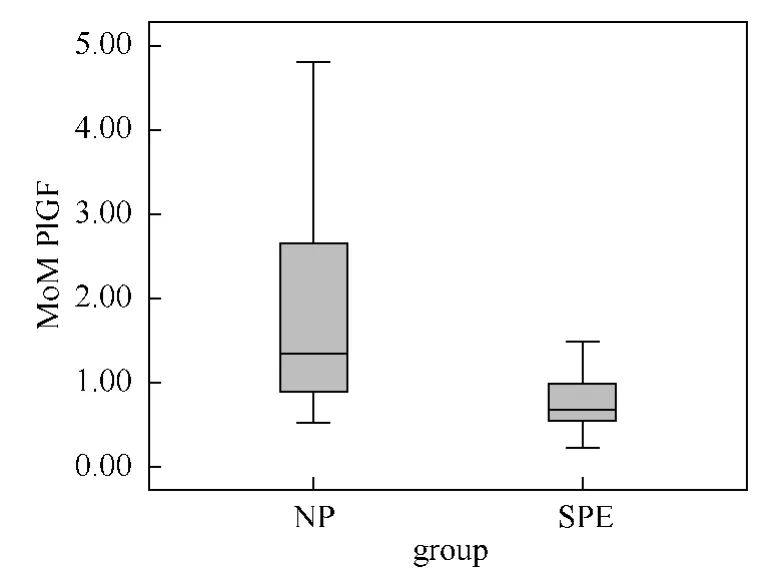
图2 两组孕妇血清中PlGF(MoM)箱线图
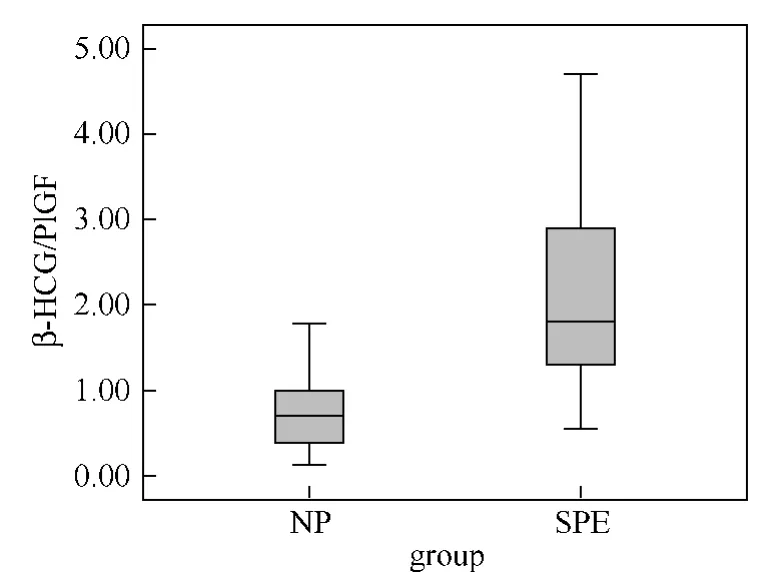
图3 两组孕妇血清中β-HCG/PlGF比值的箱线图
2.3 孕妇血清中β-HCG、PlGF水平及两者比值预测SPE的价值 以β-HCG(MoM)、PlGF(MoM)和β-HCG/PlGF比值作为检验变量,是否发生SPE作为状态变量绘制ROC曲线,见表3。结果显示,取β-HCG截断值为1.12MoM时,预测SPE的敏感度及特异度分别为54%和88%,曲线下面积(AUC)为0.664(95%CI:0.575~0.746;P=0.025);取PlGF截断值为0.83MoM时,预测SPE的敏感度及特异度分别71%和82%,AUC为0.818(95%CI:0.740~0.881;P<0.01);取β-HCG/PlGF比值截断值为1.13时,预测SPE的敏感度及特异度分别82.3%和86.3%,AUC 为0.914(95%CI:0.851~0.956;P<0.01),三者比较β-HCG/PlGF比值的预测价值最高,见图4。

表3 β-HCG、PlGF水平及二者比值预测SPE的受试者工作特性曲线分析
3 讨 论
3.1 β-HCG
3.1.1 β-HCG水平在正常妊娠过程中的变化及意义 人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)是由胎盘合体滋养细胞分泌的、由α和β亚基构成的糖蛋白激素。其中β亚基具有很强的特异性,是临床检测的靶点[6]。在胚胎第2周,HCG即由合体滋养层细胞产生,并通过绒毛膜间隙进入母体。其于妊娠第9~11周达高峰,妊娠3个月后显著下降,近20周左右时降至最低点。故母血清HCG水平是早期妊娠的标志物,同时可作为胎盘功能变化的早期信号。
3.1.2 孕妇血清中β-HCG水平异常对SPE的预测价值 Rabie和Magann[7]对2405名行体外受精(IVF)的单胎孕妇于受精后第12d抽血检验HCG水平的结果显示,HCG水平下降与PE的发生相关。HCG<50IU的孕妇发生PE及SPE的比率(odds ratio,OR)分别为2.3(95%CI:1.2~4.7)和4.2(95%CI:1.2~4.7)。Roiz-Hernandez等[8]对784例孕妇的研究表明,16~20周时PE患者血清β-hCG水平明显高于正常妊娠孕妇,取截断值2.2MoM时,预测PE在初产妇及经产妇中发生的敏感度分别为88.5%和100%,特异度分别为92.0%和85.6%。Asvold等[9]对121例未足月的PE(preterm preeclampsia,<37周)患者及158例足月的PE(term preeclampsia,≥37周)患者的血清学指标进行测定,发现妊娠早期(4~12周)时hCG水平升高提示未足月PE发生风险降低(OR 0.3,95%CI:0.1~0.9),相反,妊娠中期(13~27周)HCG水平升高提示未足月PE风险升高(OR 4.0,95%CI:1.8~8.9)。本研究结果表明,孕15~20周时PE孕妇血清β-HCG为1.24(0.80,1.58)MoM明显高于LBWI组的0.92(0.62,1.27)MoM 及正常妊娠组的0.96(0.71,1.17)MoM,差别有统计学意义(P=0.021)。上述理论及研究结果提示,在发生PE的孕妇中,胎盘局部的过氧化应激引发合体滋养细胞坏死及凋亡,其在胚胎发育的初期可导致HCG水平下降;而随着妊娠的进展,胎盘其他部位的胎盘的滋养细胞可能发生代偿性细胞增生及分裂,并于72h内迅速转变为合体滋养层,分泌更多的HCG[10]。

图4 β-HCG(MoM)、PlGF(MoM)和β-HCG/PlGF比值预测重度子痫前期的ROC曲线
3.2 PlGF
3.2.1 PlGF对胎盘滋养细胞和血管内皮细胞的生长及功能的调节 PlGF是血管内皮生长因子(vascular endothelial growth factor,VEGF)家族中的一员,其主要在胎盘局部表达。PlGF对胎盘滋养细胞和血管内皮细胞的生长及功能的调节起重要作用,包括:①具有明显的促血管生成的作用,能诱导血管内皮细胞增殖、迁移和激活的作用,并可作为内皮细胞生长因子的趋化因子来调节内皮细胞的生长;②在滋养细胞增殖和植入过程中起增强作用[11]。
3.2.2 孕妇血清中PlGF水平异常对SPE的预测价值 不少研究表明,发生PE的孕妇在妊娠早期(孕11~14周)时血清中的PlGF水平已明显低于正常妊娠孕妇[12,13]。Ghosh等[14]对1200多名孕妇的研究结果表明,早发型PE(<32周)孕妇血清中PlGF水平的变化,于中孕早期(孕22~24周)较孕早期(孕11~14周)时有更高的预测价值,前者的敏感度和特异度分别为84%和78%,后者分别58%和66%。Meler等[15]研究结果表明PE发病的孕周越小,母体血清中的PlGF水平更低(P=0.019)。Stubert等[16]研究表明孕19~26周时PlGF水平降低对PE有较好的预测价值(P=0.027),Gomez-Roig等[17]研究发现妊娠晚期时PlGF水平降低在PE患者血清中较正常妊娠孕妇明显,差别有统计学意义(P值均<0.01)。本研究结果显示,孕15~20周时,SPE组孕妇血清中的PlGF水平明显下降,与NP组比较,差别均有统计学意义(P值均<0.01)。
3.3 β-HCG/PlGF 近年来,有研究者发现孕妇血清中血管活性因子的比值或斜率指标对预测PE具有更高的优越性。Schoofs等[18]发现sFlt-1/PlGF比值在PE患者出现临床症状4周前明显升高,与正常妊娠孕妇相比,差别有统计学意义(P=0.02)。高劲松等[19]的研究结果表明,孕15~20周时,PE组孕妇血清中sFlt-1、PlGF水平及sFlt-1/PlGF比值与正常妊娠孕妇相比,差别均无统计学意义(P>0.05),而孕24~28周时,此3项指标在两组间比较差别均有统计学意义,且sFlt-1/PlGF比值对PE的预测价值最高。应用HCG和PlGF比值对PE进行预测的方法目前在国内外均鲜有相关报道,仅Asvold等[9]在其研究结论中指出,妊娠中期母血流中HCG水平异常升高伴随PlGF水平异常降低,提示发生未足月子痫前期的风险大大增加。本研究通过对孕15~20周时孕妇血清中β-HCG、PlGF水平进行检测并计算其比值,发现β-HCG/PlGF对子痫前期具有较高的预测价值,取截断值为1.13时,其预测PE发生的曲线下面积为0.914(95%CI:0.85~0.956;P<0.01),敏感度和特异度分别为83%和87%,且阳性似然比和阴性似然比分别为6.1和0.2。本研究的不足之处在于样本量有限,或存在结果偏倚可能。
3.4 孕15~20周时孕妇血清中β-HCG、PlGF水平及两者比值预测SPE发生的优越性 ①虽然迄今报道的PE外周血中的预测候选分子颇多,但几项在妊娠中、晚期时具有较好预测性能的指标如sFlt-1、sEng,在妊娠早期却非理想。HCG和PlGF是目前多份研究中较为认可的早期预测PE发生的母体血清学指标[7,9,14]。HCG 对来源于腺体组织的血管内皮生长因子(EG-VEGF)及其受体具有重要的调节功能,HCG与PlGF可能在PE发病的生物学路径中发挥协同效应[20]。②我国人群初诊产检的时间较晚,主要集中在中孕早期,目前是中期唐氏筛查的黄金窗口期,若能同时纳入PE,尤其是SPE的预测筛查,将大大推进PE的防治工作,且能避免过多增加孕妇的产检及经济负担。③2014年9月美国预防服务工作组(United States Preventive Services Task Force,USPSTF)发表指南推荐对PE高危孕妇应自孕龄12孕周时,开始每日口服小剂量阿司匹林(low dose asprin,LDA)进行预防[21]。世界卫生组织(World Health Organization,WHO)则推荐对子痫前期高危孕妇应于12~20周开始口服LDA(剂量为75mg/d)预防PE[22]。结合本研究结果,孕中期的早期(15~20周)孕妇血清中β-HCG、PlGF水平及其比值对PE的发生具有较为良好的预测价值,且β-HCG/PlGF比值的预测价值最优。值得进一步开展大样本、多中心的实验研究加以验证。
[1]李笑天.子痫前期发病机制的多源性[J].中华围产医学杂志,2015,18(6):407-410.
[2]Cole LA.Biological functions of hCG and hCG-related molecules[J].Reprod Biol Endocrinol,2010,8:102.
[3]Arroyo J,Price M,Straszewski-Chavez S,et al.XIAP protein is induced by placenta growth factor(PLGF)and decreased during preeclampsia in trophoblast cells[J].Syst Biol Reprod Med,2014,60(5):263-73.
[4]Cunningham G,Leveno K,Bloom S,et al.Williams obstetrics[M].23rd ed.New York:McGraw-Hill Professional Publishing,2010:707-708.
[5]Kagan KO,Wright D,Spencer K,et al.First-trimester screening for trisomy 21by free beta-human chorionic gonadotropin and pregnancy-associated plasma protein-A:impact of maternal and pregnancy characteristics[J].Ultrasound Obstet Gynecol,2008,31(5):493-502.
[6]刘雪峰,古丽娜尔·依明,邵永康.血清游离人绒毛膜促性腺激素β亚基检测及临床应用[J].检验医学与临床,2011,08(17):2129-2130,2148.
[7]Rabie NZ,Magann EF.Human chronic gonadotropin concentrations in very early pregnancy and subsequent preeclampsia[J].Women′s health,2014,10(5):483-485.
[8]Roiz-Hernandez J,de JC-MJ,Fernandez-Mejia M.Human chorionic gonadotropin levels between 16and 21weeks of pregnancy and prediction of pre-eclampsia[J].Int J Gynaecol Obstet,2006,92(2):101-105.
[9]Asvold BO,Eskild A,Vatten LJ.Human chorionic gonadotropin,angiogenic factors,and preeclampsia risk:a nested case-control study[J].Acta Obstet Gynecol Scand,2014,93(5):454-462.
[10]顾玮,林婧,侯燕燕.妊娠早中期孕妇血清中β-hCG、PAPPA、AFP及uE3水平检测在联合预测子痫前期中的价值[J].中华妇产科杂志,2015,(2):101-107.
[11]彭兰,戴建荣,柴利强,等.胎盘蛋白13与胎盘生长因子在子痫前期高危人群中的表达及预测意义[J].中国现代医药杂志,2015,17(1):26-29.
[12]Allen RE,Rogozinska E,Cleverly K,et al.Abnormal blood biomarkers in early pregnancy are associated with preeclamp-sia:a meta-analysis[J].Eur J Obstet Gynecol Reprod Biol,2014,182C:194-201.
[13]Poon LC,Nicolaides KH.Early prediction of preeclampsia[J].Obstet Gynecology Int,2014,2014:297397.
[14]Ghosh SK,Raheja S,Tuli A,et al.Is serum placental growth factor more effective as a biomarker in predicting early onset preeclampsia in early second trimester than in first trimester of pregnancy?[J].Arch Gynecol Obstet,2013,287(5):865-873.
[15]Meler E,Scazzocchio E,Peguero A,et al.Role of maternal plasma levels of placental growth factor for the prediction of maternal complications in preeclampsia according to the gestational age at onset[J].Prenat Diagn,2014,34(7):706-710.
[16]Stubert J,Ullmann S,Bolz M,et al.Prediction of preeclampsia and induced delivery at<34weeks gestation by sFLT-1and PlGF in patients with abnormal midtrimester uterine Doppler velocimetry:aprospective cohort analysis[J].BMC Pregnancy Childbirth,2014,14:292.
[17]Gomez-Roig MD,Mazarico E,Sabria J,et al.Use of Placental Growth Factor and Uterine Artery Doppler Pulsatility Index in Pregnancies Involving Intrauterine Fetal Growth Restriction or Preeclampsia to Predict Perinatal Outcomes[J].Gynecol Obstet Invest,2015,80(2):99-105.
[18]Schoofs K,Grittner U,Engels T,et al.The importance of repeated measurements of the sFlt-1/PlGF ratio for the prediction of preeclampsia and intrauterine growth restriction[J].J Perinat Med,2014,42(1):61-68.
[19]高劲松,沈晶,蒋宇林,等.妊娠中期孕妇血清sFlt-1、PlGF水平及比值变化预测子痫前期发生的价值[J].中华妇产科杂志,2014,49(1):22-25.
[20]Brouillet S,Hoffmann P,Chauvet S,et al.Revisiting the role of hCG:new regulation of the angiogenic factor EGVEGF and its receptors[J].Cell Mol Life Sci,2012,69(9):1537-1550.
[21]American College of Obstetrics and Gynecologists.Hypertensionn in pregnancy[R].Washington,DC:American College of Obstetrics and Gynecologists,2013:1-18.
[22]World Health Organization.WHO recommendations for prevention and treatment of preeclampsia and eclampsia[R].Geneva:World Health Organization,2011:1-22.
