E-cadherin、N-cadherin及β-catenin在精原细胞瘤中表达的变化*
2015-07-28郑文忠陈剑波张士强张恩溥李明华李贤新
郑文忠 陈剑波 张士强 刘 冲 张恩溥 李明华 李贤新**
1. 北京大学深圳医院泌尿外科,广东省男性生殖与遗传实验室(深圳 518036);
2. 中山大学肿瘤防治中心泌尿外科; 3. 北京大学深圳医院妇产科
E-cadherin、N-cadherin及β-catenin在精原细胞瘤中表达的变化*
郑文忠1陈剑波1张士强2刘 冲3张恩溥1李明华1李贤新1**
1. 北京大学深圳医院泌尿外科,广东省男性生殖与遗传实验室(深圳 518036);
2. 中山大学肿瘤防治中心泌尿外科; 3. 北京大学深圳医院妇产科
目的 探讨上皮-钙黏素(E-cadherin)、神经-钙黏素(N-cadherin)及β-链蛋白(β-catenin)在精原细胞瘤中的表达及意义。方法 采用S-P免疫组化法检测29例精原细胞瘤及10例正常睾丸E-cadherin、N-cadherin、β-catenin的表达水平,并进一步通过RT-PCR及蛋白免疫印迹技术(5例精原细胞瘤、5例正常睾丸)验证。结果免疫组化染色结果显示,正常睾丸细胞间连接处可见N-cadherin表达,而精原细胞瘤中未见N-cadherin表达;精原细胞瘤E-cadherin、β-catenin表达水平较正常睾丸显著下降,差异有显著性(P<0.05);精原细胞瘤E-cadherin、β-catenin表达水平与肿瘤TNM分期相关性分析结果无显著性(P>0.05, r1=0.2669, r2=-0.2280)。免疫印迹及PCR结果显示,精原细胞瘤E-cadherin、N-cadherin、β-catenin表达水平较正常睾丸显著下降,差异有显著性(P<0.05)。结论 精原细胞瘤中E-cadherin -β-catenin 复合体及N-cadherin表达较正常睾丸显著下降,且与肿瘤TNM分期无显著相关,提示E-cadherin、β-catenin及N-cadherin的降低可能参与精原细胞瘤的癌变过程,但与肿瘤侵袭及转移过程无显著相关。
精原细胞瘤; 上皮-钙黏素; β-链蛋白; 神经-钙黏素; 上皮间质转化
精原细胞瘤是男性睾丸恶性肿瘤中最常见的病理类型,占睾丸肿瘤30%~40%,好发年龄为35~45岁[1]。目前,精原细胞瘤发生及转移的分子机制仍未阐明。研究表明,肿瘤浸润转移常存在上皮间质转化(epithelia-mesenchymal transition, EMT)现象,EMT系指细胞表型由上皮转为间质,从而获得浸润及转移的能力[2]。EMT分子表型改变表现为上皮表型E-cadherin降低,间质表型N-cadherin上升[3,4]。E-cadherin在生殖细胞分化成熟过程中起重要作用,常与β-catenin形成复合体,通过Wnt信号通路调控多能干细胞分化方向,并在睾丸肿瘤发生及分化过程中起重要作用[5]。本研究通过免疫组化及蛋白免疫印迹方法检测E-cadherin,β-catenin及N-cadherin在正常睾丸及精原细胞瘤中的分布及表达,探讨其在精原细胞瘤发生发展过程中的作用。
材料与方法
一、标本收集制备
收集2008年9月至2014年9月北京大学深圳医院泌尿外科手术切除的精原细胞瘤组织34例(石蜡包埋29例、液氮冷冻5例),年龄在28~50岁,(45.2±7.0)岁,病理诊断为睾丸精原细胞瘤;按TNM分期进行分级:Ⅰ级10例,Ⅱ级13例,Ⅲ级2例,Ⅳ级4例。正常睾丸标本15例(石蜡包埋10例、液氮冷冻5例)选自2006年9月至2014年9月我院泌尿外科因前列腺癌而接受睾丸去势手术治疗的患者,并由病理科医师证实为正常睾丸组织。患者术前未接受放疗、化疗及其它治疗。石蜡标本(精原细胞瘤29例,正常睾丸10例)用于免疫组化实验,冰冻标本(精原细胞瘤及正常睾丸组织各5例)用于PCR及蛋白免疫印迹实验。本课题经北京大学深圳医院伦理委员会批准,且参与患者均填写《知情同意书》。
二、主要试剂及仪器
E-cadherin兔抗人单抗(武汉博士德);β-catenin鼠抗人多抗(武汉博士德); N-cadherin鼠抗人单抗(武汉博士德); UltraSensitiveTM SP(鼠/兔)试剂盒(福州迈新公司);山羊血清工作液(福州迈新公司); DAB(福州迈新公司);Trizol(Invirtogen公司);RNA逆转录试剂盒(Takara公司);RIPA裂解液(上海碧云天公司);BCA蛋白定量试剂盒(上海碧云天公司);PVDF膜(上海碧云天公司);其他常规试剂由北京大学深圳医院广东省男性生殖与遗传重点实验室供应。
三、免疫组化(S-P法)
石蜡包埋标本连续切片,片厚4μm,60℃温箱烘干后备用。石蜡切片脱蜡水化处理,0.3%过氧化氢封闭组织内源性过氧化物酶15min,抗原经pH9.0 EDTA微波修复25min,冷却60min至室温。山羊血清工作液室温孵育50min,一抗(E-cadherin,β-catenin,N-cadherin)4℃过夜,二抗(羊抗兔IgG聚合物,羊抗鼠IgG聚合物)37℃温箱孵育30min,辣根过氧化物标记生物素37℃温箱孵育30min,DAB显示,苏木素复染细胞核,水化透明,中性树胶封片。阳性组织切片作阳性对照,抗体对应IgG代替一抗为阴性对照。
四、RT-PCR
Trizol法提取组织总RNA,通过RNA PCR Kit(AMV)Ver.3.0试剂盒进行RT-PCR。引物序列分别为:E-cadherin:5’-TTCTGTGAGAGGAATCCA-3’;5’-GTGTTAGTTCTGCTGTGA-3’。N-cadherin:5’-TCATCATCCTGCTTATCC-3’;5’-ATTATCTCTTACATCATCTTCTG-3’。β-catenin:5’-TGACCAACAGAAACCTTT-3’;5’CCAATCAGACCTCTTCAC-3’。GAPDH:5’-CTCCGGGAAACTGTGGCGTG-3’;5’-ACAAAGTGGTCGTTGAGGGCA-3’。RT-PCR产物于2%琼脂糖凝胶电泳。以GAPDH为内对照,计算积分吸光值IA。
五、蛋白免疫印迹
冰冻组织于RAPI裂解液中研磨,4℃、13 800×g,离心30min,分离上清,经BCA蛋白定量试剂盒测定蛋白浓度,样品加入2×上样缓冲液,煮沸变性7min,4℃、13 800×g,离心20min,取50μg总蛋白于30mA/块胶12% SDS-聚丙烯酰胺凝胶电泳90min。转移至硝酸纤维素膜(PVDF膜),7.5% 脱脂奶粉室温封闭3h,抗体(E-cadherin,β-catenin,N-cadherin,β-tublin)4℃冰箱摇床过夜,二抗(羊抗兔IgG聚合物,羊抗鼠IgG聚合物)室温孵育1h,显影曝光,利用Quantity one软件扫描PVDF膜上蛋白信号条带,计算积分吸光值IA。
六、统计学方法
对免疫组化图像采集者实施盲法,每个标本病变典型处采集5个高倍视野(HPF×400)。每个视野通过图像分析软件Image-Pro Plus 6.0(IPP6.0)进行积分吸光度(LA)值测量,结果以表示,数据由R 3.0.1软件处理,组间比较采用样本均数间t检验进行分析,因素间关系采用Spearman相关检验分析,P<0.05为差异有显著性。
结 果
一、免疫组织化学染色结果
正常睾丸支持细胞间紧密连接处及精子均可见E-cadherin表达,精原细胞瘤E-cadherin主要表达于肿瘤胞浆。β-catenin、N-cadherin表达于正常睾丸支持细胞间紧密连接处,精原细胞瘤未见N-cadherin表达,β-catenin表达于肿瘤细胞胞浆。精原细胞瘤E-cadherin、β-catenin表达水平与肿瘤TNM分期相关性分析结果无显著性(P>0.05,r1=0.2669, r2=-0.2280),见图1。
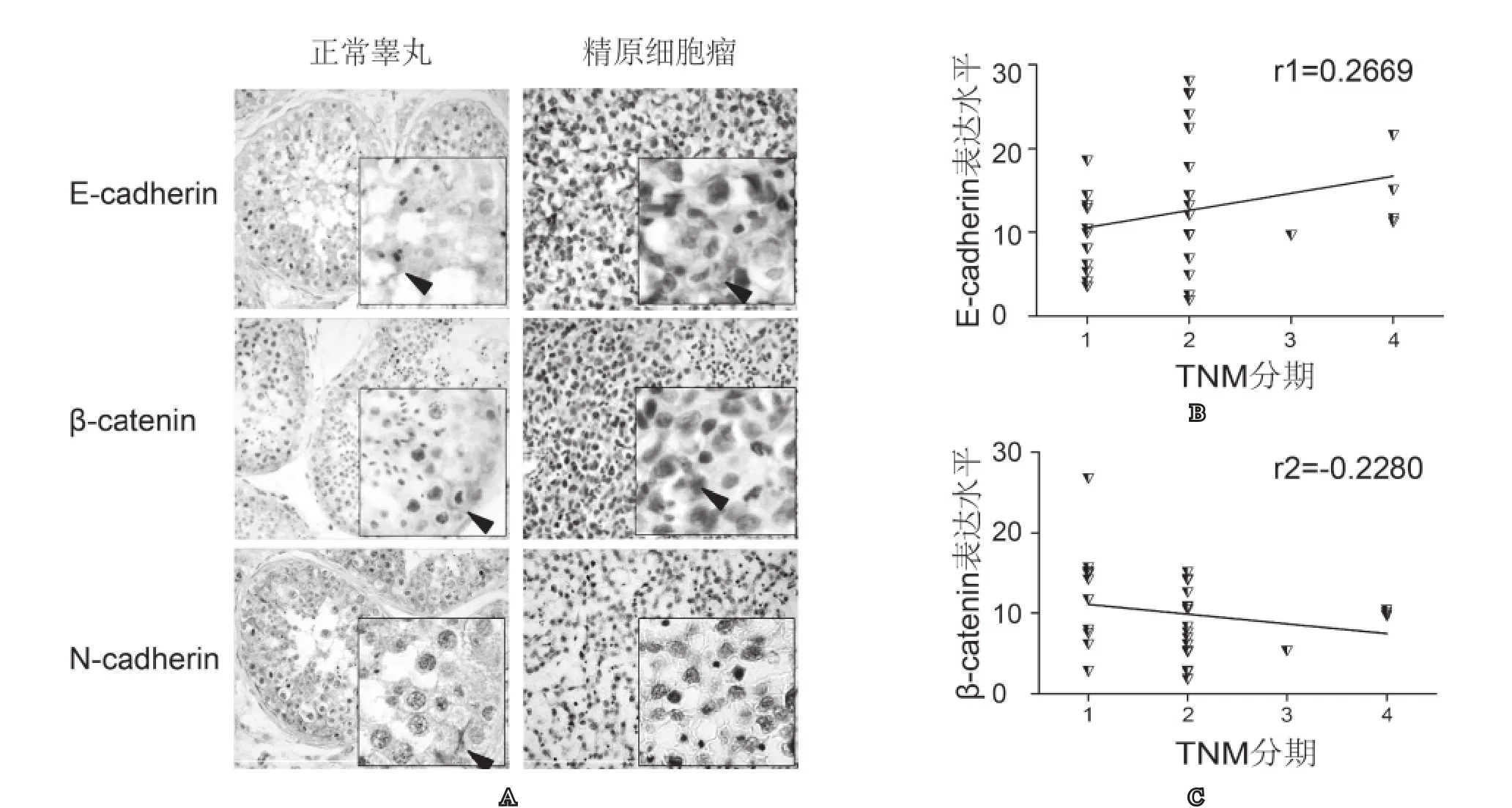
图1 E-cadherin、β-catenin、N-cadherin在睾丸组织中的表达及其与肿瘤TNM分期的相关性A: 正常睾丸及精原细胞瘤中E-cadherin、β-catenin、 N-cadherin的分布及表达(×200, ×400); B: E-cadherin、β-catenin与肿瘤TNM分期的相关性分析
二、RT-PCR结果
E-cadherin、β-catenin、 N-cadherin在正常睾丸及精原细胞瘤中均有表达,E-cadherin条带位置为91bp, N-cadherin条带位置为113bp,β-catenin条带位置为144bp,GAPDH条带位置为351bp。正常睾丸及精原细胞瘤E-cadherin积分吸光值分别为(54.45±3.85)、(5.43±2.78),差异有显著性(P<0.05)。正常睾丸及精原细胞瘤N-cadherin积分吸光值分别为(6.39±1.21)、(1.08±1.04),差异有显著性(P<0.05)。正常睾丸及精原细胞瘤β-catenin积分吸光值分别为(92.02±3.49)、(6.37±1.15),差异有显著性(P<0.05),见图2。
三、蛋白免疫印迹结果
E-cadherin、β-catenin、 N-cadherin在正常睾丸及精原细胞瘤中均有表达。E-cadherin条带位置为100kDa,β-catenin条带位置为90kDa,N-cadherin

图2 RT-PCR分析E-cadherin、N-cadherin、β-catenin在睾丸组织中的表达A、B、C分别为E-cadherin、N-cadherin、β-catenin在正常睾丸及精原细胞瘤中表达差异比较
A B C条带位置为97kDa,β-tublin条带位置为55KDa。正常睾丸及精原细胞瘤E-cadherin蛋白积分吸光值分别为(50.50±6.35)、(27.00±7.00),差异有显著性(P<0.05)。正常睾丸及精原细胞瘤N-cadherin蛋白积分吸光值分别为(51.00±5.61)、(27.00±9.00),差异有显著性(P<0.05)。正常睾丸及精原细胞瘤β-catenin蛋白积分吸光值分别为(37.60±3.23)、(13.80±1.60),差异有显著性(P<0.05),见图 3。
讨 论
精子发生指生精细胞在睾丸内经过一系列结构和功能改变,由生精上皮基底侧迁移至近腔侧,最终发育为精子的过程。睾丸内细胞间黏附在精子发生过程中起重要作用。支持细胞可通过细胞间黏附为各级生精细胞提供营养支持并维系其结构稳定。研究发现,钙黏附蛋白超家族成员在睾丸细胞间黏附中起重要作用[6]。E-cadherin是一类钙离子依赖性的跨膜糖蛋白,主要分布于各类上皮细胞膜上,由5个胞外区、一个跨膜区及胞内区构成,在细胞间黏附及信号转导过程中起重要作用[7]。Cadherins参与维持睾丸支持细胞极性、精子发生及腔内迁移等过程[8]。近期研究发现,E-cadherin在睾丸肿瘤发生过程中起关键作用[9]。肿瘤浸润转移常存在EMT现象, EMT分子表型改变表现为上皮表型E-cadherin降低,而间质表型N-cadherin升高[2]。

图 3 蛋白免疫印迹分析E-cadherin、β-catenin、N-cadherin在睾丸组织中的表达A: 正常睾丸及精原细胞瘤中E-cadherin、β-catenin、 N-cadherin的表达; B: 两组间不同蛋白表达水平比较
本实验采用免疫组织化学方法分析正常睾丸及精原细胞瘤中E-cadherin的分布及表达。与之前研究报道[9],E-cadherin仅存于正常睾丸细胞间连接处不同。我们发现睾丸支持细胞间紧密连接处及精子均可见E-cadherin表达,说明精子在进入附睾成熟前已有E-cadherin表达。研究表明,E-cadherin在精子中的定位随精子成熟而改变,从最初表达于精子头部到成熟后定位于精子赤道板及顶体后区,并在精子获能及精卵融合过程中起重要作用[10,11]。实验发现精原细胞瘤E-cadherin主要表达于肿瘤胞浆。蛋白免疫印迹及RT-PCR结果显示精原细胞瘤E-cadherin表达较正常睾丸显著下降(P<0.05)。通过分析精原细胞瘤免疫组化积分吸光度与肿瘤TNM分期的相关性,发现E-cadherin与肿瘤分期无显著相关(P>0.05,r1=0.2669)。
N-cadherin为钙依赖介导细胞间黏附的一类分子,主要分布于成人神经组织、肌肉及晶状体,与肿瘤演进密切相关。在多种肿瘤中N-cadherin上调,并增强肿瘤细胞侵袭性[12,13]。实验发现正常睾丸近基底部支持细胞紧密连接处可见N-cadherin表达,而与乳腺癌等肿瘤N-cadherin变化趋势相反,精原细胞瘤中未见其表达。N-cadherin与正常生精过程密切相关[14],因为在正常生精过程中,精原细胞分裂及各级生精细胞有基底部向腔内迁移的过程需要N-cadherin。蛋白免疫印迹及RT-PCR结果显示精原细胞瘤少量表达N-cadherin,且较正常睾丸显著下降(P<0.05)。表明N-cadherin在精原细胞瘤发生发展过程中具有特殊作用。近期研究发现,正常卵巢上皮细胞表达N-cadherin,而恶性卵巢肿瘤中N-cadherin下调,其变化趋势与精原细胞瘤相似[15]。体外实验显示,N-cadherin作为正常卵巢上皮细胞的存活因子,并抑制肿瘤的形成[16]。我们推测,睾丸中N-cadherin的作用与卵巢上皮细胞类似,即N-cadherin作为正常睾丸内生精细胞及支持细胞的存活因子,在维持睾丸支持细胞极性、精子发生及腔内迁移等过程起重要作用,并抑制肿瘤细胞的形成。
肿瘤浸润转移常存在EMT现象,EMT分子表型改变表现为上皮表型E-cadherin降低,间质表型N-cadherin升高。分析比较E-cadherin及N-cadherin在正常睾丸及精原细胞瘤中表达变化,正常睾丸中支持细胞与生精细胞存在类似EMT的现象,而精原细胞瘤未见典型EMT现象。由此提示,EMT在维持睾丸支持细胞极性、精子发生及腔内迁移等过程中可能起重要作用,而在精原细胞瘤发生及侵袭、转移等生物学过程中不起主要作用。所以,E-cadherin、N-cadherin可能仅在精原细胞瘤发生过程中起作用,而不影响肿瘤侵袭、转移。
E-cadherin常与β-catenin形成复合体,通过Wnt信号通路调控多能干细胞分化方向。正常睾丸E-cadherin-β-catenin复合体参与构成支持细胞间的连接。β-catenin是一类多功能信号转导分子,在睾丸生精细胞与支持细胞间黏附及胞内信号转导过程中发挥关键作用[17]。β-catenin 在睾丸肿瘤发生及分化过程中起重要作用[5]。研究发现,过度激活Wnt/β-catenin信号通路与小鼠睾丸支持细胞瘤的发生密切相关[18]。胞内β-catenin升高是Wnt信号通路激活的典型表现[19]。免疫组织结果显示,β-catenin仅表达于正常睾丸支持细胞间近基底部紧密连接处,呈环形紧扣生精细胞,精原细胞瘤胞浆内可见β-catenin表达。我们推测:一方面,精原细胞瘤发生过程中细胞连接处E-cadherin-β-catenin下调,破坏细胞间连接,进而影响正常生精过程;另一方面,肿瘤细胞胞内β-catenin出现,提示Wnt/ β-catenin信号通路激活可能在肿瘤发生过程中起重要作用。蛋白免疫印迹及RT-PCR结果显示精原细胞瘤β-catenin与E-cadherin表达一致,较正常睾丸显著下降(P<0.05)。通过分析精原细胞瘤免疫组化积分吸光度与肿瘤TNM分期的相关性,发现β-catenin与肿瘤分期无显著相关(P>0.05, r2=-0.2280)。提示E-cadherin-β-catenin复合体可能仅在精原细胞瘤发生过程中起作用,而不影响肿瘤侵袭及转移。
综上所述,通过分析正常睾丸及精原细胞瘤中E-cadherin、 β-catenin、 N-cadherin的分布及表达,本实验发现精原细胞瘤中E-cadherin 、β-catenin、N-cadherin表达较正常睾丸显著下降,且与肿瘤TNM分期及EMT无显著相关,提示E-cadherin 、β-catenin、N-cadherin的低表达可能导致精原细胞瘤的发生,而精原细胞瘤侵袭及转移的生物学过程可能存在一种不同于EMT的途径。本研究分析了E-cadherin 、β-catenin、N-cadherin在正常睾丸及精原细胞瘤中的表达及分布,进一步将深入研究其在肿瘤发生中的分子机制。
1 刘仁伟, 吴志清, 冯丰坔, 等. 睾丸精原细胞瘤的MRI表现. 中国医学影像技术 2012; 28(5): 982-985
2 Kokkinos MI, Wafai R, Wong MK, et al. Vimentin and epithelial-mesenchymal transition in human breast cancer observations in vitro and in vivo. Cells Tissues Organs 2007; 185(1-3): 191-203
3 Saitoh M, Shirakihara T, Miyazono K. Regulation of the stability of cell surface E-cadherin by the proteasome. Biochem Biophys Res Commun 2009; 381(4): 560-565
4 Cavallaro U, Schaffhauser B, Christofori G. Cadherins and the tumour progression: is it all in a switch? Cancer Lett 2002; 176(2): 123-128
5 Honecker F, Kersemaekers AM, Molier M, et al. Involvement of E-cadherin and beta-catenin in germ cell tumours and in normal male fetal germ cell development. J Pathol 2004; 204(2): 167-174
6 Johnson KJ, Patel SR, Boekelheide K. Multiple cadherin superfamily members with unique expression pro les are produced in rat testis. Endocrinology 2000; 141(2): 675-683
7 Obrink B. Epithelial cell adhesion molecules. Exp Cell Res 1986; 163(1): 1-21
8 赵丽, 刁瑞英, 刘晓翌, 等. E-cadherin在精子发生及精卵融合过程中的作用. 中国优生与遗传杂志 2012;20(1): 1-2, 4
9 Batistatou A, Scopa CD, Ravazoula P, et al. Involvement of dysadherin and E-cadherin in the development of testicular tumours. Br J Cancer 2005; 93(12): 1382-1387
10 Purohit S, Brahmaraju M, Palta A, et al. Impaired E-cadherin expression in human spermatozoa in a male factor infertility subset signi es E-cadherin-mediated adhesion mechanisms operative in sperm-oolemma interactions. Biochem Biophys Res Commun 2004;316(3): 903-909
11 Fazeli A, Duncan AE, Watson P, et al. Sperm-oviduct interaction: induction of capacitation and preferential binding of uncapacitated spermatozoa to oviductal epithelial cells in porcine species. Biol Reprod 1999; 60(4):879-886
12 Li G, Satyamoorthy K, Herlyn M. N-cadherin-mediated intercellular interactions promote survival and migration of melanoma cells. Cancer Res 2001; 61(9): 3819-3825
13 Hazan RB, Phillips GR, Qiao RF, et al. Exogenous expression of N-cadherin in breast cancer cells induces cell migration, invasion, and metastasis. J Cell Biol 2000;148(4): 779-790
14 Newton SC, Blaschuk OW, Millette CF. N-cadherin mediates Sertoli cell-spermatogenic cell adhesion. Dev Dyn 1993; 197(1): 1-13
15 Marques FR, Fonsechi-Carvasan GA, De Angelo Andrade LA, et al. Immunohistochemical patterns for alpha- and beta-catenin, E- and N-cadherin expression in ovarian epithelial tumors. Gynecol Oncol 2004; 94(1): 16-24
16 Pon YL, Auersperg N, Wong AS. Gonadotropins regulate N-cadherin-mediated human ovarian surface epithelial cell survival at both post-translational and transcriptional levels through a cyclic AMP/protein kinase A pathway. J Biol Chem 2005; 280(15): 15438-1544817 Maiese K, Li F, Chong ZZ, et al. The Wnt signaling pathway: aging gracefully as a protectionist? Pharmacol Ther 2008; 118(1): 58-81
18 Chang H, Guillou F, Taketo MM, et al. Overactive betacatenin signaling causes testicular sertoli cell tumor development in the mouse. Biol Reprod 2009; 81(5): 842-849
19 Tanwar PS, Kaneko-Tarui T, Zhang L, et al. Constitutive WNT/beta-catenin signaling in murine Sertoli cells disrupts their differentiation and ability to support spermatogenesis. Biol Reprod 2010; 82(2): 422-432
(2015-03-28收稿)
Expression of E-cadherin, N-cadherin and β-catenin in seminomas*
Zheng Wenzhong1, Chen Jianbo1, Zhang Shiqiang2, Liu Chong3, Zhang Enpu1, Li Minghua1, Li Xianxin1**
1. Department of Urology, Peking University Shenzhen Hospital; Guangdong Key Labrotory of Male Reproductive and Genetic,Shenzhen , Guang dong 518036, China; 2. Department of Urology, Sun Yat-sen University Cancer Center;
3. Department of Gynaecology and Obstetrics, Peking University Shenzhen Hospital Corresponding author: Li Xianxin, E-mail: xianxinli@163.com
Objective To investigate the expressions of E-cadherin、N-cadherin and β-catenin in seminomas and their signi cance in the development of seminomas. Methods The expressions of E-cadherin、N-cadherin and β-catenin in 26 seminomas tissues and 10 normal testicular tissues were detected by immunohistochemical staining, of which the relationships to clinical feature of seminomas and to EMT were analyzed. The expression level of E-cadherin, N-cadherin and β-catenin were further con rmed by RT-PCR and Western Blot. Results E-cadherin and β-catenin were detected in all normal testicular tissues and seminomas. N-cadherin were detected in tight junctions (TJs) and adherin junctions(AJs) between sertoli cells. Immunohistochemical staining showed that there were absent N-cadherin in testicular tissues of seminomas. Downregulation of Ecadherin-β-catenin complexes in seminomas were not correlated with TNM stages (P>0.05,r1=0.2669, r2=-0.2280). RT-PCR and WesternBlot results indicated that the expression of E-cadherin, N-cadherin andβ-catenin were all signi cantly decreased in testicular tissue of seminomas patients as compared with that in normal testis tissues (P<0.05). Conclusion Low expression of Ecadherin-β-catenin complexes in seminomas were not correlated with TNM stags and no signi cant EMT was found in the testicular cancer, indicating that those proteins may play an important role in tumorigenesis but not metastasis of seminomas.
seminoma; E-cadherin; β-catenin; N-cadherin; EMT
10.3969/j.issn.1008-0848.2015.07.003
R 737.21
资助: 本课题受国家自然科学基金(No.81572513); 广东省自然科学基金(S2012010008200);深圳市科技创新委员会基础研究计划(JCYJ20150403091443334)资助**
, E-mail: xianxinli@163.com
