青兰属植物甘青青兰化学成分研究
2015-07-28左马怡李干鹏
左马怡,杨 超,田 倩,罗 阳,杨 淬,曾 亮,李干鹏
(云南民族大学民族药资源化学国家民委-教育部重点实验室,云南昆明650500)
甘青青兰(Dococe Phalumtanguticum Maxim.)系唇形科(Labiatae)青兰属(Dracocephalum)多年蔓生草本植物[1],别名唐古特青兰、陇塞青兰,藏名译音:知羊故、知羊高.甘青青兰是一种传统中药,其性寒,味甘、苦,具有香味;有和胃疏肝、清热利水、止咳化痰等功能,是藏医常用唇形科草本植物药材,一般用其的地上干燥部分入药,可治创伤、溃疡、头晕、胃炎、关节炎和肝炎等症[2].其常生长于海拔1 900~4 600 m的地方,在干燥河谷的谷岸、山野路旁、草滩或高山草地、田边及松林边缘生长.主要分布于西藏(东部)、青海(东南部)、甘肃(西南部)以及四川(西部)等地[3].
青兰属植物化学成分复杂,主要可分为挥发油类、黄酮及黄酮苷类、植物甾醇类、有机酸及其酯类、无机元素等,国内外研究报道多为黄酮类化合物,也有二萜、三萜等[4];为了更好地开发利用这一药用植物资源,搞清甘青青兰的药效物质基础,对甘青青兰乙醇提取液的化学成分进行研究,并对其中部分化合物做抗肿瘤活性测定;以期对今后甘青青兰的药理研究、临床应用,以及藏药的新药研发提供有效的科学依据.
1 实验部分
1.1 实验药材、主要试剂与仪器
仪器:核磁共振谱仪AVANCEⅢ(瑞士BRUKER公司);旋转蒸发仪N-1100D-WD(上海EYELA仪器有限公司);暗箱式紫外分析仪ZF-20D(巩义市予华仪器有限公司);红外分光光度计Nicoiet Is10(美国赛默飞世尔科技有限公司;高效液相色谱仪安捷伦1200(美国安捷伦公司).
试剂:甲醇、乙醇、丙酮、正丁醇等有机试剂均为分析纯,水为纯净水.
药材:甘青青兰全草于2013年8月购于云南省迪庆自治州藏医院,植物标本经藏医阿荣鉴定.
1.2 提取与分离
将采集的甘青青兰全草7.8 kg,经粉碎机粉碎(过0.216nm筛),用95%的乙醇浸泡在25 L的渗漉桶中,冷提4次,每次5~7滴.提取液过滤、在56℃水浴下用旋转蒸发仪将提取液减压浓缩,回收溶剂,然后水浴挥干,得总浸膏约780 g.将适量温水加入所得浸膏中使其溶解,分别用乙酸乙酯、正丁醇于室温下连续萃取4次,将不同萃取液分别合并,用旋转蒸发仪减压浓缩,依次制得甘青青兰不同极性部位萃取物:乙酸乙酯部分浸膏约72 g、正丁醇部分浸膏约123 g、水相部分浸膏206 g.将乙酸乙酯部位上硅胶柱层析,用氯仿/甲醇为洗脱剂梯度洗脱,收集各组分,再经反复柱色谱分离、纯化,得到化合物1(7.1 mg)、化合物2(22.8 mg)、化合物3(5.8 mg)、化合物4(11.7 mg)、化合物5(7.9 mg)、化合物6(7.2 mg).
2 结果与讨论
2.1 结构鉴定
化合物1 分子式为C18H16O8;深褐色粉末,溶于甲醇;1H NMR(CD3OD,400 MHz)δ:7.27(1H,d,J=1.6 Hz,H -2),7.07(1H,d,J=7.9 Hz,H -5),7.02(1H,dd,J=1.9,8.0 Hz,H -6),7.77(1H,d,J=16.0 Hz,H - 7),6.49(1H,d,J=15.6 Hz,H - 8),6.13(1H,d,J=4.0 Hz,H -2.),6.88(1H,d,J=8.4 Hz,H-5'),3.57(2H,m,H -7'),5.49(m,H -8');13C NMR(CD3OD,100 MHz)δ:127.1(C -1),114.0(C -2),146.2(C -3),147.7(C -4),116.4(C -5),123.2(C -6),147.7(C -7),116.4(C -8),168.5(C -9),129.0(C -1'),117.5(C -2'),146.2(C -3'),144.8(C -4'),116.2(C -5'),121.8(C -6'),37.5(C -7'),74.4(C-8').以上数据与文献[5]报道一致,化合物1鉴定为迷迭香酸.
化合物2 分子式为C19H18O8;黄色粉末,溶于甲醇;1H NMR(CD3OD,400 MHz)δ:7.05(1H,d,J=2.0 Hz,H -2),6.58(1H,d,J=1.6 Hz,H -5),6.80(1H,dd,J=4.4,8.0 Hz,H - 6),7.57(1H,d,J=16.0 Hz,H -7),6.28(1H,d,J=14.6 Hz,H - 8),6.95(1H,d,J=1.6 Hz,H -2'),6.72(1H,d,J=2.0 Hz,H -5'),3.04(2H,m,H -7'),5.21(1H,dd,J=5.2 Hz,11.6,H - 8');13C NMR(CD3OD,100 MHz)δ:127.5(C -1),114.0(C -2),146.6(C -3),147.9(C -4),116.2(C -5),123.2(C -6),147.9(C -7),116.4(C -8),168.3(C -9),128.7(C -1'),117.1(C -2'),146.6(C -3'),145.2(C -4'),117.5(C -5'),120.8(C -6'),37.7(C -7'),74.8(C-8'),52.6(-OCH3).以上数据与文献[5]报道一致,化合物2鉴定为迷迭香酸甲酯.
化合物3 分子式为C10H11O5;黄色粒状,溶于甲醇;1H NMR(CD3OD,400 MHz)δ:6.67(1H,d,J=9.6 Hz,H -5),6.53(s,br,H -6),7.91(1H,d,J=6.4 Hz,H -8),3.34(3H,s,- COOCH3);13C NMR(CD3OD,100 MHz)δ:129.7(C -1),117.5(C -2),145.0(C -3),146.0(C -4),116.1(C -5),121.7(C -6),73.3(C -8),175.8(C -9).以上数据与文献[6]报道一致,化合物3鉴定为2,3-2H-3-羟基-咖啡酸甲酯.
化合物4 分子式为C9H8O4;黄色结晶,溶于甲醇;1H NMR(CD3OD,400 MHz)δ:6.93(1H,d,J=8.0 Hz H -2),6.78(1H,d,J=2.4 Hz H -5),7.55(1H,d,J=2.4 Hz,H - 7),6.23(1H,J=2.4 Hz,H -8);13C NMR(CD3OD,100 MHz)δ:127.7(C -1),115.1(C -2),146.7(C -3),147.0(C -4),116.4(C -5),122.8(C -6),147.0(C -7),115.5(C-8),171.0(C-9).以上数据与文献[6]报道一致,化合物4鉴定为咖啡酸.
化合物5 分子式为C7H6O3;白色针状结晶,溶于甲醇;1H NMR(CD3OD,400 MHz)δ:7.88(2H,dd,J=8.0 Hz,2 -H,6 -H),6.81(2H,m,3 -H,5 -H);13C NMR(CD3OD,100 MHz)δ:132.9(C -1),133.2(C -2,C -6),114.2(C -3,C -5),163.1(C-4),170.1(C -7).以上数据与文献[7]报道一致,化合物5鉴定为对羟基苯甲酸.
化合物6 分子式为C7H6O4;黄色片状,溶于甲醇;1H NMR(CD3OD,400 MHz)δ:7.41(1H,d,J=0.8 Hz,H -2),6.76(1H,d,J=8.0 Hz,H -5),7.44(s,br,H - 6),6.23(1H,J=2.4 Hz,H - 8);13C NMR(CD3OD,100 MHz)δ:122.1(C -1),114.4(C -2),144.3(C -3),147.0(C -4),116.4(C -5),122.6(C -6),171.2(C -7).以上数据与文献[8]报道一致,化合物6鉴定为原茶酸.
2.2 抗肿瘤活性测定
将对数生长期的肿瘤细胞Hep G2、Hela、肺癌细胞株用0.25% 胰蛋白酶消化,然后用含10%胎牛血清,1%青链霉素的DMEM完全培养液吹打制成细胞悬液,分别将肿瘤细胞稀释至5.0×10-4mg/mL,再将其接种至96孔培养板中,每孔加入198 μL肿瘤细胞悬液,于37℃、5%CO2的培养箱内培养24 h.待细胞完全贴壁后,各实验组每 孔 加 入 含 不同 浓 度(10-4、10-5、10-6、10-7mmol·L-1)待测化合物 2 μL.阴性对照组加入含等体积药物溶剂的DMEM培养液200 μL.另单设不含细胞的DMEM培养液200 μL为空白对照组.阳性对照组采用以上相同浓度和体积的 DDP.每一个浓度设3个平行孔,培养24 h后各孔分别加入5 mg/mL的 MTT溶液20 μL,再培养4 h后,吸去各孔培养液,分别加入100μL DMSO,震荡20 min后用酶标仪在570 nm波长处测定各孔吸收度(OD)值.用以下公式计算药物各个质量浓度对肿瘤细胞的抑制率:
抑制率(%)=[1-(OD实验 -OD空白)/(OD对照-OD空白)]×100%
以同一药物的不同浓度对肿瘤细胞生长抑制率作图,可得到剂量反应曲线,根据线性回归方程求出该药物对细胞生长抑制率(IC50).
实验对分离提取的单体化合物1、2、3进行了体外抗肿瘤活性测定,结果表明3个化合物对Hep G-2、Hela、肺癌细胞株均有一定的抗肿瘤活性.化合物1对Hela细胞株具有较好体外抗肿瘤活性.化合物3对Hep G-2和肺癌细胞株具有较好的抗肿瘤活性.
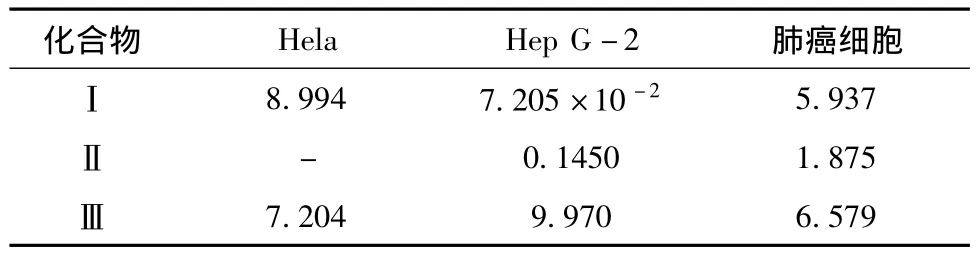
表1 化合物Ⅰ、Ⅱ、Ⅲ对Hela,Hep G-2、肺癌细胞株的IC50 μmol·L-1
3 结语
从甘青青兰乙酸乙酯部位中分离得到6个化学物.通过现代波谱技术对它们进行结构鉴定,6个化合物分别为迷迭香酸(1),迷迭香酸甲酯(2),2,3-2H-3-羟基-咖啡酸甲酯(3),咖啡酸(4),对羟基苯甲酸(5),原茶酸(6).并对其中3个化合物进行了抗肿瘤活性测定,化合物1、3具有较好的体外抗肿瘤活性,值得进一步深入研究.
[1]国家中医药管理局《中华本草》编委会.中华本草:藏药卷[M].上海:上海科学技术出版社,2002:278-279.
[2]南京中医药大学.中药大辞典[M].2版.上海:上海科学技术出版社,2006:2687-2688.
[3]中国科学院西北为原生物研究所.藏药志[M]青海:青海人民出版社,1991:183.
[4]刘建英,刘玉梅.青兰属植物的化学成分及药理作用研究进展[J].食品科学,2012,33(13):314 -319.
[5]高雪.三种菊科植物和一种唇形科植物化学成分及其生物活性研究[D].兰州:兰州大学,2007.
[6]李云秋,冯育林,杨世林,等.刺山柑化学成分的研究[J].中草药,2007,38(4):510 -512.
[7]李静,黎莲娘.南丹参化学成分研究[J].中草药,1994,25(7):347-349.
[8]CHEN Z W,GU WH,WANG W Z.Study on the polyphenolic compounds of Salvia miltiorrhiza[J].药学学报,1981,9(16):24.
