复合低聚肽增强免疫力功能研究
2015-07-25尹利端黄静张厚森董丛超烟台新时代健康产业有限公司山东烟台64006国家质检总局标准与技术法规研究中心北京0008江苏省理化测试中心江苏南京004
尹利端,黄静,张厚森,董丛超(.烟台新时代健康产业有限公司,山东烟台64006;.国家质检总局标准与技术法规研究中心,北京0008;.江苏省理化测试中心,江苏南京004)
复合低聚肽增强免疫力功能研究
尹利端1,黄静2,张厚森3,董丛超1
(1.烟台新时代健康产业有限公司,山东烟台264006;2.国家质检总局标准与技术法规研究中心,北京100028;3.江苏省理化测试中心,江苏南京210042)
摘要:对复合低聚肽增强免疫力的功能进行研究。分别以0.4、0.8、2.4 g/kg·BW(相当于人体推荐量的5、10、30倍)剂量的复合低聚肽对小鼠连续灌胃30 d,分别测定小鼠的细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK细胞活性。结果显示,体液免疫功能、单核-巨噬细胞吞噬功能、NK细胞活性均为阳性,细胞免疫功能为阴性,表明复合低聚肽具有增强免疫力功能。
关键词:复合低聚肽;增强免疫力;保健食品
免疫力是机体自身的一种主动防御机制,对维持机体健康具有十分重要意义。现代城市中相当多的人群由于长期缺乏运动、生活不规律、工作压力大等原因,导致机体免疫力低下,严重危害身体健康。开发安全、有效的具有增强免疫力功能的保健食品,对于改善免疫力低下人群的健康状况具有重要意义。低聚肽是以大分子蛋白质为原料,经酶解、分离、纯化等过程制成的蛋白水解产物。研究表明,低聚肽具有免疫调节、降血压、抗肿瘤、降血脂、抗氧化、促进矿物质转运等功能[1-3]。作为一类新型功能性食品原料,低聚肽以其丰富的保健功能、优良的加工特性、易于被人体吸收等特点而备受业界关注。本研究按照《保健食品检验与评价技术规范》(2003版)的试验要求[4],对由大豆低聚肽和胶原低聚肽组成的复合低聚肽样品进行了增强免疫力功能的研究,以期进一步掌握复合低聚肽增强免疫力的作用效果和剂量范围,为低聚肽在增强免疫力保健食品的开发方面提供科学参考。
1 材料和方法
1.1试验样品
复合低聚肽由某科技公司提供,规格4.8 g/袋。人体口服推荐用量为每人每日1次,每次1袋。
1.2试验动物与分组
选用SPF级昆明种雌性小鼠160只,6周龄~8周龄,体重18 g~22 g。每40只小鼠为1大组,共4大组。免疫一组用于迟发型变态反应(DTH)实验、血清溶血素的测定、抗体生产细胞数的测定;免疫二组用于小鼠碳廓清实验;免疫三组用于小鼠腹腔巨噬细胞吞噬鸡红细胞实验;免疫四组用于小鼠淋巴细胞转化实验和小鼠NK细胞活性测定。每免疫大组小鼠分为对阴性对照组、低、中、高剂量组,各10只。
1.3主要仪器与试剂
光学显微镜:日本Olympus株式会社;紫外分光光度计:日本岛津株式会社;酶联免疫检测仪:美国Thermo公司;CO2培养箱:上海岛析公司。刀豆蛋白A、青链霉素:美国Sigma公司;RPMI1640培养液、小牛血清:美国Gibco公司;绵羊红细胞(SRBC)、氧化型辅酶I、琼脂糖、四甲基偶氮唑盐(MTT):美国Amersco公司。
1.4剂量选择与受试物给予方式
试验样品的推荐用量为每人每日4.8 g,每人按60 kg体重计,相当于0.08 g/d/kg·BW,按相当于人体推荐量的5、10、30倍确定小鼠的低、中、高剂量,即各组小鼠每日剂量分别为0.4、0.8、2.4 g/kg·BW。用蒸馏水配制试验样品,低、中、高剂量样品浓度分别为20、40、120 g/L,按20mL/kg·BW的体积给予相应剂量组动物灌胃,对照组以等体积蒸馏水,每日灌胃1次,连续给予30 d后测定各项免疫指标。
1.5试验方法
脏器/体重比值测定:小鼠称重后处死,取出胸腺、脾脏,去尽筋膜及表面血污,称重,计算胸腺体重比值及脾脏体重比值。
其他免疫指标测定:小鼠DTH实验(足跖增厚法)、ConA诱导的小鼠脾淋巴细胞转化实验(MTT法)、抗体生成细胞测定(Jerne改良玻片法)、小鼠血清溶血素测定、小鼠碳廓清实验、小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法)、小鼠NK细胞活性测定等按照《保健食品检验与评价技术规范》(2003版)规定的方法进行。
1.6试验数据统计
采用SPSS软件进行试验数据统计和方差分析。
2 结果与分析
2.1复合低聚肽对小鼠体重的影响
受试样品对各免疫组小鼠体重的影响结果见表1、表2、表3、表4。
表1 复合低聚肽对小鼠(免疫一组)体重的影响(x±SD)Tab le1 Effectof com pound oligopeptideonm iceweightof group one(±SD)
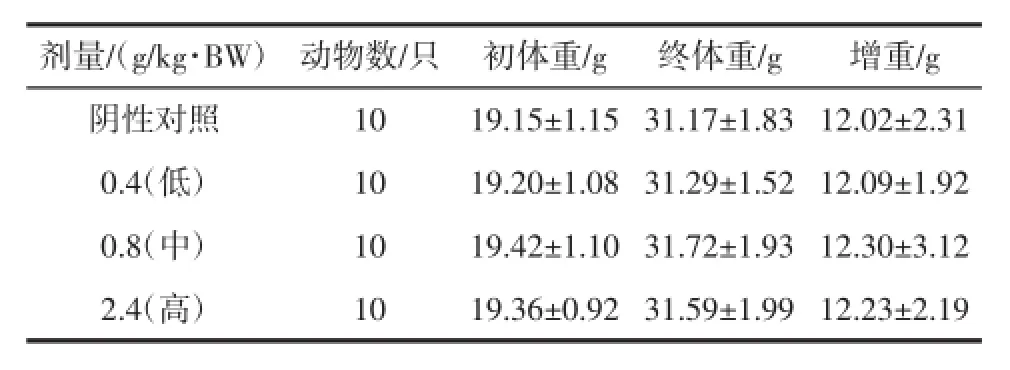
表1 复合低聚肽对小鼠(免疫一组)体重的影响(x±SD)Tab le1 Effectof com pound oligopeptideonm iceweightof group one(±SD)
剂量/(g/kg·BW) 动物数/只 初体重/g 终体重/g 增重/g阴性对照10 19.15±1.15 31.17±1.83 12.02±2.31 0.4(低) 10 19.20±1.08 31.29±1.52 12.09±1.92 0.8(中) 10 19.42±1.10 31.72±1.93 12.30±3.12 2.4(高) 10 19.36±0.92 31.59±1.99 12.23±2.19
表2 复合低聚肽对小鼠(免疫二组)体重的影响(±SD)Table2 Effectof compound oligopeptide onm iceweightofgroup two(±SD)
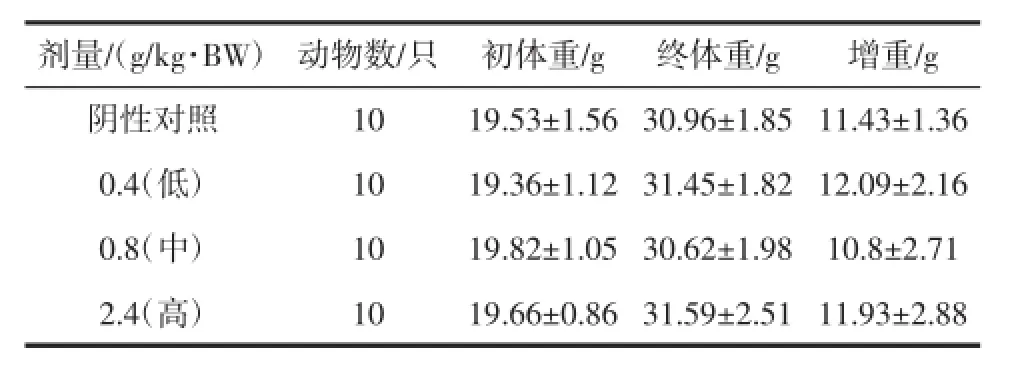
表2 复合低聚肽对小鼠(免疫二组)体重的影响(±SD)Table2 Effectof compound oligopeptide onm iceweightofgroup two(±SD)
剂量/(g/kg·BW) 动物数/只 初体重/g 终体重/g 增重/g阴性对照10 19.53±1.56 30.96±1.85 11.43±1.36 0.4(低) 10 19.36±1.12 31.45±1.82 12.09±2.16 0.8(中) 10 19.82±1.05 30.62±1.98 10.8±2.71 2.4(高) 10 19.66±0.86 31.59±2.51 11.93±2.88
表3 复合低聚肽对小鼠(免疫三组)体重的影响(±SD)Table3 Effectof compound oligopeptide onm iceweightofgroup three(x±SD)
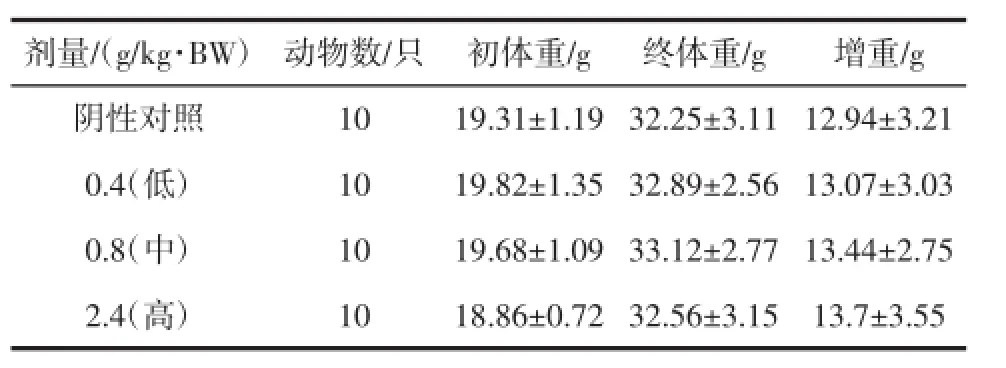
表3 复合低聚肽对小鼠(免疫三组)体重的影响(±SD)Table3 Effectof compound oligopeptide onm iceweightofgroup three(x±SD)
剂量/(g/kg·BW) 动物数/只 初体重/g 终体重/g 增重/g阴性对照10 19.31±1.19 32.25±3.11 12.94±3.21 0.4(低) 10 19.82±1.35 32.89±2.56 13.07±3.03 0.8(中) 10 19.68±1.09 33.12±2.77 13.44±2.75 2.4(高) 10 18.86±0.72 32.56±3.15 13.7±3.55
表4 复合低聚肽对小鼠(免疫四组)体重的影响(±SD)Table4 Effectof compound oligopeptide onm iceweightofgroup four(x±SD)
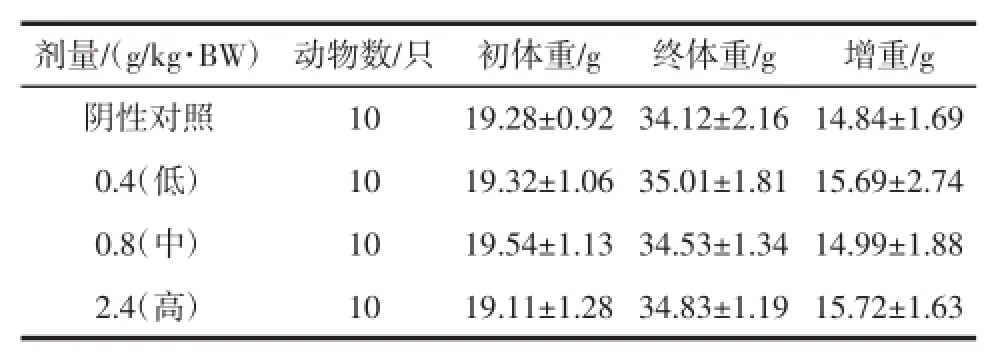
表4 复合低聚肽对小鼠(免疫四组)体重的影响(±SD)Table4 Effectof compound oligopeptide onm iceweightofgroup four(x±SD)
剂量/(g/kg·BW) 动物数/只 初体重/g 终体重/g 增重/g阴性对照10 19.28±0.92 34.12±2.16 14.84±1.69 0.4(低) 10 19.32±1.06 35.01±1.81 15.69±2.74 0.8(中) 10 19.54±1.13 34.53±1.34 14.99±1.88 2.4(高) 10 19.11±1.28 34.83±1.19 15.72±1.63
由表1、表2、表3、表4可知,各剂量组小鼠在试验初、末期体重变化与阴性对照组无显著性差异(P>0.05),小鼠增重与阴性对照组比较无显著性差异(P>0.05),表明受试样品对小鼠体重无影响。
2.2复合低聚肽对小鼠脏器/体重比值的影响
受试样品对小鼠脏器/体重比值影响的试验结果见表5。
表5 复合低聚肽对小鼠脏器/体重比值的影响(x±SD)Table 5 Effect of com pound oligopeptideonm ice imm uneorgan/ bodyweight ratio(±SD)
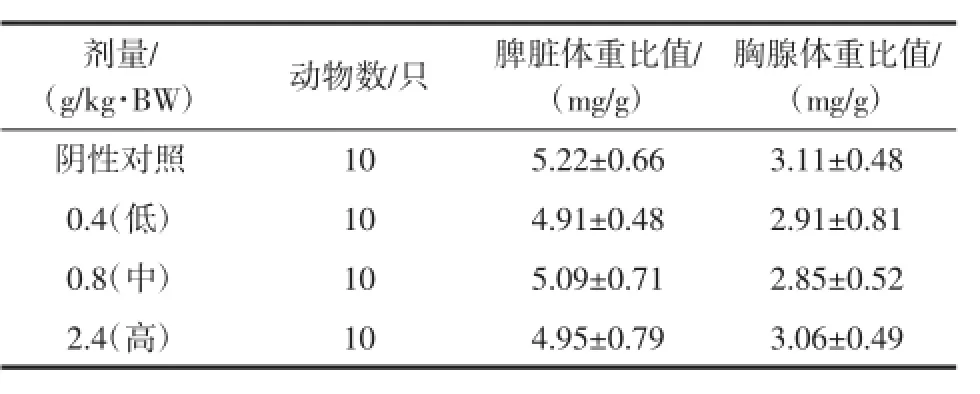
表5 复合低聚肽对小鼠脏器/体重比值的影响(x±SD)Table 5 Effect of com pound oligopeptideonm ice imm uneorgan/ bodyweight ratio(±SD)
(g/kg·BW) 动物数/只 脾脏体重比值/ (mg/g)胸腺体重比值/ (mg/g)阴性对照10 5.22±0.66 3.11±0.48 0.4(低) 10 4.91±0.48 2.91±0.81 0.8(中) 10 5.09±0.71 2.85±0.52 2.4(高) 10 4.95±0.79 3.06±0.49剂量/
由表5可知,经口给予小鼠受试样品30 d,小鼠的脾脏体重比值和胸腺体重比值与阴性对照组比较,各剂量组均无显著性差异(P>0.05),表明受试样品对小鼠的免疫器官体重比值无影响。
2.3复合低聚肽对小鼠细胞免疫功能的影响
受试样品对小鼠迟发型变态反应及淋巴细胞增殖能力影响的试验结果见表6。
表6 复合低聚肽对小鼠迟发型变态反应及淋巴细胞增殖能力的影响±SD)Tab le6 Effectof com pound oligopeptideon delayed type hypersensitivity and lym phocyte transform ation capability inm ice (±SD)
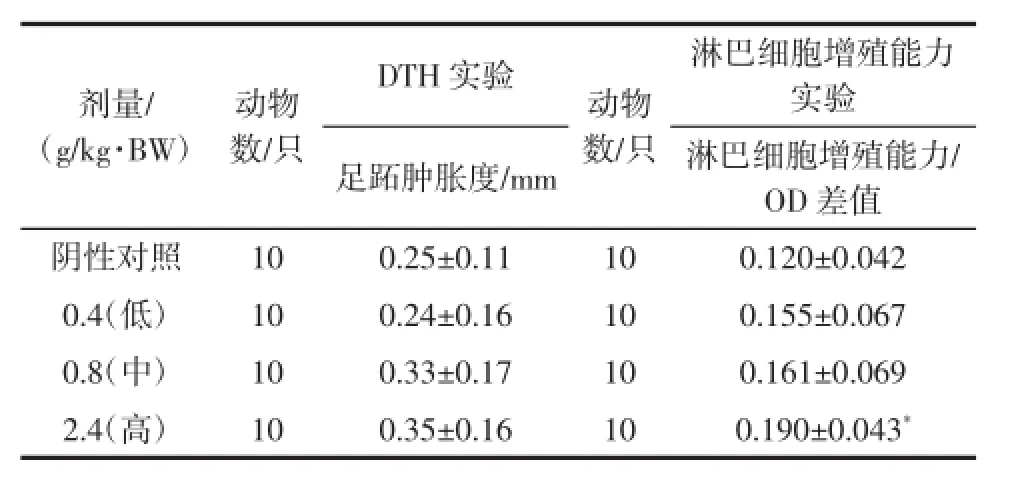
表6 复合低聚肽对小鼠迟发型变态反应及淋巴细胞增殖能力的影响±SD)Tab le6 Effectof com pound oligopeptideon delayed type hypersensitivity and lym phocyte transform ation capability inm ice (±SD)
注:*表示与阴性对照组比较,具有显著性差异(P<0.05)。
剂量/ (g/kg·BW)动物数/只淋巴细胞增殖能力实验足跖肿胀度/mm 淋巴细胞增殖能力/ OD差值阴性对照10 0.25±0.11 10 0.120±0.042 0.4(低) 10 0.24±0.16 10 0.155±0.067 0.8(中) 10 0.33±0.17 10 0.161±0.069 2.4(高) 10 0.35±0.16 10 0.190±0.043*DTH实验 动物数/只
由表6可知,在绵羊红细胞诱导的小鼠迟发型变态反应试验中,受试样品各剂量组足跖增厚值与对照组比较均无显著性差异。对ConA诱导的小鼠脾淋巴细胞转化试验中,各剂量组光密度差值均高于对照组,且高剂量组具有显著性差异(P<0.05),表明受试样品具有促进小鼠淋巴细胞增殖转化能力的作用。
2.4复合低聚肽对小鼠体液免疫的影响
受试样品对小鼠抗体生成细胞数及血清溶血素水平影响的试验结果见表7。
表7 复合低聚肽对小鼠抗体生成细胞数及血清溶血素水平的影响(±SD)Table7 Effect of com pound oligopeptideon antibody p roducing cellsand blood-serum erythrocytolysin inm ice(±SD)
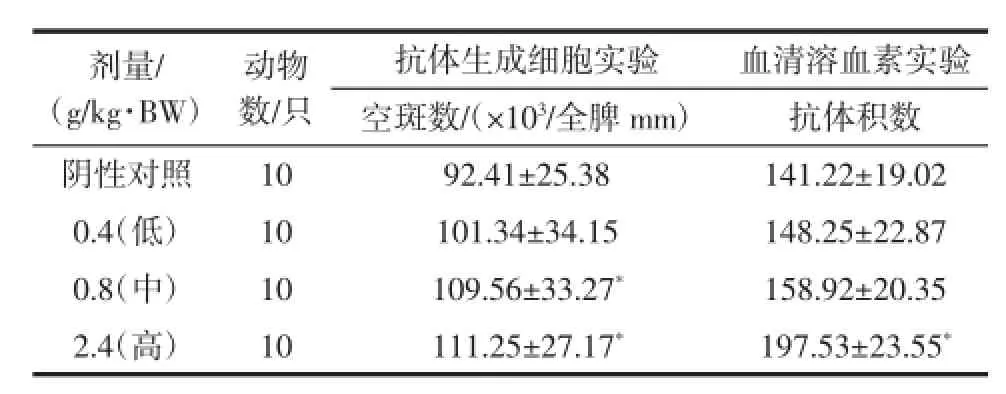
表7 复合低聚肽对小鼠抗体生成细胞数及血清溶血素水平的影响(±SD)Table7 Effect of com pound oligopeptideon antibody p roducing cellsand blood-serum erythrocytolysin inm ice(±SD)
注:*表示与阴性对照组比较,具有显著性差异(P<0.05)。
剂量/ (g/kg·BW)抗体生成细胞实验 血清溶血素实验空斑数/(×103/全脾mm) 抗体积数阴性对照10 92.41±25.38 141.22±19.02 0.4(低) 10 101.34±34.15 148.25±22.87 0.8(中) 10 109.56±33.27* 158.92±20.35 2.4(高) 10 111.25±27.17* 197.53±23.55*动物数/只
由表7可知,各剂量组小鼠的抗体生成细胞数均高于阴性对照组,并且中、高剂量组与阴性对照组比较具有显著性差异(P<0.05),表明受试样品具有增加小鼠抗体生成细胞数的能力。小鼠血清溶血素试验中,高剂量组的抗体积数与对照组相比具有显著性差异(P<0.05),表明受试样品具有提高小鼠血清溶血素水平的作用。
2.5复合低聚肽对小鼠单核-巨噬细胞碳廓清能力的影响
受试样品对小鼠单核-巨噬细胞碳廓清能力影响的试验结果见表8。
表8 复合低聚肽对小鼠单核-巨噬细胞碳廓清能力的影响(x±SD)Table 8 Effectof com pound oligopeptideon carbon-clearance by mononuclear-macrophage inmice(±SD)

表8 复合低聚肽对小鼠单核-巨噬细胞碳廓清能力的影响(x±SD)Table 8 Effectof com pound oligopeptideon carbon-clearance by mononuclear-macrophage inmice(±SD)
注:*表示与阴性对照组比较,具有显著性差异(P<0.05);**表示与阴性对照组比较,具有极显著性差异(P<0.01)。
剂量/(g/kg·BW) 动物数/只 吞噬指数阴性对照10 5.22±0.61 0.4(低) 10 6.01±0.71*0.8(中) 10 6.09±0.66*2.4(高) 10 6.65±0.58**
由表8可知,与阴性对照组比较,复合低聚肽各剂量组小鼠单核-巨噬细胞碳廓清能力明显增加,且具有显著性差异,其中高剂量组对小鼠单核-巨噬细胞碳廓清能力影响非常显著(P<0.01),表明受试样品具有促进小鼠单核-巨噬细胞碳廓清能力的作用。
2.6复合低聚肽对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响
受试样品对小鼠腹腔巨噬细胞吞噬鸡红细胞能力影响的试验结果见表9。
表9 复合低聚肽对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响(±SD)Table9 Effectof com pound oligopeptideon capability of phagocytizing chicken redcellsby peritonealmacrophage inm ice (±SD)
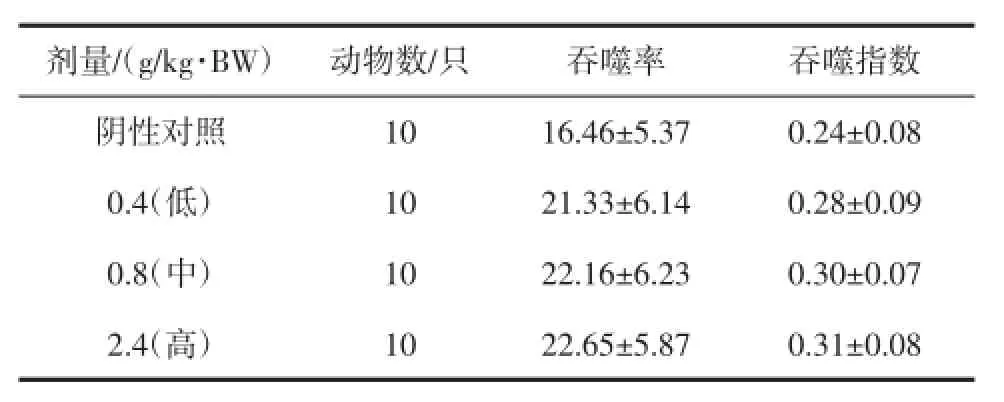
表9 复合低聚肽对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响(±SD)Table9 Effectof com pound oligopeptideon capability of phagocytizing chicken redcellsby peritonealmacrophage inm ice (±SD)
剂量/(g/kg·BW) 动物数/只 吞噬率 吞噬指数阴性对照10 16.46±5.37 0.24±0.08 0.4(低) 10 21.33±6.14 0.28±0.09 0.8(中) 10 22.16±6.23 0.30±0.07 2.4(高) 10 22.65±5.87 0.31±0.08
由表9可知,与阴性对照组比较,受试样品各剂量组对小鼠腹腔巨噬细胞吞噬鸡红细胞的能力均具有增加的趋势,但均没有显著性差异(P>0.05)。
2.7复合低聚肽对小鼠NK细胞活性的影响
受试样品对小鼠NK细胞活性影响的试验结果见表10。
由表10可知,与阴性对照组比较,受试样品各剂量组对小鼠NK细胞活性有增加的趋势,且高剂量组具有显著性差异(P<0.05),表明受试样品具有提高小鼠NK细胞活性的作用。
表10 复合低聚肽对小鼠NK细胞活性的影响(±SD)Tab le 10 Effect of com pound oligopeptideon activity of NK cells inm ice(±SD)
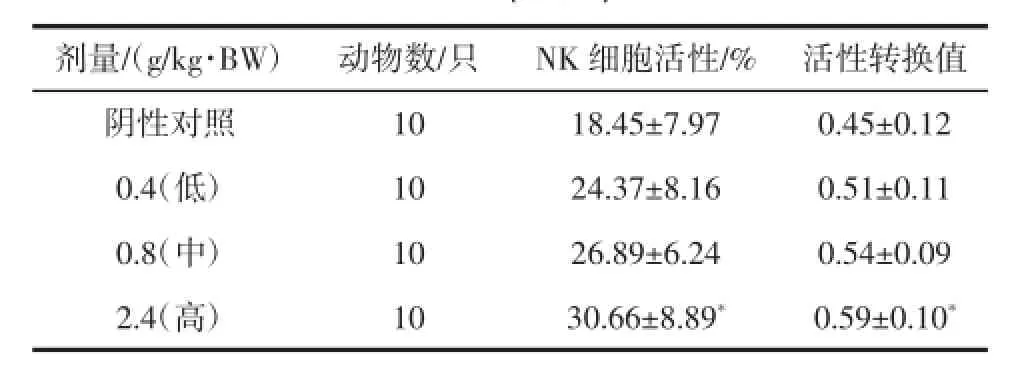
表10 复合低聚肽对小鼠NK细胞活性的影响(±SD)Tab le 10 Effect of com pound oligopeptideon activity of NK cells inm ice(±SD)
注:*表示与阴性对照组比较,具有显著性差异(P<0.05)。
剂量/(g/kg·BW) 动物数/只 NK细胞活性/% 活性转换值阴性对照10 18.45±7.97 0.45±0.12 0.4(低) 10 24.37±8.16 0.51±0.11 0.8(中) 10 26.89±6.24 0.54±0.09 2.4(高) 10 30.66±8.89* 0.59±0.10*
3 讨论
依据《保健食品检验与评价技术规范》(2003版)增强免疫力功能的判定标准,在细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK细胞活性4方面任两个方面结果阳性,可判定该受试样品具有增强免疫力功能。其中细胞免疫功能、体液免疫功能、单核-巨噬细胞功能分别测定的两个试验项目结果若为阳性,或任一个试验的两个剂量组结果为阳性,可判定该项功能测定结果为阳性。NK细胞活性测定试验的一个以上剂量组结果阳性,可判定NK细胞活性阳性[4]。
本研究不同剂量的复合低聚肽样品经口给予小鼠30 d,对小鼠体重增长无不良影响,对小鼠脾脏体重比值和胸腺体重比值无影响,小鼠的体液免疫功能、单核-巨噬细胞吞噬功能、NK细胞活性试验结果均为阳性,根据上述增强免疫力功能判定标准,可判定复合低聚肽具有增强免疫力保健功能。
肽是机体组织细胞的重要组成部分,是一类具有多种特殊生理功能的物质。研究发现,几乎所有细胞都受肽类物质调节,如细胞分化、神经激素递质调节、免疫调节等均与肽密切相关,它具有调节机体生理功能和为机体提供营养的双重功效[5]。由于低聚肽自身独特的分子结构,其在人体内的吸收机制不同于游离氨基酸,与游离氨基酸相比,低聚肽的吸收速度更快,并且其进入血液后可以迅速被机体组织利用[6-7]。本研究所用复合低聚肽样品由大豆低聚肽和胶原低聚肽组成。据文献报道,大豆低聚肽、胶原低聚肽通过促进淋巴细胞转化、提高体液免疫功能、提高巨噬细胞吞噬功能、增加NK细胞活性等方面发挥调节机体免疫的作用[8-10],这与本研究的试验结果基本一致。本研究表明,复合低聚肽在提高小鼠体液免疫功能和单核-巨噬细胞吞噬功能,以及促进NK细胞活性方面具有活性,说明复合低聚肽是多个方面发挥作用而实现增强免疫力的功能。
参考文献:
[1]任玮,金振涛,陈亮,等.食源性低聚肽体外抗氧化活性研究[J].食品与发酵工业,2008,34(12):44-46
[2]李善仁,陈济琛,胡开辉,等.大豆肽的研究进展[J].中国粮油学报, 2009:24(7):142-147
[3]GURZ,LICY,LIUW Y,etal.Angiotensin I-converting enzyme inhibitory activity of low-molecular-weight peptides from Atlantic salmon(Salmosalar L)skin[J].Food Res Int,2011,44(5):1536-1540
[4]中华人民共和国卫生部.保健食品检验与评价技术规范:(2003 版)[M].北京:化学工业出版社,2005:22-34
[5]孔令明,李芳,陶永霞,等.多肽的功能活性与研究进展[J].中国食品添加剂,2009,20(3):71-73
[6]李勇.生物活性肽研究现况和进展[J].食品与发酵工业,2007,33 (1):3-9
[7] 李世成,杨则宜.短肽及其在运动中的应用[J].中国运动医学杂志,2003,2(2):174-176
[8]丁进锋,苏秀榕,李妍妍,等.海蜇胶原蛋白肽的免疫活性的研究[J].水产科学,2011,30(6):359-361
[9]陈宣钦,李茂辉,陈丽梅,等.大豆小分子肽增强小鼠免疫力的实验研究[J].大豆科学,2012,31(3):466-470
[10]李红胜,高存川,谢为天,等.大豆肽对小鼠免疫功能的影响[J].广东农业科学,2012,45(5):109-111
DO I:10.3969/j.issn.1005-6521.2015.19.051
收稿日期:2015-08-19
作者简介:尹利端(1979—),男(汉),工程师,硕士,研究方向:功能食品的研究、开发与产业化。
Study on Immunity Enhancing Function of Com pound Oligopeptide
YIN Li-duan1,HUANG Jing2,ZHANGHou-sen3,DONGCong-chao1
(1.YantaiNew EraHealth Industry Co.,LTD,Yantai264006,Shandong,China;2.Research Center for Standard and TechnicalRegulations,AQSIQ,Beijing 100028,China;3.Physicsand Chemistry Testing Center of Jiangsu Province,Nanjing 210042,Jiangsu,China)
Abstract:The immunity enhancing function of compound oligopeptide was studied.Compound oligopeptide were consecutively orally given tomice with the doses of 0.4,0.8,2.4 g/kg·BW (comparatively as 5,10,30 times of recommended human daily dosage)for 30 days.The cellular immunity,humoral immunity,mononuclearmacrophage and NK cell activity were respectively determined.The results showed that humoral immune function,mononuclear macrophage function and NK cell activity were all positive,while cellular immunitywasnegative.The final results showed thatcompound oligopeptide could enhance immunity function.
Keywords:compound oligopeptide;enhancing immunity function;functional foods
