可逆性胼胝体压部病灶综合征二例报道并文献复习
2015-07-25李凤鹏周中和陈会生
夏 程,李凤鹏,周中和,陈会生
可逆性胼胝体压部病灶综合征(reversible splenial lesion syndrome,RESLES)是一种临床、影像综合征,与癫痫发作、快速停用抗癫痫药物、感染和严重的代谢紊乱 (如低血糖、低钠、高钠血症)等相关。绝大多数患者临床预后良好。本文报道2例分别与特发性低颅压及流行性出血热伴发的RESLES患者,同时复习相关文献。
1 病例简介
患者1,男,58岁,因“反复头痛1月余,加重4 d”于2013-07-16入院。2011年患脑梗死,未遗留后遗症;既往冠心病病史10余年,2013年6月发现高血压,未系统治疗,否认糖尿病病史。于2013-06-16 9:00一般活动中出现头部持续性胀痛,伴有恶心,未吐,不伴发热,卧床后症状减轻,坐、立位时症状明显,否认创伤、上呼吸道感染病史,否认癫痫病史,否认抗癫痫药物服用史及近期高海拔地区滞留史,当地医院给予止痛对症治疗,症状减轻。2013-07-13 10:00左右于一般活动中再次出现上述症状。2013-07-16来院就诊,查颅脑CT示:脑组织饱满,脑池、脑室缩小,左额部硬膜下积液。食欲差,睡眠可,二便无异常。入院体检:内科及神经系统未见明显阳性体征。脑电图、经颅多普勒、双侧颈动脉超声、胸部X线片、心电图、心脏超声均未见明显异常。血常规、尿常规、便常规、凝血系列、空腹及餐后血糖、肝肾功能、电解质、风湿免疫血管炎筛查未见异常。2013-07-19查颅脑MRI平扫+增强扫描示:双侧大脑半球硬膜下及小脑幕下T1低信号,T2及液体衰减反转恢复序列 (FLAIR)高信号,考虑积液,以额、颞叶为著;增强扫描示:硬脑膜及小脑幕明显强化;胼胝体压部局限性卵圆形病灶 (1.0 cm×1.5 cm),T1低信号,T2及FLAIR高信号;增强扫描无明显强化。2013-07-24颅脑弥散加权成像 (DWI)示:胼胝体压部局限性卵圆形病灶高信号,表观扩散系数(ADC)稍低 (见图1)。诊断:特发性低颅压。入院后给予0.9%氯化钠溶液3 500 ml/d静脉滴注,补液治疗15 d,症状消失出院。出院后随访,上述症状未再发。2013-10-16复查颅脑MRI示:硬膜下积液及胼胝体压部局限性卵圆形病灶消失 (见图1)。
患者2,男,25岁,战士,因“咳嗽半月余,发热3 d”于2013-11-17入院。既往体健。于半月前野外军事演习时出现咳嗽、咯白色泡沫痰,不伴发热,自行口服感冒药物治疗 (具体不详),症状迁延不愈,3 d前上述症状加重,咯黄色黏痰,伴有体温增高,最高达41℃,头痛、烦躁,伴阵发性视物变形,于当地医院就诊,给予头孢类抗生素治疗 (具体不详),症状未见好转,以“发热待查”入院,发病以来精神、食欲较差,二便正常。入院体检:体温40.7℃,脉搏128次/min,呼吸频率20次/min,血压110/70 mm Hg(1 mm Hg=0.133 kPa),眼部、面部及前胸潮红,听诊双肺呼吸音清,未闻及干湿啰音,心律齐,双下肢无水肿,神经系统查体未见阳性体征。血常规:白细胞计数5.7×109/L、中性粒细胞分数 0.88、红细胞计数 4.36 ×1012/L、血红蛋白 143 g/L、血小板计数 115×109/L、红细胞沉降率4 mm/1 h;溶血全项正常;凝血指标:D-二聚体2.2 mg/L、活化部分凝血活酶时间 47.5 s、凝血酶原时间15.9 s;C反应蛋白59.0 mg/L;血生化分析:直接胆红素 7.6 μmol/L、丙氨酸氨基转移酶206 U/L、天冬氨酸氨基转移酶146 U/L、血清氯86.9 mmol/L、血清钠 125.7 mmol/L、超敏 C反应蛋白41.97 mg/L、磷酸肌酸激酶601 U/L、乳酸脱氢酶543 U/L,余项正常;降钙素原1.14 μg/L;血清呼吸道合胞病毒、腺病毒、军团菌、柯萨奇病毒、肺炎支原体、肺炎衣原体、流感病毒A、流感病毒B、副流感病毒、埃克病毒、结核杆菌抗体IgM(-);尿常规:白细胞3.69个/高倍镜视野、尿蛋白 (++)、微量清蛋白 (+);腰椎穿刺脑脊液压力300 mm H2O(1 mm H2O=0.009 8 kPa),常规、生化正常。入院后复查血常规,血小板计数进行性下降,最低达36×109/L,外周血异常;红细胞形态检查:破碎红细胞1%;血生化进行性恶化:直接胆红素26.4 μmol/L、总胆红素40.0 μmol/L、丙氨酸氨基转移酶912 U/L、天冬氨酸氨基转移酶 1 217 U/L、磷酸肌酸激酶721 U/L、乳酸脱氢酶 2 527 U/L;凝血指标进行性恶化:D-二聚体8.6 mg/L、活化部分凝血活酶时间77.6 s、凝血酶原时间18.5 s;2次血清流行性出血热病毒抗体IgM(+)。胸部CT未见异常。2013-11-21颅脑MRI+DWI+磁共振血管成像(MRV)+磁共振血管造影(MRA)示:胼胝体压部局限性卵圆形病灶T1低信号,T2及FLAIR高信号。DWI示:胼胝体压部局限性卵圆形病灶高信号,ADC稍低,MRV及MRA未见明显异常 (见图2)。诊断:(1)流行性出血热;(2)低钠血症。给予口服浓氯化钠、更昔洛韦抗病毒、谷胱甘肽保肝、输注新鲜冰冻血浆及营养支持等治疗1个月,病情痊愈出院。2013-12-03复查颅脑MRI+DWI示:胼胝体压部局限性卵圆形病灶消失 (见图2)。
2 讨论
RESLES典型表现为MRI上直径1~2 cm的卵圆形病灶,位于胼胝体压部的中央,胼胝体其他部分不受累及。病灶呈FLAIR和T2高信号,T1信号轻度降低或没有信号改变,DWI呈高信号,ADC减低,增强扫描没有强化。影像学异常多持续一定时间后自行消失。病灶的此种影像学特点提示其本质为细胞毒性水肿。
2.1 病因学及临床特点 可逆性胼胝体压部病灶可伴发于多种疾病。多数情况下胼胝体压部病灶不是孤立出现的,而是与相关疾病其他特异的影像学表现伴发。另外,在一些情况下,如低血糖或其他代谢性疾病,可逆性病灶也可在其他脑区出现。文献报道,与胼胝体压部局限性可逆性病灶相关的症状体征包括:癫痫发作、意识模糊、共济失调、昏睡、昏迷、头痛和谵妄等[1]。然而,很难判断这些症状与胼胝体压部局限性可逆性病灶之间的因果关系。
2.1.1 痫性发作和抗癫痫药物 迄今有50余例资料完整的与抗癫痫治疗有关的RESLES病例报道[1]。见于传统抗癫痫药物和新型抗癫痫药物,尤其在突然停药时。常见的有卡马西平、苯妥英和拉莫三嗪。RESLES也发生在服用抗癫痫药物的非癫痫患者,如神经痛患者。RESLES与快速停用抗癫痫药物本身相关,而与痫性发作频率和发作类型无关。胼胝体压部可逆性病灶多在抗癫痫药物停用后24 h~1周被观察到。
2.1.2 感染 迄今有40余例符合感染的相关RESLES患者被报道[1]。绝大多数为儿童或青年人,患者多来自日本,没有明显的性别倾向。临床表现无特异性,与脑病或脑炎特征一致。绝大多数患者没有痫性发作或接受抗癫痫药物治疗史。在确定病原体的患者中,病毒尤为突出,特别是流感病毒。其他致病因子包括轮状病毒、麻疹、单纯疱疹病毒、EB病毒、水痘-带状疱疹病毒、腮腺炎病毒、腺病毒、汉坦病毒、肠炎沙门杆菌、大肠埃希菌和军团菌[1]。近半数的患者表现为因系统性感染所致的脑病,而无中枢神经系统感染证据,脑脊液化验多正常。绝大多数患者颅脑MRI改变在病后1 d出现,通常1~2周内消失。绝大多数患者在MRI正常后数天或数周内临床痊愈。
2.1.3 代谢性疾病 该患者多数为因胰岛素或口服降糖药治疗导致严重的低血糖。有2例严重的高钠血症伴RESLES患者被报道,另外发现,伴有胼胝体压部可逆性病灶的临床症状轻微的脑炎/脑病患者常合并低钠血症[1]。胼胝体压部病灶发生早,在临床出现症状时或数小时后出现,绝大多数患者1周内完全消失。MRI病灶消失通常滞后于临床恢复,后者通常发生在12 h内。临床特征绝大多数包括异常的神志和局灶的神经功能缺损,与低血糖明显相关,而与胼胝体压部病灶关系不确切[1]。
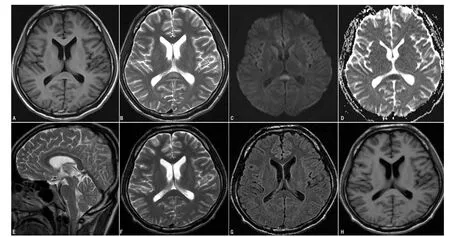
图2 患者2颅脑MRI+DWI扫描Figure 2 Cranial magnetic resonance imaging and diffusion-weighted imaging findings of patient 2
2.1.4 其他药物及毒物 数例 RESLES患者被报道在使用其他制剂过程中,包括甲硝唑[2]、溴甲烷[3]、氟尿嘧啶[4]、顺铂、卡铂[5]、含有拟交感神经成分的减肥药物[6]、奥氮平、西太普兰[7]等。病灶发生非常早 (部分患者在数小时内),数天后或数周后改善。
2.1.5 其他 其他疾病伴 RESLES患者偶有报道,包括神经性厌食[8]、营养不良[9]、马比病[10]、韦尼克脑病[11]、维生素 B12缺乏[12]、腓骨肌萎缩症[13]、高原脑水肿[14]、系统性红斑狼疮[15]和子痫[16]等。MRI随访显示,病灶多在首次MRI检查后1~4个月显著改善或消失。需要指出的是,高原脑水肿患者胼胝体压部病灶呈DWI高信号,ADC值增高,提示血管源性水肿[14]。
2.2 发病机制 RESLES的机制目前尚不清楚。总结文献报道,有如下学说:(1)髓鞘兴奋毒性脑水肿[17]。兴奋毒性脑水肿是由于细胞间隙谷氨酸水平增高所致的一种细胞毒性脑水肿。细胞间隙谷氨酸水平增高可由谷氨酸释放增多或再摄取减少导致。谷氨酸与兴奋性氨基酸受体结合将诱导Na+内流而致细胞毒性水肿。兴奋毒性脑水肿既可累及神经元也可累及胶质细胞,后者则导致髓鞘水肿。DWI上病灶呈高信号,ADC降低,仅反映了细胞毒性脑水肿,而不能区分水肿的细胞类型。RESLES被认为是胼胝体压部髓鞘内的兴奋毒性水肿,而并不意味神经元损害。胶质细胞和髓鞘内水肿对神经元起到一定的保护作用,能延缓轴索细胞毒性水肿的发展。髓鞘内水肿通常短暂,随着致病因素的去除,DWI及ADC恢复正常。低血糖脑病时,葡萄糖耗竭诱发能量代谢减低和离子泵的衰竭,随后发生细胞毒性脑水肿。然而,低血糖也导致细胞外间隙谷氨酸的释放增加。因此,能量衰竭和兴奋毒性脑水肿均存在。低血糖初期谷氨酸再摄取系统未减低。神经元和胶质细胞谷氨酸再摄取系统功能的存在可防止低血糖性水肿发展成不可逆性损伤。然而,后期如果葡萄糖耗竭持续,能量衰竭占优势,谷氨酸再摄取系统功能就会减低,细胞毒性水肿就会发生。这就解释了为什么立即治疗后低血糖诱发的DWI弥散受限可以恢复正常,如果治疗延误,DWI弥散受限则将不可逆。 (2)水电解质失衡学说[18-19]。部分因快速停用抗癫痫药物而出现RESLES的癫痫患者撤药过程中有短暂的血浆抗利尿激素水平升高。抗利尿激素可以调节局部脑血流,影响脑组织的水含量,参与脑水肿的形成。推测在血清抗癫痫药物浓度突然变化时,可能会出现短暂的体液失衡,引起不恰当的抗利尿激素综合征,参与了脑内易感部位的水肿形成。另外发现,伴有轻微RESLES临床症状的脑炎/脑病患者常合并低钠血症[1]。低钠可引起脑渗透压的改变导致脑水肿。但低钠或高钠导致的脑水肿仅局限于胼胝体压部的原因尚不清楚。(3)一过性炎性反应[17]。炎性因子和炎性细胞的出现可致细胞毒性水肿。多发性硬化患者也可出现胼胝体的可逆性病灶,可能是因为炎性细胞的浸润及细胞毒性水肿导致病灶的出现,当病因解除后病灶即消失。 (4)遗传因素。最近报道了一些家族性伴有RESLES的临床症状轻微的脑炎/脑病患者,提示遗传因素可能参与部分RESLES的发病机制[20]。
本组患者1诊断为特发性低颅压,临床表现仅为体位性头痛,实验室检查血钠正常;患者2诊断为流行性出血热,临床表现为发热、纳差、眼部、面部及前胸潮红、伴头痛、烦躁及阵发性视物变形,不伴尿量的改变,实验室检查血钠低于参考范围。2例患者胼胝体压部病灶在MRI上的表现与上述一致,患者1影像学亦伴有硬膜下积液及硬脑膜强化等低颅压的MRI表现。患者1病灶在首次MRI检查后3个月随访复查消失,患者2病灶在首次MRI检查后12 d复查消失。2例患者亦分别经支持、对症及针对性治疗15 d及1个月临床痊愈。RESLES与特发性低颅压伴发的患者目前国内外尚无报道,推测RESLES与短暂的代偿性抗利尿激素分泌增加有关。患者2诊断流行性出血热伴有低钠血症,既往有文献报道,推测病灶出现与一过性炎性反应及水电解质失衡有关[1]。
从目前的文献资料看,RESLES是一种临床、影像综合征,与多种病因相关,绝大多数患者预后良好,病程具有自限性。目前国外对这种现象报道较多,而在国内还没有引起足够的认识,因此临床医生应加强对此病的认识,避免造成误诊及过度医疗。
[1] Garcia-Monco JC,Cortina IE,Ferreira E,et al.Reversiblespleniallesion syndrome(RESLES):what's in a name? [J].J Neuroimaging,2011,21(2):e1-14.
[2] Kim E,Na DG,Kim EY,et al.MR imaging of metronidazole - induced encephalopathy:lesion distribution and diffusion-weighted imaging findings[J].AJNR Am J Neuroradiol,2007,28(9):1652-1658.
[3] Kang K,Song YM,Jo KD,et al.Diffuse lesion in the splenium of the corpus callosum in patients with methyl bromide poisoning[J].J Neurol Neurosurg Psychiatry,2006,77(5):703-704.
[4] ThaKK, TeraeS, SugiuraM,et al.Diffusion-weighted magnetic resonance imaging in early stage of 5-fluorouracilinduced leukoencephalopathy[J].Acta NeurolScand, 2002, 106(6):379-386.
[5] Maeda M,Tsukahara H,Terada H,et al.Reversiblespleniallesion with restricted diffusion in a wide spectrum of diseases and conditions [J].J Neuroradiol,2006,33(4):229-236.
[6] Winslow H,MickeyB,Frohman EM.Sympathomimetic-induced kaleidoscopic visual illusion associated with a reversible splenium lesion [J]. Arch Neurol,2006,63(1):135-137.
[7] Horak EL,Jenkins AJ.Postmortem tissue distribution of olanzapine and citalopram in a drug intoxication [J]. J Forensic Sci,2005,50(3):679-681.
[8] Nishimura K,Takei N,Suzuki K,et al.A transient lesion in splenium of the corpus callosum in a patient with childhood-onset anorexia nervosa[J].Int J Eat Disord,2006,39(6):527-529.
[9] KosugiT, Isoda H, ImaiM, et al.Reversible focal splenial lesion of the corpus callosum on MR images in a patient with malnutrition [J].Magn Reson Med Sci,2004,3(4):211-214.
[10] Aggunlu L,Oner Y,Kocer B,et al.The value of diffusion-weighted imaging in the diagnosis of Marchiafava-Bignami disease:apropos of a case [J].J Neuroimaging,2008,18(2):188-190.
[11] Loh Y,Watson WD,Verma A,et al.Restricted diffusion of the splenium in acute Wernicke's encephalopathy[J].J Neuroimaging, 2003, 15(4):373-375.
[12] Kori S.Hyperintense splenium in vitamin B12deficiency[J].Neurol India,2005,53(3):377-378.
[13] Okada K,Fujiwara H,Tsuji S.X-linked Charcot- Marie- Tooth disease with transient splenium lesion on MRI[J].Intern Med,2006,45(1):33-34.
[14] Wong SH,Turner N,Birchall D,et al.Reversible abnormalities of DWI in highaltitude cerebral edema [J].Neurology,2004,62(2):335-336.
[15] Appenzeller S,Faria A,Marini R,et al.Focaltransient lesions of the corpus callosum in systemic lupus erythematosus[J].Clin Rheumatol,2006,25(4):568-571.
[16] Chen Z,Xu M,Shang D,et al.A case of reversible splenial lesions in late postpartum preeclampsia[J].Intern Med,2012,51(7):787-790.
[17]Gallucci M,Limbucci N,Paonessa A,et al.Reversible focal splenial lesions [J].Neuroradiology, 2007, 49 (7):541-544.
[18] Polster T,Hoppe M,Ebner A.Transient lesion in the splenium ofthe corpus callosum:three further cases in epileptic patients and a pathophysiological hypothesis[J]. J NeurolNeurosurg Psychiatry,2001,70(4):459-463.
[19] Shimizu H,Kataoka H,Yagura H,et al.Extensive neuroimaging of a transient lesion in the splenium of the corpus callosum[J].Eur J Neurol,2007,14(1):e37-39.
[20] Imamura T,Takanashi J,Yasugi J,et al.Sisters with clinically mild encephalopathy with a reversible splenial lesion(MERS)-like features:Familial MERS? [J].J NeurolSci, 2010, 290(1/2):153-156.
