双抗夹心酶联免疫(ELISA)方法测定卵类黏蛋白
2015-07-23李晶王薇张燕陆旸王硕天津出入境检验检疫局工业产品安全技术中心天津300308食品营养与安全教育部重点实验室天津科技大学食品工程与生物技术学院天津300457
李晶,王薇,张燕,陆旸,王硕,*(.天津出入境检验检疫局工业产品安全技术中心,天津300308;.食品营养与安全教育部重点实验室天津科技大学食品工程与生物技术学院,天津300457)
双抗夹心酶联免疫(ELISA)方法测定卵类黏蛋白
李晶1,王薇2,张燕2,陆旸2,王硕2,*
(1.天津出入境检验检疫局工业产品安全技术中心,天津300308;2.食品营养与安全教育部重点实验室天津科技大学食品工程与生物技术学院,天津300457)
摘要:卵类黏蛋白是鸡蛋中的主要过敏原,因此建立相应的检测方法对保障消费者健康非常重要。为此本试验分别制备了卵类黏蛋白特异性兔多克隆抗体和鼠多克隆抗体,对不同检测条件进行优化,最终建立了一种用于定量分析卵类黏蛋白的双抗夹心ELISA方法,并对检测方法的精密度进行考察。结果表明,通过对封闭液、捕获抗体包被量和检测pH的优化,该方法的最低检出限达到(0.274±1.27)ng/mL,且具有良好的特异性以及检测精密度。因此,所建立的方法可用于食品中卵类黏蛋白的定量检测。
关键词:过敏原;卵类黏蛋白;双抗夹心ELISA方法
鸡蛋是人们日常生活中最普遍易得的蛋白质来源之一。由于含有丰富的蛋白质和卵磷脂、固醇类、蛋黄素以及多种矿物质和维生素,鸡蛋已经成为婴幼儿主要的膳食蛋白来源,被广泛用于婴幼儿饼干、米粉和面条中。卵类黏蛋白是鸡蛋中的主要过敏原。据统计,在全世界上,大约有0.5%~2.5%的儿童对鸡蛋过敏,其已经成为仅次于牛奶的引发婴幼儿食物过敏的食物[1-2]。卵类黏蛋白是蛋清中含量最高且致敏性最强的一种蛋白[3]。由于含有糖基组分,其稳定性较高,在热处理和胰蛋白酶降解下均相当稳定[4]。因此,建立对其有效地检测方法对保障消费者健康至关重要。
目前检测致敏蛋白的方法主要包括免疫学检测方法和PCR方法[5-9]。但是PCR方法往往存在操作繁杂和难以定量等问题。相比之下,基于免疫学方法的酶联免疫检测技术具有高效、灵敏和低成本等优点。因此,本文利用此项技术建立并优化了用于食品中卵类黏蛋白含量的双抗夹心ELISA检测方法,该方法具有较低的最低检出限和较好的重现性,可用于相关部门的检测。
1 材料与方法
1.1试剂和材料
卵类黏蛋白、弗氏完全佐剂、牛血清白蛋白(BSA)、弗氏不完全佐剂、羊抗兔IgG辣根过氧化物酶标物、三羟甲基氨基甲烷(Tris)、甘氨酸(含量≥99.9%)、羊抗鼠IgG辣根过氧化物酶标物、甘氨酸、BCA蛋白定量试剂盒、十二烷基磺酸钠(SDS)、过氧化氢脲(CH6N2O3)、3,3',5,5'-四甲基联苯胺(TMB)、脱脂乳粉、鱼皮胶:Sigma公司;Tween 20:上海浦东化工试剂厂;丙三醇(分析纯):天津市北方天医化学试剂厂;变色硅胶:天津市化学试剂一厂;β-环糊精、二甲基亚砜(DMSO):德国 Merck公司;Protein G-Sepharose、Protein A-Sepharose 4B:美国Amersham公司;96孔酶标板:美国Thermo公司。
1.2仪器设备
BioLosic LP蛋白纯化仪:美国BIO-RAD公司;Mlultiskan Spectrum酶标仪:美国Thermo公司。
1.3方法
1.3.1卵类黏蛋白兔多克隆抗体的制备
以卵类黏蛋白为免疫原对新西兰大耳白兔进行免疫,制备卵类黏蛋白特异性抗体。两周免疫1次,共免疫5次,并采血清。采用间接ELISA法测定血清的效价。利用Protein A-Sepharose4B免疫亲和层析柱对抗体进行纯化。
1.3.2卵类黏蛋白鼠多克隆抗体的制备
试验用BALB/c小鼠进行免疫,免疫剂量为100μg/只。第4次免疫后取血并纯化后置于-20℃冰箱保存备用。
1.3.3卵类黏蛋白双抗夹心ELISA方法的建立
将卵类黏蛋白兔多抗包被于96孔聚苯乙烯酶标板中(100μL/孔),然后4℃下孵育12 h~16 h。PBST洗液洗板3次后,在酶标板中加入封闭液(200μL/孔),于37℃封闭1 h。之后用PBST洗液洗板3次,每孔加入卵类黏蛋白标准溶液,于37℃下孵育1 h,取出后用PBST洗液洗板3次。随后,将卵类黏蛋白鼠多抗加入到酶标板中(100μL/孔),于37℃下孵育1 h,之后用PBST洗液洗板4次,然后将HRP标记的鼠二抗加入酶标板中(100μL/孔),37℃下孵育30min。PBST洗液洗板5次后,向每孔中加入底物A和B的混合液(100μL/孔),于37℃下显色约15min~20min。然后加入终止液(50μL/孔)并利用酶标仪采用双波长方式(450 nm~650 nm)读取吸光度值(OD值)。
1.3.4双抗夹心ELISA法选择性的测定
双抗夹心ELISA法选择性的测定采用交叉反应程度进行测定。交叉反应程度采用交叉反应物吸光度值与阴性对照样吸光度值的比值(P/N)进行表示。
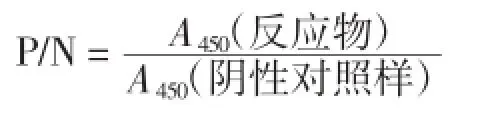
2 结果与讨论
2.1卵类黏蛋白双抗夹心ELISA方法的建立
2.1.1封闭液的优化
试验分别采用0.5%鱼皮胶、0.5%的脱脂乳粉、0.5%酪蛋白、1%明胶、1%的脱脂乳粉、1%BSA溶液、5%的脱脂乳粉作为封闭液,并对其空白值进行对比。不同封闭液的优化结果见表1。
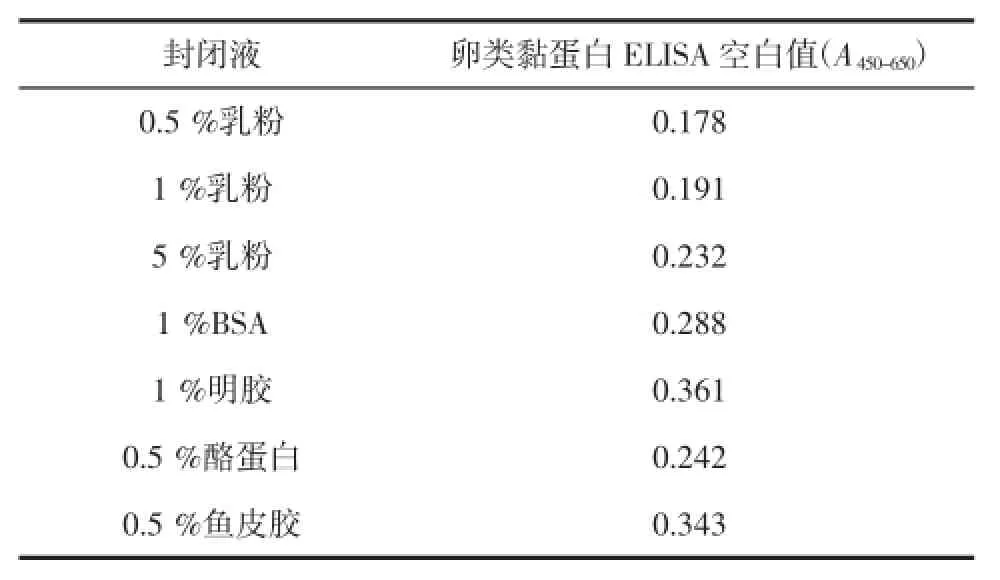
表1 不同封闭液下空白的平均吸光度值Table1 Absorption valuesat the different blocking buffer
如表1所示,采用0.5%乳粉作为封闭液时的空白值最低,表明其非特异性吸附最小,因此本试验选择0.5%乳粉作为封闭液。
2.1.2捕获抗体包被量的优化
选择0.075、0.1、0.15、0.2μg/孔作为兔多克隆抗体包被量,绘制检测曲线图,选择曲线线性部分作图,不同捕获抗体包被量的优化结果见图1。
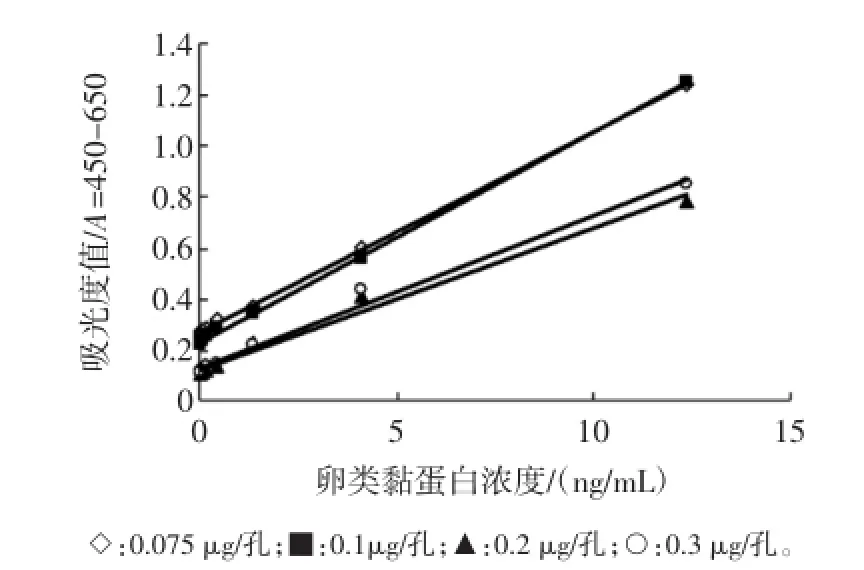
图1 不同捕获抗体包被量对双抗体夹心酶联免疫检测的影响Fig.1 Effectof captureantibody coating amounton OVM sandw ich ELISA
如图1所示,当包被量为0.075μg/孔时,空白值最低,且最大吸光度值接在1.2左右。因此选择兔抗卵类黏蛋白0.075μg/孔作为捕获抗体的最终包被量。
2.1.3不同pH的优化
本试验选取pH为5.7、7.4、8.5的磷酸缓冲液进行试验。不同pH对卵类黏蛋白空白值的影响见表2。
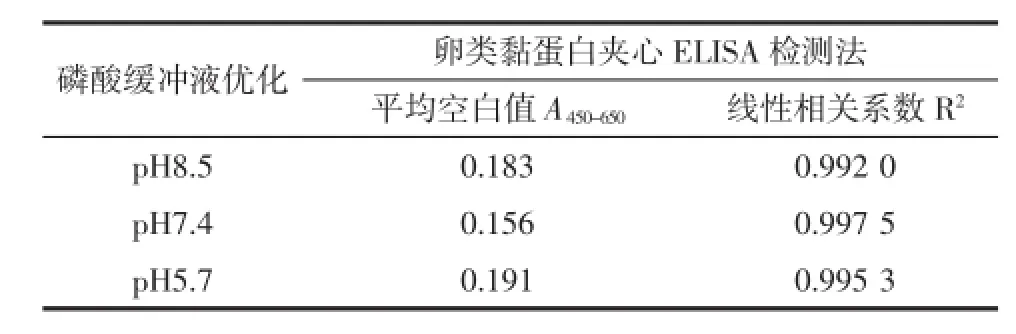
表2 不同pH对双抗体夹心酶联免疫检测的影响Table2 Effect of pH of PBSon sandw ich ELISA
如表2所示,当pH为7.4时,空白值最低,因此选择pH 7.4,作为卵类黏蛋白双抗体夹心ELISA法检测的样品稀释液。可见过酸或者过碱都会对待测蛋白的活性产生影响,这一结果与卵类黏蛋白的结构稳定性有关[10-11]。
2.1.4卵类黏蛋白双抗夹心ELISA方法标准曲线的绘制
在上述优化条件下,以兔多克隆抗体作为捕捉抗体(0.075μg/孔),鼠单克隆抗体作为检测抗体,加入卵转铁蛋白标准品,绘制黏蛋白间接竞争ELISA标准曲线(见图2)。
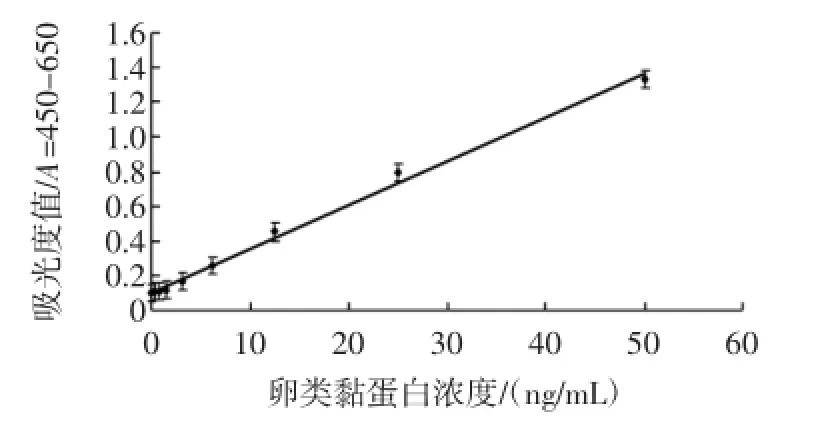
图2 卵类黏蛋白双抗体夹心酶联免疫检测的标准曲线(n=8)Fig.2 Standard curve ofOVM allergenson sandw ich ELISA (n=8)
如图所示,所建立的双抗夹心ELISA方法最低检出限(LOD)值为(0.274±1.27)ng/mL(n=8)。
2.1.5卵类黏蛋白双抗夹心ELISA方法的特异性
试验选择了11种常见食物过敏原(卵转铁蛋白、白蛋白、溶菌酶、α-乳白蛋白、牛奶总蛋白、β-乳球蛋白、酪蛋白、花生总蛋白、大豆、杏仁和绿豆)进行检测方法特异性测定。将这11种过敏原蛋白分别稀释至10、1、0.1μg/mL,并以PBS作为阴性对照,计算交叉反应物吸光度值与阴性对照样吸光度值的比值(P/N)。结果见表3,与11种食物的P/N值均小于2,表明交叉反应非常小,此本方法对卵类黏蛋白具有良好的的特异性。卵类黏蛋白的特异性试验结果见表3。
2.2卵类黏蛋白双抗夹心ELISA方法的精密度
本试验选择8个不同浓度的卵类黏蛋白溶液进行分析,分别考查板内变异和板间变异,对建立的双抗体夹心酶联免疫检测方法进行精密度测试。
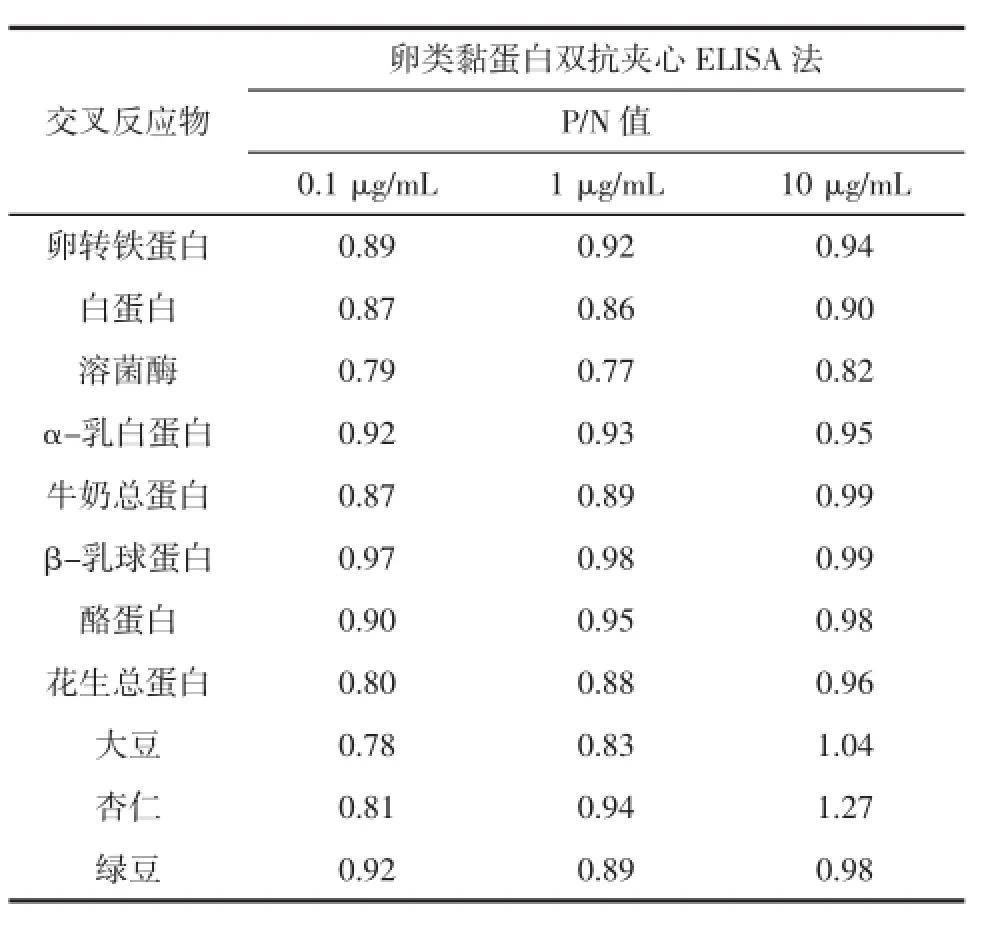
表3 双抗体夹心ELISA检测方法对卵类黏蛋白的特异性Table3 Cross-reactivity ofsandw ich ELISA for OVM
2.2.1卵类黏蛋白双抗夹心板内变异
选择8个不同浓度的卵类黏蛋白溶液进行分析,根据每一个浓度对应得到的吸光度值计算平均值以及标准偏差,得到变异系数。不同浓度的卵类黏蛋白溶液的板内变异结果见表4。
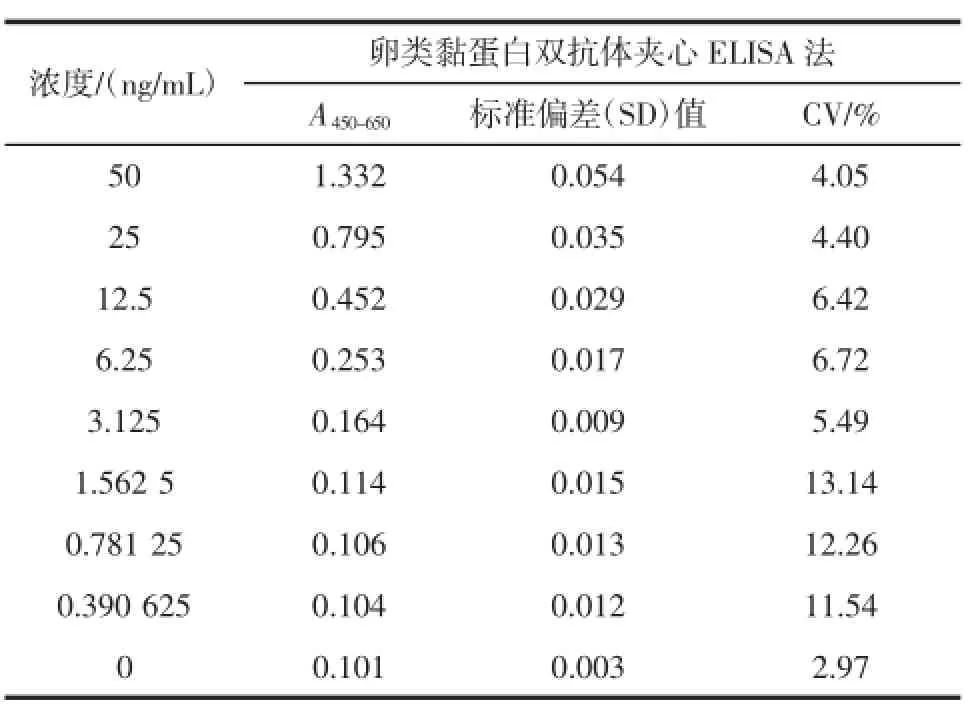
表4 双抗体夹心酶联免疫检测法板内变异(n=4)Table4 Variance in-p late of sandw ich ELISA for OVM(n=4)
由表4可知吸光度值变异系数大部分在2.97%~13.14%之间,表明所建立的方法具有良好的板内重复性。
2.2.2卵类黏蛋白双抗夹心板间变异
在相同条件下,取空白和8个不同浓度的卵类黏蛋白溶液,进行分析,综合5 d测得的吸光度值A450-650进行分析。不同浓度的卵类黏蛋白溶液的板间变异结果见表5。
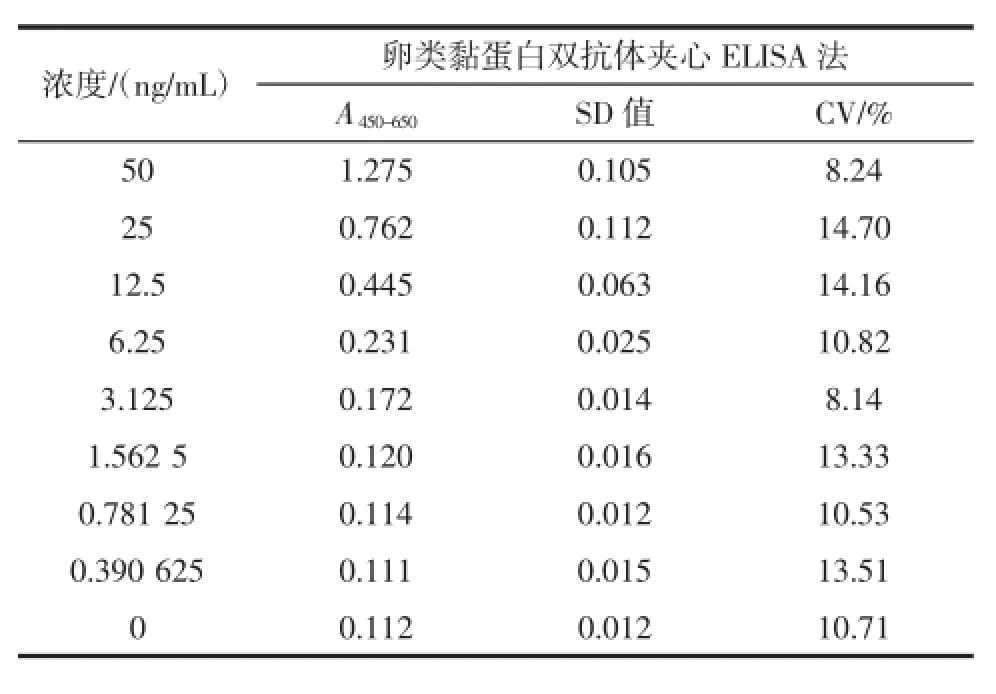
表5 卵类黏蛋白双抗体夹心酶联免疫检测法板间变异(n=5)Table5 Variance between-plateofsandw ich ELISA for OVM (n=5)
由表5可知吸光度值变异系数均在8.24%~14.70%之间,因此本方法具有良好的板间重复性。
3 结论
本试验建立并优化了一种用于检测卵类黏蛋白的双抗夹心ELISA方法,选用0.5%乳粉作为封闭液,优化后的捕获抗体包被量为0.075μg/孔,检测pH为7.4。该方法的最低检出限可达到(0.274±1.27)ng/mL,且具有良好的板间和板内重现性,因此所建立的方法可用于对卵类黏蛋白的定量检测。
参考文献:
[1]罗嘉莹,黄惠敏,郑佩燕,等.广东省学龄前儿童食物过敏情况及相关危险因素分析[J].重庆医科大学学报,2013,38(8):843-847
[2]胡燕.重视开展儿童食物过敏研究[J].中国儿童保健杂志,2011, 19(6):489-491
[3]Lemon-Mule H,Sampson H A.Immunologic changes in children with egg allergy ingesting extensively heated egg[J].Journal of Allergyand Clinical Immunology,2008,122(5):977-983
[4]Walsh B J,Hill D J,Macoun P.et al.Detection of four distinct groupsofhen eggallergensbingding IgE in the seraof childrenwith eggallergy[J].Allergol Immunopathol(Madr),2005,33(4):183-191
[5]Monaci L,ViscontiIA.Immunochemical and DNA-based methods in food allergen analysis and quality assurance perspectives[J]. Trends in Food Science and Technology,2010,21(6):1-12
[6]余清,黄红霞,刘绍文.食品过敏原及其检测分析技术[J].质量技术监督研究,2009(2):27-31
[7]HeiWenjing,Li Zhen,Ma X.Determination of beta-conglycinin in soybean and soybean productsusinga sandwich enzyme-linked immunosorbentassay[J].Analytica Chimica Acta.2012(734):62-68
[8]吴序栎,吉坤美,李佳娜,等.双抗体夹心ELISA法测定食物中虾过敏原成分[J].食品科技,2009,34(8):240-243
[9]詹政科,刘萍,吉坤美,等.双抗体夹心ELISA法测定食物中牛奶过敏原蛋白成分[J].中国乳品工业,2009,34(8):44-47
[10]Wolf Walter J,Sathe Shridhar K.Ultracentrifugal and polyacrylamide gel Electrophoretic studies of extractability and stability of almondmealproteins[J].Journal of Agricultural and Food Chemistry,1998(78):511-521
[11]NowakWegrzyn-A,Bloom KA,Sicherer SH,etal.Tolerance to extensively heatedmilk in children with cow’smilk allergy[J].Journal of Allergyand Clinical Immunology,2008,122(2):342-347
DOI:10.3969/j.issn.1005-6521.2015.22.032
收稿日期:2015-08-27
基金项目:质检公益性行业科研专项(201310067)
作者简介:李晶(1976—),女(满),研究员,博士,生物技术与食品工程专业。
*通信作者
The Development of Sandw ich Enzyme-linked Immunosorbent Assay(ELISA)for Detecting Ovomucoid
LIJing1,WANGWei2,ZHANG Yan2,LU Yang2,WANGShuo2,*
(1.Tianjin Entry-exit Inspection and Quarantine Bureau of Industrial ProductSafety TechnicalCenter,Tianjin 300308,China;2.Key Laboratory of Food Nutrition and Safety Ministryof Education ofChina,The Schoolof Food Engineering and Biotechnology of Tianjin University of Scienceand Technology,Tianjin 300457,China)
Abstract:Ovomucoid isamajorallergen in eggs,so it is important to develop a detectionmethod for it.In this study,anti-ovomucoid polyclonal antibodies and anti-ovomucoid monoclonal antibodieswere generated from rabbits and mice respectively.A sandwich ELISA for ovomucoid was developed and validated.Under the optimized conditions,the limit of detection was(0.274±1.27)ng/mL,with good selectivity and accuracy.The developed assaywassuitable forquantity ovomucoid in food samples.
Keywords:allergen;ovomucoid;sandwich ELISA
