无机化工流程试题考点及题型探析
2015-07-21赵树良
赵树良
摘要:无机化工流程试题在高考中既容易得分,但有不容易的得到满分。只要把握此类问题的考试意图、掌握答题方法得满分的可能性也很大。
关键词:流程、分离、除杂、回收、循环
中图分类号: G634 文献标识码:A 文章编号:1674-098X(2015)06(b)-0000-00
近几年无机化工流程试题的考查成了高考的新宠,几乎每年必考。如何正确解答此类试题,探析如下:
1.无机化工流程试题考查知识点归纳总结
无机化工流程试题一般从三个方面入手进行考查:第一原料处理,第二分离提纯,第三获得产品。其中核心考点是物质的分离操作、除杂试剂的选择、生产条件的控制。主要考点总结如下:
1)加快反应速率:常用方法是粉碎原料、升高温度、搅拌、加入适当的催化剂等五种方法。
2)溶解:⑴水溶⑵酸溶⑶碱溶⑷萃取或反萃取
3)灼烧、焙烧、煅烧:⑴高温使原料之间发生化学转化直接转变为产品,⑵使杂质分解、氧化为易除去的杂质。
4)控制适宜反应条件:化工生产需要考虑化学反应速率、产率、生产设备、经济效率等问题,因此需要选择适宜的反应条件(如浓度、温度、压强、催化剂等),所以生产中必须控制反应条件,其中温度和酸度的控制是条件控制的两大主旋律。如控制温度可以水浴加热、油浴加热等,防止反应物或生成物可能易分解、易挥发、有易水解的离子、导致平衡移动使转化率或产率降低、加热温度不能过高等。
5)调节溶液的酸碱性(pH值):⑴调节溶液的pH值使其中某些离子形成沉淀。如Mn2+含有Fe2+,可先加氧化剂将Fe2+氧化为Fe3+,再调节溶液的酸度在3.7≤pH<8.3即可。⑵调节溶液的pH值应满足两个条件:首先是能改变溶液的pH值,其次是不引入或产生新杂质,或新杂质在后续过程中易除。
6)除杂试剂:应满足除杂实验的几个基本要求。
7) 萃取:萃取所需要的仪器、萃取剂的选用或操作方法。
8)洗涤:关于洗涤,经常涉及四个问题:⑴洗涤的目的通常有:除去晶体表面的可溶性杂质;⑵常用的洗涤试剂可以是蒸馏水、有机溶剂(如酒精、丙酮等)。有机物洗涤可防止水溶性产品溶于水,提高产率;⑶洗涤的方法;⑷如何证明洗涤干净。
9) 蒸发:蒸发掉一部分溶剂。有时要考虑反应时的气体氛围以抑制水解。
10) 蒸发浓缩、冷却结晶:适用于杂质的溶解度随温度变化不大物质的分离提纯。
11) 蒸发结晶、趁热过滤:适用于杂质的溶解度随温度变化较大物质的分离提纯,可减少杂质晶体的析出。
12) 沉淀剂过量的检验:欲使杂质离子完全沉淀,加入的沉淀剂要过量。
2常见题型探析
2.1考查资源的回收与利用
化工生产中使原料尽量转化为产品是降低成本、提高产量、增加效益的关键。资源的回收包括有毒气体的回收、废水的处理、金属资源的回收。
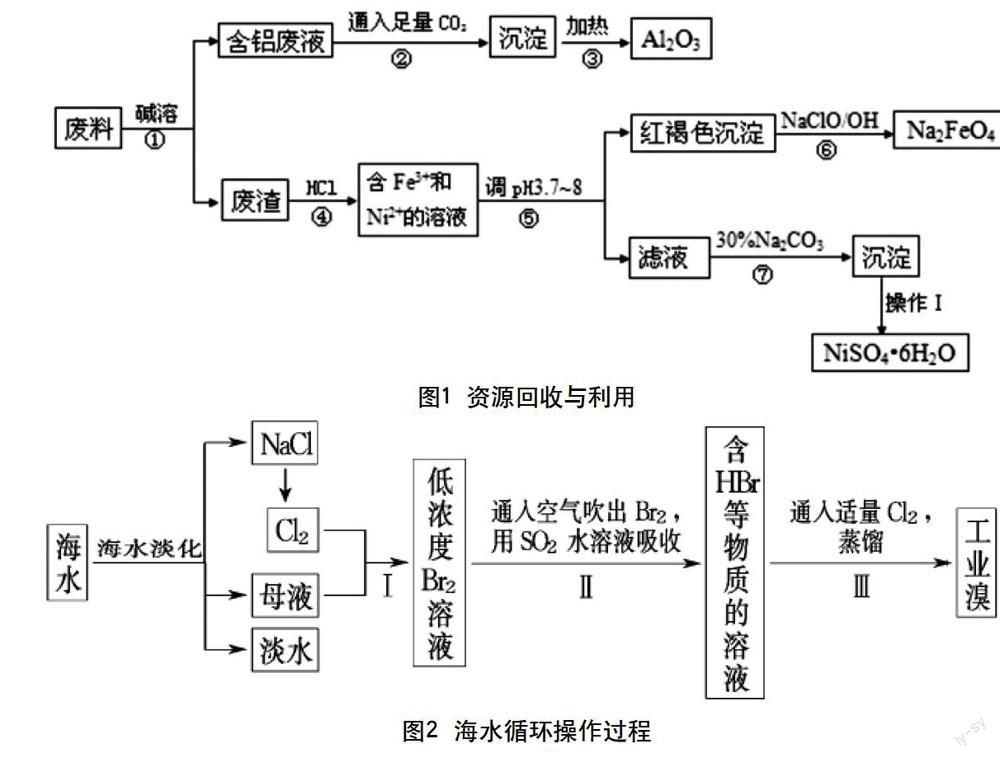
例1.某回收废料中含有Al2O3、Fe2O3、NiO多种金属氧化物,某实验小组同学欲将之分离并制备有关物质,设计流程如下图:
已知:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)过程②的离子方程式 。
(2)过程⑥用于制备绿色水处理剂,反应的离子方程式 。
(3)加入Na2CO3的目的是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
答案:(1)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(2)2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
(3)沉淀Ni2+
(4)静置后取上层清液少许再加入Na2CO3溶液后没有沉淀生成则沉淀完全,否则沉淀不完全
(5)①并用蒸馏水洗涤沉淀2~3次②向沉淀中滴加稀H2SO4,直至恰好完全溶解
解析:Al2O3、Fe2O3、NiO这三种氧化物,只有Al2O3溶于碱,所以Al2O3与碱反应生成可溶性的铝盐,再与过量CO2反应生成Al(OH)3和HCO3-,滤渣是Fe2O3、NiO,调节pH3.7~8使Fe3+全部转化为Fe(OH)3,Fe(OH)3与ClO-在碱性条件下反应生成FeO42-,2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;加入碳酸钠目的就是使Ni2+转化为NiCO3沉淀,再与H2SO4反应生成NiSO4。
2.2考查循环操作过程
化工生产中使原料尽量转化为产品是降低成本、提高产量、增加效益的关键。但反应进行时常常伴有中间产物、副产物等的生成。有些中间产物、副产物通过化学方法处理可以转化为原料,进一步循环回收利用。
例2.中菲“黄岩岛之争”和中日“钓鱼岛危机”,凸现了海洋资源的重要性。海水综合利用的工业流程图如下:
(1)将NaCl溶液进行电解,电解反应方程式 ,阴极产物为 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是___________________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是______________。
(4)分离出粗盐后的海水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从海水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是____________________,目的是________________。
②上述提取镁的流程中,为了降低成本,减少污染,可以采取很多措施,请写出其中一点_________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化生成步骤,体现简约性原则。你同意该同学的想法吗?为什么?______________________________________________。
【答案】(1)2NaCl+2H2O H2↑+Cl2↑+2NaOH(2分) NaOH、H2(1分)
(2)富集溴元素(2分)
(3)Br2+SO2+2H2O=4H++SO2-4+2Br-(2分)强酸对设备的严重腐蚀(2分)
(4)①在HCl气流中 抑制MgCl2水解(2分)
②电解产生的Cl2用于制取HCl气体(2分)
③不同意,因为MgO熔点很高,熔融时因耗费大量的能量而增加生产成本(2分)
解析:电解NaCl溶液:2NaCl+2H2O H2↑+Cl2↑+2NaOH,或也可得到H2和NaClO。步骤Ⅰ中获得低浓度Br2溶液,再经过步骤Ⅱ、Ⅲ可富集溴元素。(3)SO2与Br2发生氧化还原反应:SO2+Br2+2H2O=H2SO4+2HBr,产物是两种强酸,故在工业生产中要注意强酸对设备的严重腐蚀。加热得到无水MgCl2,要防止其水解。MgO熔点很高,熔融时因耗费大量的能量而增加生产成本。
总评:解答此类试题时,首先要通读试题和仔细分析流程图,明确目的和挖掘出隐含条件是得分的前提。还要注意答题的规范性。
