PVA包埋微球粒径对短程反硝化动力学影响
2015-07-19张宏伟余伟明张朝晖
张宏伟 ,余伟明,王 亮 ,赵 斌 ,张朝晖 ,张 凯
(1. 天津大学环境科学与工程学院,天津 300072;2. 天津工业大学环境工程系,天津 300387;3. 省部共建分离膜与膜过程国家重点实验室,天津 300387)
氨氮、硝酸盐、亚硝酸盐等无机氮化合物是污水中常见的污染物[1].过量的无机氮是水体富营养化的重要诱因,对水生生物产生严重危害.高效脱氮是评价含氮废水处理工艺效果的重要指标.全程反硝化过程是NO-→NO-→N,短程反硝化是直接NO-→3222N2的过程,与全程反硝化相比,短程反硝化能够节约40%的碳源[2].
与传统的生物脱氮方式相比,利用固定化微生物进行脱氮具有其独特的优势:①微生物浓度高,降解速率大;②沉降性好,更易实现分离;③即使水力停留时间很短,也能实现很长的污泥停留时间;④提高反应体系的抗毒害能力[3].学者们已经利用海藻酸钠(SA)[4]、聚乙二醇(PEG)[5]和聚乙烯醇(PVA)[6]等材料固定微生物,其中用以脱氮的研究也有很多.Yang等[7]利用三乙酸纤维素包埋活性污泥,用以处理生活污水,与传统的活性污泥系统相比,包埋系统能够获得更高的总氮去除率.Isaka等[8]用聚乙二醇包埋异养反硝化细菌,用以处理人工合成硝酸盐废水,在系统运行的第16天,去除能力达到4.4,kg/(m3·d).
虽然利用固定化微生物技术进行脱氮的研究很多,但是对于反硝化动力学的研究还很少.由于包埋材料对于 NO2-的传质阻力,固定化载体的粒径会对反硝化动力学过程产生影响,但有关粒径对反硝化过程,特别是对短程反硝化动力学的影响研究尚不多.为此,笔者以PVA作为包埋材料,制得3种粒径的包埋反硝化污泥微球,以亚硝酸盐作为反硝化氮源,研究不同粒径条件下pH值、温度、溶解氧(DO)对短程反硝化动力学的影响.
1 实验材料和方法
1.1 反硝化污泥
实验所用污泥分离自实验室既有的用于养殖废水处理的 A/O反应系统的缺氧段,为消除污泥悬浮液中既有亚硝酸盐对实验的影响,通过反复清洗、离心得到混合液中悬浮固体质量浓度(MLSS)为30.4,g/L污泥浓缩液,混合液中可挥发性悬浮固体质量浓度(MLVSS)为23.4,g/L.
1.2 包埋方法
将 15,g PVA 粉末(PVA124,平均聚合度 n=2,400,皂化度 99%,日本可乐丽)和 2,g SA 粉末(化学纯,天津科密欧)溶解到 150,mL去离子水中,灭菌20,min.冷却至室温后,加入 50,mL污泥,并置于磁力搅拌器上充分搅拌 30,min.固定化溶液为 3%硼酸和 2%氯化钙混合溶液,使用前以 2,mol/L氢氧化钠调整pH值至7.利用蠕动泵将浓缩污泥/PVA-SA的混合液缓慢滴入固定化溶液中,在室温下固化 12,h后用去离子水清洗3遍得到包埋反硝化污泥微球,并置于 4 ˚C保存.通过控制蠕动泵转速和锥形滴头尺寸调节微球粒径,得到不同粒径的3种微球.
1.3 实验方法
短程反硝化实验以去离子水配水进行,每升水中含有 493,mg NaNO2(约 100,mg/L)、625,mg CH3COONa(约合 COD 为 500,mg)、153,mg NaCl、252,mg MgSO4·7,H2O 和 72,mg CaCl2.在锥形瓶加入 135,mL合成废水和 15,cm3的包埋颗粒(相当于87.75,mg),对照组中加入135,mL合成废水和与微球所含污泥等量的活性污泥.通过磷酸盐缓冲溶液维持溶液在指定 pH值(无特殊说明实验溶液 pH值为7.5).实验在全温摇床(HYG-A,太仓市实验设备厂)中进行,摇床转速为 150,r/min.以摇床控制反应体系温度(若未指出,溶液温度为 35,℃).厌氧实验维持体系 DO低于0.05,mg/L(研究 DO影响时除外).研究DO对短程反硝化的影响时,反应容器调整为小型的好氧反应器,维持系统 DO质量浓度在 0.5~0.7,mg/L和 1.0~1.2,mg/L,其他实验条件不变.每组实验进行2次,取平均值.包埋微球样品置于含2.5%戊二醛的0.1,mol/L磷酸盐缓冲液(pH=7.3)中,在4,℃冰箱中固定12,h,用0.1,mol/L磷酸盐缓冲液(pH=7.3)清洗 3 次,分别用 50%、70%、80%、90%、100%酒精脱水 10,min,脱水后的样品置于真空干燥箱中 30,℃干燥 2,h,最后将样品喷金,进行扫描电镜(Hitachi s4800,日本)测定.
1.4 分析方法
NO2--N和 MLSS测试方法参照标准方法[9].溶解氧(DO)质量浓度采用便携式溶氧仪(HQ30,d,哈希,美国)测定.pH 值用数显酸度计(pHS-25,雷磁,中国上海)测定.
2 结果和讨论
2.1 包埋微球形貌特征
如图 1(a)所示,微球呈规则球状,3种包埋微球的粒径分别为 2.7,mm、3.6,mm和 4.8,mm.包埋微球表面光滑,呈微褐色(为污泥颜色).
包埋微球横截面的电镜照片如图 1(b)所示.由图可见在包埋微球的内部分布着密集的孔隙结构,呈多孔网状结构.微孔结构的存在一方面有利于溶质分子的传质,为反应底物和微生物代谢产物的传输提供通道,另一方面能够为包埋微球内部的微生物生长繁殖提供空间.

图1 PVA包埋微球形貌Fig.1 Morphology of PVA entrapping beads
2.2 包埋微球的短程反硝化动力学分析
图 2为不同粒径微球还原 NO2-效果.由图可见,随着时间的推移,NO2--质量浓度逐渐降低,其中游离污泥组在反应时间为6,h时基本降解完全;而粒径为2.7,mm的微球组在反应时间为6,h时,NO2--N质量浓度仍保持17,mg/L左右.

图2 污泥和不同粒径微球降解NO2--N比较Fig.2 Comparison of NO2--N degradation between sludge and entrapping beads with different diameters
零级反应动力学模型是目前应用最多的反硝化动力学模型[10-11].NO2--N的降解速率[12]可表示为

式中:ρNO-2-N为亚硝酸盐氮质量浓度,mg/L;V为NO2--N降解速率,mg/(L·h);kNO-2-N为NO2--N比降解速率,mg/(g·h);ρX为微生物质量浓度,g/L. 实验过程中系统内微生物质量浓度变化忽略不计,以0~6,h的 NO2--N质量浓度对时间做线性拟合,所得斜率即为 NO2--N的降解速率.由图 2可见,本实验中不同粒径包埋微球还原NO2--N过程均可用零级反应动力学进行描述,R2>0.98.当微球粒径分别为2.7、3.6 和 4.8,mm 时,NO2--N降解速率分别约为14.2、13.7 和 13.3,mg/(L·h),NO2--N比降解速率分别为 25.1、23.4、22.7,mg/(g·h),分别是游离污泥系统的 88%、82%和 79%.这表明,包埋微球的 NO2--N降解速率略低于游离污泥,并且随着微球粒径增大,NO2--N降解速率逐渐降低.
2.3 NO2-传质对短程反硝化的影响
NO2-通过微球的多孔结构进入包埋微球内部,与包埋的微生物接触,进而发生短程反硝化反应.由于实验系统碳源充足(氮碳比为 5),NO2-传质速率是决定微球短程反硝化动力学的主要因素.为评价NO2-传质对微球短程反硝化过程的影响,引入效率因子 η,其定义为降解速率(存在传质阻力)与微球表面降解速率(无传质阻力)的比值[13],即

式中 VS为微球表面的 NO2--N降解速率,mg/(L·h),本实验中以游离污泥的 NO2--N降解速率代替.η越小,传质作用对短程反硝化的影响越大[14].
图3为不同粒径微球效率因子随初始NO2--N质量浓度变化的情况.随 NO2--N质量浓度升高,微球结构对于NO2-传质的影响逐步减小.当NO2--N质量浓度高于 70,mg/L时,包埋所增加的 NO2--传质阻力对于反硝化速率的影响仅为 10%~20%,并且当粒径由2.7,mm增大至4.8,mm,效率因子η逐渐减小.当NO2--N质量浓度低于50,mg/L时,由于NO2-传质动力的下降,导致传质阻力的增加会显著降低 NO2-的传质速率,从而抑制短程反硝化过程,并且粒径越大抑制作用越明显.当 NO2--N质量浓度降至 20,mg/L时,粒径为 4.8,mm的微球的 NO2--N降解速率仅为相应微球表面 NO2--N降解速率的 24.1%.这也是短程反硝化过程后期(6,h后),当溶液中残留 NO2--N质量浓度相对较低时,短程反硝化过程偏离零级反应动力学的主要原因.

图3 效率因子随初始NO2--N质量浓度变化Fig.3 Changes of efficiency factor with the initialmass concentration of NO2--N
2.4 pH值对短程反硝化的影响
图 4为 pH值对短程反硝化比降解速率的影响.游离污泥对照组的数据表明,实验条件下短程反硝化的最佳pH值为7.0~8.0,这与文献[15]相吻合.微球的粒径对短程反硝化最佳 pH值无显著影响,但由于包埋材料对NO2-传质的限制,最佳pH值条件下微球的比降解速率低于游离污泥组.
当pH<7.0或>8.0时,微球的NO2--N比降解速率高于活性污泥组.当 pH值为 8.5时,不同粒径微球对应的 NO2--N比降解速率基本相同,约为25.0,mg/(g·h),是游离污泥组的1.3倍.而当pH值为 5.5时,NO2--N比降解速率随微球粒径增大而增大,表明 pH值对短程反硝化的影响已经超过包埋材料对NO2-传质的抑制.
NO2-还原受到 NO2-还原酶、NO 还原酶和 N2O还原酶的共同作用[16],而pH值是影响酶活性的重要因素.有研究指出,当pH值为6.8时,NO2-还原酶的活性比pH值为7.5时低10~15倍[17].因此,当系统pH值超出该过程关键酶的适宜 pH值范围后,短程反硝化过程会受到明显抑制.包埋微球结构能够对其中的微生物产生保护作用.这种保护作用有利于微生物适应不良的环境,抵抗外界环境压力的冲击[18].因此,即使在不适 pH值条件下,包埋微球仍表现出较好的适应性,具有更高的NO2--N比降解速率.
此外,游离亚硝酸(FNA)作为水中亚硝酸根存在的形式之一,其浓度与pH值密切相关.FNA会影响基因转录和酶的组合过程,进而对短程反硝化过程产生抑制[19].Ma等[20]从实验室反应器的缺氧段分离出活性污泥,研究 FNA对反硝化作用的影响.结果表明,当 FNA质量浓度从 0.010,mg/L升至0.025,mg/L,NO2--N降解速率下降了60%;当FNA质量浓度进一步升至 0.20,mg/L时,反硝化过程几乎停止.FNA质量浓度随温度和 pH值的变化可由式(3)计算[21],即
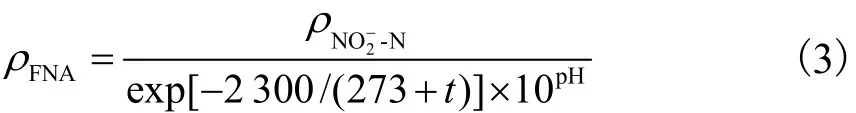
包埋材料在影响 NO2--N传质的同时也影响FNA的传质,特别是在 pH=5.7时,实验系统中FNA质量浓度达到0.35,mg/L时,极大抑制了游离污泥和微球表层微生物的短程反硝化过程.此时,粒径2.7、3.6、4.8,mm 的微球 NO2--N的比降解速率分别是游离污泥的 1.5、1.8和 2.1倍.而在微球内部,由于受到传质影响,FNA质量浓度相对较低,仍能保持较高的短程反硝化速率.因此,pH=5.7时随微球粒径的增加,NO2--N比降解速率逐步升高.
在高氨氮废水脱氮过程中,硝化过程消耗碱度导致 pH值降低,而反硝化过程产生碱度导致 pH值升高,因而系统 pH值容易产生波动,对脱氮效果影响较大.通过 PVA包埋反硝化污泥的方法,短程反硝化的适宜 pH值可由 7.0~8.0扩大到 6.5~8.5,有利于保持脱氮系统的高效稳定.
2.5 温度对短程反硝化的影响
温度对 NO2--N比降解速率的影响如图 5所示.温度影响酶活性[22],因此对 NO2--N比降解速率影响显著.与游离污泥对照组类似,包埋微球短程反硝化的最适温度在 30~40,℃,过高或过低的温度均会使NO2--N比降解速率显著下降.当温度由8,℃升至36,℃时,2.7,mm微球的 NO2--N 比降解速率由8.64,mg/(g·h)上升至 38.1,mg/(g·h),当温度升至48,℃时,NO2--N比降解速率降至 21.6,mg/(g·h).与游离污泥对照组相比,包埋微球在极端温度(4,℃和 48,℃)下的 NO2--N比降解速率更高.4,℃时2.7、3.6、4.8,mm 微球的 NO2--N比降解速率分别是游离污泥组的1.8、1.6、1.7倍,48,℃分别是污泥组的1.3、1.3、1.4倍.这说明包埋材料提高了反硝化微生物抵御环境温度的能力,对酶活性起到保护作用.整体而言,粒径对不同温度下比降解速率变化规律影响并不显著,这是温度对微生物活性的影响以及温度对NO2--N传质影响共同作用的结果.

图5 比降解速率随温度变化规律Fig.5 Changes of specific degradation rate with temperature
2.6 溶解氧对短程反硝化的影响
图6 为DO对NO2--N比降解速率的影响,DO显著抑制短程反硝化过程.对于游离污泥系统而言,当DO升高至0.5~0.7,mg/L时,NO2--N比降解速率下降了76%;进一步升高DO至1.0~1.2,mg/L,NO2--N比降解速率下降了91%.相同条件下,3.6,mm微球的NO2--N比降解速率分别只下降了 25%和 43%. 对于包埋微球系统而言,当 DO<0.05,mg/L时,2.7、3.6、4.8,mm微球对应的NO2--N比降解速率分别为31.6、29.2、27.4,mg/(g·h).当 DO 为 0.5~0.7,mg/L 和1.0~1.2,mg/L时,3种微球的 NO2--N的比降解速率都有所下降,其大小关系为3.6,mm微球>4.8,mm微球>2.7,mm微球.
NO2-的还原电势低于O2,因此O2具有更强的竞争电子供体能力,从而抑制NO2-还原.此外,O2的存在抑制亚硝酸盐还原酶合成,影响反硝化菌还原NO2-的活性[23].孙洪伟等[24]考察了实际高氨氮垃圾渗滤液短程生物脱氮过程中 DO对短程反硝化动力学的影响,当DO为0.4,mg/L时,反硝化活性降低了49%.在本实验中,尽管包埋微球同样受到 DO的影响,但受抑制幅度显然低于游离污泥系统.由于微球结构对O2传质的影响,包埋微球径向存在DO梯度,微球内部DO远低于表层.因此在外部DO较高的情况下,包埋微球内部可以保持较高的反硝化速率,这与 Qiao等[25]的研究结论相一致.通过包埋微生物的方式创造缺氧微环境是强化同步硝化反硝化的重要手段,其中包埋微球粒径影响DO和NO2-传质,直接关系反硝化速率.一方面,随着包埋微球粒径的增大,DO传质阻力增大,包埋微球内部的缺氧区域增大,更有利于反硝化作用的发生;但是另一方面,随着粒径的增大,NO2-的传质阻力也会增大,对反硝化反应产生不利影响.因而,当反应环境为低氧环境时,在 NO2-和O2传质的双重作用下,粒径为 3.6,mm的中等粒径小球的比降解速率最高.本实验中当0.5,mg/L<DO<0.7,mg/L和 1.0,mg/L<DO<1.2,mg/L时,3.6,mm粒径微球的NO2--N的比降解速率最高,达到 22.0,mg/(g·h)和 16.2,mg/(g·h),分别是相同条件下游离污泥体系的 2.8和 8.0倍,能够保证同步硝化反硝化体系良好的脱氮效果.

图6 溶解氧对比降解速率的影响Fig.6 Effect of DO on specific degradation rate
3 结 论
(1) PVA包埋反硝化污泥微球的短程反硝化过程符合零级反应动力学模型.当 NO2--N初始质量浓度为 100,mg/L时,受 NO2-传质影响,当微球粒径由2.7,mm增至 4.8,mm时,NO2--N的比降解速率由25.1,mg/(g·h)降至 22.7,mg/(g·h).
(2) 与游离污泥相比,包埋微球对不适宜 pH值和温度的耐受性提高了.在 pH=5.7时,粒径 2.7、3.6、4.8,mm 的微球 NO2--N的比降解速率分别是游离污泥的 1.5、1.8和 2.1倍;而 4,℃和 48,℃时,虽然包埋菌的 NO2--N的比降解速率比游离菌高,但是不同粒径微球间的反硝化速率差异并不显著.通过PVA包埋反硝化污泥的方法,有利于保持脱氮系统的高效稳定.
(3) 当 0.5,mg/L<DO<0.7,mg/L和 1.0,mg/L<DO<1.2,mg/L时,包埋微球的短程反硝化速率高于游离污泥系统.在 NO2-和 O2传质的双重作用下,3.6,mm粒径微球的NO2--N的比降解速率最高,分别达到 22.0,mg/(g·h)和 16.2,mg/(g·h),是相同条件下游离污泥体系的 2.8和 8.0倍,能够保证同步硝化反硝化体系中良好的脱氮效果.
[1] Zhou W, Sun Y, Wu B, et al. Autotrophic denitrification for nitrate and nitrite removal using sulfur-limestone[J].Journal of Environmental Sciences, 2011, 23(11): 1761-1769.
[2] Chung J, Bae W, Lee Y W, et al. Shortcut biological nitrogen removal in hybrid biofilm/suspended growth reactors[J]. Process Biochemistry, 2007, 42(3): 320-328.
[3] Sumino T, Nakamura H, Mori N, et al. Immobilization of nitrifying bacteria in porous pellets of urethane gel for removal of ammonium nitrogen from waste-water[J].Applied Microbiology and Biotechnology, 1992, 36(4):556-560.
[4] Yan J, Hu Y Y. Partial nitrification to nitrite for treating ammonium-rich organic wastewater by immobilized biomass system[J]. Bioresource Technology, 2009,100(8): 2341-2347.
[5] Qiao X, Zhang Z, Chen Q, et al. Nitrification characteristics of PEG immobilized activated sludge at high ammonia and COD loading rates[J]. Desalination, 2008,222(1/2/3): 340-347.
[6] Chang I S, Kim C I, Nam B U. The influence of polyvinyl-alcohol (PVA) characteristics on the physical stability of encapsulated immobilization media for advanced wastewater treatment[J]. Process Biochemistry, 2005,40(9): 3050-3054.
[7] Yang P Y, Su R, Kim S J. EMMC process for combined removal of organics, nitrogen and an odor producing substance[J]. Journal of Environmental Management, 2003,69(4): 381-389.
[8] Isaka K, Kimura Y, Osaka T, et al. High-rate denitrification using polyethylene glycol gel carriers entrapping heterotrophic denitrifying bacteria[J]. Water Research,2012, 46(16): 4941-4948.
[9] 魏复盛.水和废水监测分析方法[M]. 北京:中国环境科学出版社, 2002.Wei Fusheng.Standard Methods for the Examination of Water and Wastewater[M]. Beijing:China Environmental Science Press, 2002(in Chinese).
[10] Foglar L, Briški F, Sipos L, et al. High nitrate removal from synthetic wastewater with the mixed bacterial culture[J]. Bioresource Technology, 2005, 96(8): 879-888.
[11] Glass C, Silverstein J A. Denitrification kinetics of high nitrate concentration water: pH effect on inhibition and nitrite accumulation[J]. Water Research, 1998, 32(3):831-839.
[12] Pala A, Bölükbaş Ö. Evaluation of kinetic parameters for biological CNP removal from a municipal wastewater through batch tests[J]. Process Biochemistry, 2005,40(2): 629-635.
[13] Dursun A Y, Tepe O. Internal mass transfer effect on biodegradation of phenol by Ca-alginate immobilized Ralstonia eutropha[J]. Journal of Hazardous Materials,2005, 126(1/2/3): 105-111.
[14] Aksu Z, Bülbül G. Determination of the effective diffusion coefficient of phenol in Ca-alginate immobilized P.Putida beads[J]. Enzyme and Microbial Technology,1999, 25(3): 344-348.
[15] Lee K C, Rittmann B E. Effects of pH and precipitation on autohydrogenotrophic denitrification using the hollow-fiber membrane-biofilm reactor[J]. Water Research,2003, 37(7): 1551-1556.
[16] Ka J O, Urbance J, Ye R W, et al. Diversity of oxygen and N-oxide regulation of nitrite reductases in denitrifying bacteria[J]. FEMS Microbiology Letters, 1997, 156(1):55-60.
[17] Baumann B, van der Meer J R, Snozzi M, et al. Inhibition of denitrification activity but not of mRNA induction in Paracoccus denitrificans by nitrite at a suboptimal pH[J]. Antonie van Leeuwenhoek, 1997, 72(3): 183-189.
[18] Magrí A, Vanotti M B, Szögi A A. Anammox sludge immobilized in polyvinyl alcohol (PVA) cryogel carriers[J]. Bioresource Technology, 2012, 114: 231-240.
[19] Zhou Y, Oehmen A, Lim M, et al. The role of nitrite and free nitrous acid (FNA) in wastewater treatment plants[J]. Water Research, 2011, 45(15): 4672-4682.
[20] Ma J, Yang Q, Wang S, et al. Effect of free nitrous acid as inhibitors on nitrate reduction by a biological nutrient removal sludge[J]. Journal of Hazardous Materials,2010, 175(1): 518-523.
[21] Torà J A, Lafuente J, Baeza J A, et al. Combined effect of inorganic carbon limitation and inhibition by free ammonia and free nitrous acid on ammonia oxidizing bacteria[J]. Bioresource Technology, 2010, 101(15): 6051-6058.
[22] Zumft W G. Cell biology and molecular basis of denitrification[J]. Microbiology and Molecular Biology Reviews,1997, 61(4): 533-616.
[23] Nester E W, Roberts C E, Pearsall N N, et al. Microbiology[M]. New York:Holt Rinehart and Winston, 1978.
[24] 孙洪伟, 魏东洋, 王淑莹, 等. DO 对高氨氮渗滤液短程生物脱氮反硝化过程动力学的影响[J]. 环境科学学报, 2010, 30(5): 935-940.Sun Hongwei, Wei Dongyang, Wang Shuying, et al. The effect of DO on the kinetics of denitritation and partial nitrogen removal from landfill leachate with high ammonia contration[J]. Acta Scientiae Circumstantiae, 2010,30(5): 935 -940(in Chinese).
[25] Qiao S, Tian T, Duan X, et al. Novel single-stage autotrophic nitrogen removal via co-immobilizing partial nitrifying and anammox biomass[J]. Chemical Engineering Journal, 2013, 230: 19-26.
