基于蛋白包覆金纳米簇的碱性蛋白酶荧光检测
2015-07-19苏荣欣何志敏
苏荣欣 ,李 伟,齐 崴 ,何志敏
(1. 天津大学化工学院化学工程联合国家重点实验室,天津 300072;2. 天津化学化工协同创新中心,天津 300072)
蛋白酶是目前商业化程度最高、应用最广的一类酶[1].碱性蛋白酶作为蛋白酶的一种,已被证明在洗涤添加剂[2]、食品、服装、医药以及检测试剂等行业具有很大的应用前景[3].目前,对碱性蛋白酶的研究多集中在从不同的动物组织、植物组织和菌种中提取并纯化碱性蛋白酶[4-11].而对酶活的检测一直使用传统的比色方法[12-13],检测过程较为繁琐,检测灵敏度较低.有关检测方法的研究极少报道.由于碱性蛋白酶的酶活一般较弱,开发一种可快速、准确且灵敏检测碱性蛋白酶的方法极具现实意义.
金纳米颗粒具有超小尺寸、良好生物相容性和较低的生物毒性,从而吸引了大量研究者的兴趣.而荧光金纳米簇不仅具有金纳米颗粒的优点,更具有良好的荧光性质,因此被大量应用到荧光标记、生物检测以及小分子检测中[14-16].近年来,蛋白合成金纳米簇方法得以建立[17-19],使得荧光金纳米簇的应用范围获得进一步扩展[20].
笔者利用以溶菌酶为模板合成的金纳米簇,建立碱性蛋白酶浓度的定量检测方法,考察金纳米簇与碱性蛋白酶溶液体积比、反应温度和反应时间对检测灵敏度的影响规律,进一步确定该方法的检测范围和检测限.
1 碱性蛋白酶检测原理
本检测方法的检测原理如图 1所示.在 pH为13的条件下,溶菌酶作为模板剂和还原剂合成由 25个金原子组成的金纳米簇.在溶菌酶的保护下,金纳米簇可以稳定存在,并且保持荧光性能.保持 pH为13的条件下,加入碱性蛋白酶,碱性蛋白酶将包覆金纳米簇上的溶菌酶水解,使金纳米簇失去保护,从而使环境中的氧气猝灭金纳米簇的荧光[21].本检测方法就是利用碱性蛋白酶水解溶菌酶导致荧光猝灭,并根据荧光猝灭的程度对体系中碱性蛋白酶的含量进行准确、灵敏地检测.由于在碱性条件下,其他蛋白酶的活性很低,因此本方法对碱性蛋白酶检测具有较好的选择性.

图1 利用蛋白酶剪切作用检测碱性蛋白酶的原理Fig.1 Schematic illustration of the detection of alkaline protease based on their scissor
2 实 验
2.1 仪器与药品
仪器:荧光光谱仪(安捷伦科技有限公司);JEM-2100F透射电子显微镜(日本 JEOL公司);恒温水浴摇床(优莱博技术有限公司);SevenGo™ pH-SG2型pH计(梅特勒-托利多公司);TU-1810型紫外分光光度计(北京普析通用仪器有限公司).
药品溶菌酶(梯希爱化成工业发展有限公司);氯金酸(HAuCl4·4H2O,阿拉丁公司,上海);实验所用碱性蛋白酶(200,unit/g);胃蛋白酶、胰蛋白酶、葡萄糖氧化酶和过氧化氢酶均来自北京普博欣生物科技有限责任公司;配置缓冲液所用的氯化钾和氢氧化钠来自阿拉丁公司,均为分析纯.
2.2 溶菌酶稳定的金纳米簇的制备
合成金纳米簇所需玻璃容器均经彻底清洗,并用王水(HNO3和 HCl体积比为 1∶3)浸泡,用双蒸水充分冲洗并烘干后使用.以溶菌酶为模板合成金纳米簇的方法参见文献[17,22-23].本实验合成金纳米簇的方法为:将 125,mg溶菌酶在快速搅拌的条件下溶解到 5,mL双蒸水中,待充分溶解之后加入 5,mL 10,mmol/L的氯金酸溶液,室温下充分混合 1~2,min,此时混合溶液变为棕色.使用 1,mol/L的氢氧化钠溶液将混合溶液的pH调节到13,由于超过了溶菌酶的等电点,此时出现白色沉淀.在室温下搅拌1~2,min后,将反应溶液转入 37,℃恒温水浴摇床中,200,r/min,反应 12,h.反应后溶液变为红色,避光冷藏待用.
2.3 检测方法条件优化
为了在短时间内获得最好的检测效果,本实验考察了金纳米簇的制备时间、检测反应温度、溶菌酶比例及反应时间的影响,进而确定反应进行的条件.后续的检测实验按优化后的条件进行.
2.4 碱性蛋白酶检测
碱性蛋白酶检测中所用到的缓冲溶液均提前过膜,防止杂质对实验结果的影响.将 10,mg碱性蛋白酶溶解到1,mL pH为13的氯化钾-氢氧化钠缓冲溶液中配制成 5,mg/mL的母液,而后稀释成不同浓度的酶溶液.选择 pH为 13的缓冲溶液是为了既保证碱性蛋白酶活性的条件,又不影响金纳米簇的荧光性质.在7,mL干净的离心管中,依次加入2.7,mL不同浓度的碱性蛋白酶溶液和 3,mL金纳米簇溶液,混匀后放入 40,℃的恒温水浴摇床中,200,r/min,反应3,h.采用荧光光谱仪在激发光波长为532,nm的条件下检测所得溶液在600~900,nm的发射光光谱.
3 结果与讨论
3.1 金纳米簇的表征
如图2所示,在该实验条件下合成的金纳米簇粒径在 3~10,nm 之间,大于蓝光金纳米簇粒径[19],较为符合文献[17]所报道的发红光金纳米簇的粒径.
在 350,nm 紫外光照射下,可以看到合成的金纳米簇可以发出红色荧光.使用荧光光谱仪进一步确定金纳米簇的激发和发射光谱.如图 3所示,所获得的金纳米簇的激发波长为 532,nm,在此激发波长下,金纳米簇的发射波长为 670,nm左右.所有数据经归一化处理.
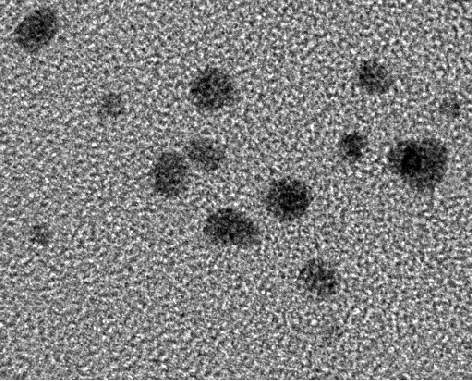
图2 金纳米簇的透射电镜图Fig.2 TEM image of Au NCs
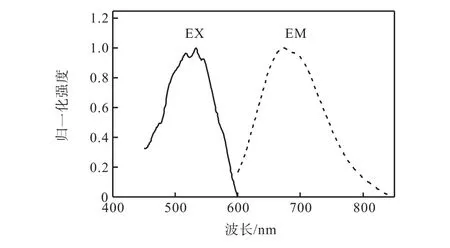
图3 金纳米簇的荧光激发(EX)和发射(EM)光谱Fig.3 Fluorescence excitation (EX) and emission (EM)spectra of Au NCs
3.2 实验条件的优化
为了获得最佳的检测结果,本实验考察了检测体系中金纳米簇与酶溶液比例、反应温度、反应时间对检测效果的影响.之后的检测按照优化后的条件进行.
3.2.1 反应机理验证
为了验证反应机理,检测了金纳米簇与碱性蛋白酶反应前后粒径的变化.实验结果如图 4所示,曲线1对应未与碱性蛋白酶反应的金纳米簇的粒径分布,曲线 2对应 100,μg/mL碱性蛋白酶 2,700,μL,在 40,℃条件下与 300,μL金纳米簇溶液反应 2,h后的粒径分布.可以看到金纳米簇粒径在反应前后从 8,nm左右下降到 4,nm 左右,这证明了碱性蛋白酶与金纳米簇表面包覆的溶菌酶相互作用,将溶菌酶水解,从而验证了之前所设计的反应机理.
3.2.2 金纳米簇与酶溶液比例的确定
由于碱性蛋白酶的酶活较弱,为了在短时间内达到对碱性蛋白酶的有效检测,检测体系中酶溶液应占较大比例.这里考察了金纳米簇溶液与 100,μg/mL碱性蛋白酶溶液体积比分别为 4∶6、2∶8、1∶9和5∶95条件下,在40,℃下反应2,h后荧光强度相对降低值(即荧光信号)(I0-I)/I0.结果如图 5所示,荧光信号随着碱性蛋白酶溶液比例的增高而增高.虽然体积比为5∶95时信号最强,但由于在该比例下荧光强度较弱,当酶浓度较低时,检测信号波动较大.因此1∶9被选为后续实验的标准比例.

图5 不同金纳米簇与碱性蛋白酶溶液体积比的荧光信号Fig.5 Fluorescence signals made by different volume ratios of Au NCs to alkaline protease solution
3.2.3 反应温度的确定
由于碱性蛋白酶的最适温度在 40~55,℃之间,本实验分别检验了 37,℃、40,℃、45,℃、50,℃和 55,℃条件下,2.7,mL 100,μg/mL的碱性蛋白酶溶液与300,μL金纳米簇溶液混合后荧光相对下降值(即荧光信号)(I0-I)/I0随时间的变化.结果如图 6所示,37,℃条件下,基本无荧光信号;40,℃、45,℃、50,℃和55,℃条件下,荧光信号均随时间增加逐渐增强.虽然荧光信号的程度随温度升高而增强,但为了避免由于高温对金纳米簇荧光强度的影响,本实验选取较温和的条件,即40,℃,为反应温度.
3.2.4 反应时间的确定
为了使本检测方法可以在较短时间内达到对碱性蛋白酶的灵敏检测,考察了 0,μg/mL和 500,μg/mL碱性蛋白酶溶液可获得的荧光信号随时间的变化,以便选择合适的反应时间.如图 7所示,反应 60,min后,500,μg/mL和 0,μg/mL碱性蛋白酶所产生的荧光信号差别随反应的进行逐渐增大.由于本方法将检测较宽浓度范围的碱性蛋白酶,故选择反应时间为180 min.

图6 不同反应温度下荧光信号随时间的变化Fig.6 Change of fluorescence signal with reaction time at different temperatures

图7 碱性蛋白酶质量浓度为 0,μg/mL 和 500,μg/mL 时荧光信号随反应时间的变化Fig.7 Change of fluorescence signal with reaction time in 0 μg/mL and 500 μg/mL alkaline protease solution
3.3 碱性蛋白酶检测曲线的建立
依照第2.2节方法进行碱性蛋白酶检测实验.实验发现:当反应时间相同时,随着酶浓度的增加,荧光强度降低更多.从图 8可见,碱性蛋白酶质量浓度与相应的荧光信号在对数坐标下呈线性,在 2~2,000,μg/mL 范围内成良好线性(R2=0.986),检测限为 0.1,μg/mL(S/N=3).根据碱性蛋白酶的酶活值(200,unit/g),检测线性区间为 4×10-5~0.04,unit/mL,检测限为 2×10-6,unit/mL.证明该方法可检测的碱性蛋白酶含量线性范围较大.
3.4 方法选择性考察
为了考察本检测方法对碱性蛋白酶检测是否具有专一性,本实验引入胃蛋白酶和胰蛋白酶作为蛋白酶类干扰物,引入葡萄糖氧化酶和过氧化氢酶作为其他酶类干扰物.实验中用到的所有酶的质量浓度均为 500,μg/mL.干扰酶检测实验条件与碱性蛋白酶检测相同.如图 9所示,碱性蛋白酶所产生的信号明显大于其他蛋白酶或其他种类酶,证明该检测方法具有实际应用的可能.值得注意的是,胃蛋白酶的检测信号为负值,说明加入胃蛋白酶后,金纳米簇的荧光强度不降反增.这是因为胃蛋白酶在碱性条件下没有剪切蛋白的活性,由于它本身也是一种蛋白,同样可作为合成金纳米簇的还原剂和稳定剂.因此,在反应过程中,那些未被溶菌酶吸附还原的 A uCl4-有可能会被胃蛋白酶还原为荧光金纳米簇,使荧光强度升高.
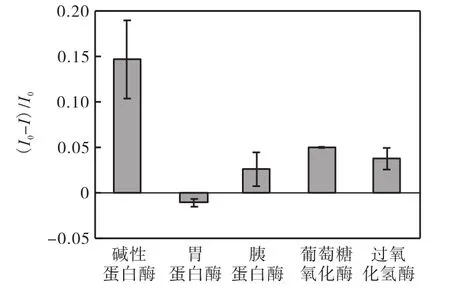
图9 金纳米簇对碱性蛋白酶和其他干扰物的荧光响应Fig.9 Fluorescence responses of Au NCs to alkaline protease and other interfering substances
4 结 语
本文利用碱性蛋白酶与金纳米簇表面包覆的溶菌酶的相互作用,建立了一种碱性蛋白酶灵敏、高效的荧光检测技术,研究了金纳米簇与碱性蛋白酶溶液体积比、反应温度和反应时间对检测灵敏性的影响,发现当金纳米簇与碱性蛋白酶溶液体积比为 1∶9、反应温度为40,℃、反应时间为3,h的条件下,检测效果最好.该方法检测线性区间为4×10-5~0.04 unit/mL,检测限为 2×10-6,unit/mL,同时为蛋白稳定的荧光金属纳米簇拓展了一种新的生物检测应用.
[1] Rao M B,Tanksale A M,Ghatge M S,et al. Molecu-lar and biotechnological aspects of microbial proteases[J]. Microbiology and Molecular Biology Reviews,1998,62(3):597-635.
[2] Maurer K H. Detergent proteases [J]. Current Opinion in Biotechnology,2004,15(4):330-334.
[3] Gupta R,Beg Q K,Lorenz P. Bacterial alkaline proteases:Molecular approaches and industrial applications[J]. Applied Microbiology and Biotechnology,2002,59(1):15-32.
[4] Van Heyningen S,Secher D S. A new alkaline protease from Acremonium kiliense [J]. Biochemical Journal,1971,125(4):1159-1160.
[5] Eguchi M,Kuriyama K. Purification and characterization of membrane-bound alkaline proteases from midgut tissue of the silkworm,Bombyx mori [J]. Journal of Biochemistry,1985,97(5):1437-1445.
[6] Rivett A J. Purification of a liver alkaline protease which degrades oxidatively modified glutamine synthetase:Characterization as a high molecular weight cysteine proteinase [J]. Journal of Biological Chemistry,1985,260(23):12600-12606.
[7] Matsuzawa H,Tokugawa K,Hamaoki M,et al. Purification and characterization of aqualysin Ⅰ(a thermophilic alkaline serine protease)produced by Thermus aquaticus YT-1 [J]. European Journal of Biochemistry,1988,171(3):441-447.
[8] Monod M,Togni G,Rahalison L,et al. Isolation and characterisation of an extracellular alkaline protease of Aspergillus fumigatus [J]. Journal of Medical Microbiology,1991,35(1):23-28.
[9] Joo H S,Choi J W. Novel alkaline protease from the polychaeta,Periserrula leucophryna:Purification and characterization [J]. Process Biochemistry,2001,36(8/9):893-900.
[10] Miyaji T,Otta Y,Shibata T,et al. Purification and characterization of extracellular alkaline serine protease from Stenotrophomonas maltophilia strain S-1 [J]. Letters in Applied Microbiology,2005,41(3):253-257.
[11] Jellouli K,Ghorbel-Bellaaj O,Ayed H B,et al. Alkaline-protease from Bacillus licheniformis MP1:Purification,characterization and potential application as a detergent additive and for shrimp waste deproteinization [J]. Process Biochemistry,2011,46(6):1248-1256.
[12] Kembhavi A A,Kulkarni A,Pant A. Salt-tolerant and thermostable alkaline protease from Bacillus subtilis NCIM no. 64 [J]. Applied Biochemistry and Biotechnology,1993,38(1/2):83-92.
[13] Anson M L. The estimation of pepsin,trypsin,papain,and cathepsin with hemoglobin [J]. Journal of General Physiology,1938,22(1):79-89.
[14] Durgadas C V,Sharma C P,Sreenivasan K. Fluorescent gold clusters as nanosensors for copper ions in live cells [J]. Analyst,2011,136(5):933-940.
[15] Fang Y M,Song J,Chen J S,et al. Gold nanoparticles for highly sensitive and selective copper ions sensing—Old materials with new tricks [J]. Journal of Materials Chemistry,2011,21(22):7898-7900.
[16] Li J,Lin X. Simultaneous determination of dopamine and serotonin on gold nanocluster/overoxidizedpolypyrrole composite modified glassy carbon electrode[J]. Sensors and Actuators B:Chemical,2007,124(2):486-493.
[17] Xie J P,Zheng Y,Ying J Y. Protein-directed synthesis of highly fluorescent gold nanoclusters [J]. Journal of the American Chemical Society,2009,131(3):888-889.
[18] Kawasaki H,Hamaguchi K,Osaka I,et al. pH-dependent synthesis of pepsin-mediated gold nanoclusters with blue green and red fluorescent emission [J].Advanced Functional Materials,2011,21(18):3508-3515.
[19] Chen T H,Tseng W L. (Lysozyme type Ⅵ)-stabilized Au8 clusters:Synthesis mechanism and application for sensing of glutathione in a single drop of blood [J].Small,2012,8(12):1912-1919.
[20] Yuan X,Luo Z,Yu Y,et al. Luminescent noble metal nanoclusters as an emerging optical probe for sensor development [J]. Chemistry—An Asian Journal,2013,8(5):858-871.
[21] Wang Y,Wang Y,Zhou F,et al. Protein-protected Au clusters as a new class of nanoscale biosensor for labelfree fluorescence detection of proteases [J]. Small,2012,8(24):3769-3773.
[22] Wei H,Wang Z,Yang L,et al. Lysozyme-stabilized gold fluorescent cluster:Synthesis and application as Hg2+sensor [J]. Analyst,2010,135(6):1406-1410.
[23] Hu L,Han S,Parveen S,et al. Highly sensitive fluorescent detection of trypsin based on BSA-stabilized gold nanoclusters [J]. Biosensors and Bioelectronics,2012,32(1):297-299.
