从“微粒之间的相互作用力”的复习课教学谈化学观的构建
2015-07-08吴声文
吴声文
特级教师程同森曾说,“没有基本观念统领的知识教学是把‘种子磨成‘面粉的教学”,“观念为本”的教学“具有超越课堂之外的持久价值”。化学基本观念是指学生通过具体化学知识学习后在头脑中建立起来的概括性认识,是学生若干年后,将许多事实性知识忘掉,还在头脑中留存下来的观念、思维和方法。[1]
高中化学苏教版《必修2》专题一中“微粒之间的相互作用力”这一单元充分体现了中学化学重要的元素观、微粒观、变化观和分类观。它折射出化学动态的外在美和奇妙的内在美,其中不仅蕴含着“简单孕育复杂”的哲学思想,更是“结构与性质的因果关系”“真理相对性和绝对性辩证统一”“人与自然和谐发展”的精彩演绎。那些看似简单的元素和简单的作用方式不仅让自然界处处闪烁着化学的光芒,也让人类充分发挥化学创造的魅力,不断把自然界“自在之物”改造成“为我之物”,开辟出充满创意的“崭新世界”。
笔者就“微粒之间的相互作用力”这一单元的复习课谈谈如何帮助学生建构化学基本观念。
一、生活中捕捉“微粒观”
问题1:生活中常常遇到下列现象,有想过原因吗?
(1)走入公园,能闻到花香。
(2)在潮湿的环境中,接触电源会触电。
深入思考:物质是由哪些微粒构成的?生活中还有哪些现象可以作为你的证据?
问题1培养学生用化学的眼光去看待周围世界,用宏观入微观的方法揭示万般现象深处的本质原因,用大胆想象和抽象思维揭示生活中熟悉现象背后的“微粒观”,从而感悟由微小的粒子个体构造出的绚烂多姿、无穷变化的宏观天地。
二、物质世界中感受“元素观”
问题2:利用H、C、N、O、Na元素组成符合下列要求的物质:
(1)只含有离子键的物质;
(2)只含有共价键的化合物;
(3)既含离子键又含共价键的物质;
(4)含有分子间作用力的单质。
深入思考:这五种元素还可以构成哪些其他类别的物质?
问题2不仅让学生厘清了微粒间相互作用的种类、特点及形成的晶体类型,而且还强烈感受到了物质世界中简洁、普适、深刻的“元素观”。学生能够轻松地罗列出这五种元素构成的各种物质,但在这过程中,如果教师适时引导:“由这五种元素总共可以形成多少种物质呢?”学生猛然间会发现,仅由上述五种元素实则可以形成上万种物质,特别是由碳构成的有机物,是一个庞大的家族,不仅在种类上多,而且在结构上也可能是异常复杂的。自然界中还有一百多种元素,依此形成的物质,可想而知是不计其数!这是多么完美的一幅“道生一,一生二,二生三,三生万物”的演绎图景。人体正是由简单的元素最终形成复杂生命现象的代表。“简单孕育复杂”的哲学思想在此展现得如此淋漓尽致!当我们再把目光投射到生活生产中,就会发现:由于五种元素间相互作用方式存在差异,组成物质的性质不尽相同,对应的使用价值也就各有不同。这一因果关系正是化学思维中“结构决定性质”的映射。
三、“电子式”中透视“分类观”
问题3:书写下列几种物质的电子式:
NaCl、MgCl2、NaOH、H2O、HCl、Cl2、O2
思考:(1)电子式书写要遵循哪些规则?能否就上述每种电子式的类型,列举与之相似的物质?
(2)根据电子式,总结离子键和共价键在成键元素、成键微粒、成键本质、存在物质类别上的区别?
(3)电子式在表示上述物质时,有哪些优点,又会存在什么样的缺点?
从宏观、微观和符号三种水平上认识和理解化学知识,并建立三者之间的内在联系,从而形成化学学科特有的思维方式,我们称之为三重表征思维方式。电子式本质上即为化学符号。因此在这个环节让学生书写电子式有利于进一步理解两种化学键的不同本质,同时又进行思维发散。学生通过枚举,将一种物质的电子式迁移延伸至多种物质,虽是不完全归纳,但在尝试总结几类常见电子式模式的思维加工中,训练了类比和归纳能力。电子式的优点是可以直观地看到不同化学键中成键元素、构成微粒、作用方式的区别。正是存在这些不同,我们有必要对化学键进行分类,分类是化学家研究物质的基本思想,它使纷繁复杂的物质世界变得有序而有趣。分类后又需要对其进行区别表征,电子式的产生也就理所当然了。既然电子式是一种区分化学键的方法,故在书写时,先要判断该物质所属类别,避免离子与原子混用的错误,同时还要注意微粒的排布、阴阳离子的写法、是否符合稳定结构或成键规则等。
四、化学键中洞悉“变化观”
问题4:以NaCl、HCl、Cl2为例,说明这些物质在形成过程中,元素的最外层电子排布分别发生了怎样的变化?找出三者之间的相同点和不同点?
三种元素在形成上述物质的过程中存在的相同点是:外层电子都趋向于形成八(或二)电子结构。这是一种稳定结构状态,在自然界中就存在着,即稀有气体。正是这一稳定结构,决定了它们特殊的性质,也是它们成为空气中最不易被发现成分的原因之一。
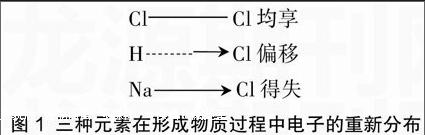
在描述不同点时,氯化钠是学生最熟悉的,它的形成过程是由于电子的得失;氯化氢则是共用电子对的典型代表,但电子对存在偏移现象;再看氯气,分子中两原子却能均等地共享电子对。若用图1对比三种物质的形成过程,竟然仅是电子的运动方式由最平和的一端走向最剧烈的一端,这让学生不可思议地“看”到了电子在非极性共价键向极性共价键,最后到离子键的演变过程,隐隐中感觉到一股“量变终究导致质变”的冲破力量。
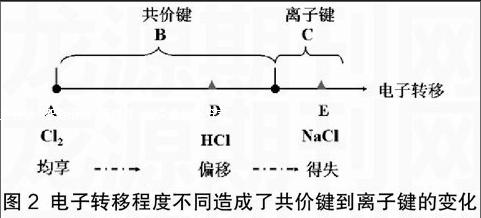
如果此时教师能够适时引导,可以起到更有效地帮助学生形成“变化观”和“量变质变观”的作用。教师可以进行如图2阐述:
由图2得知,电子从均等共享的极端形式A点(非极性键),渐变到电子对发生偏移的B区间(极性键,除A点外),最后过渡到另一极端形式,理论上称电子得失(事实上,在自然界中并不存在)。在C区间,电子对偏移程度都超过一定的临界,我们人为地定义这样的化学键为离子键。所以,离子键只不过是电子的偏移方式到了某一程度的结果,正如量的不断积累必然会引起质的飞跃。从键的极性看,离子键可以看成是最强的极性键。而在漫长的量变过程中,皆处于共价键阶段,故它是自然界中更普遍存在的一种形式,前者不过是特例而已。当然,学生今后有机会学习到《物质结构与性质》时,便更能深刻地体会到图2中的横坐标应是电负性差,共价键与离子键的分界(E点)是1.7,离子键和共价键之间并没有绝对的界限,他们所熟悉的氯化钠中,键的离子性百分数也仅占了70%而已。可以说自然界中有绝对的共价键,却不存在绝对的离子键。接下来,教师可以把学生所知的物质都纳入到图2中,促进学生整体性知识的形成。endprint
深入思考:(1)根据这一原理,大家能否列举属于A点、B区间、C区间的其他物质?并说明有什么规律?
(2)能否利用元素周期律说明HF、CsCl在坐标中的大致位置,并说明原因。
以A点为例,一开始,学生会列举N2、O2、H2、Br2等,教师只需一点拨“这些物质有什么特点”,学生随即恍然大悟:原来都是非金属单质,正是相同的两种元素争夺电子的能力相同才造成电子对的均享。这样,在列举B区间的物质时,学生不再围绕具体的物质,而是直接总结出“由不同元素构成的电子对发生偏移的共价键”,跨过E点之后就是活泼金属与活泼非金属构成的离子化合物,还有铵盐、强碱、含氧酸盐等少数物质。HF处在B区间,由于F的非金属更强,故在HCl的稍右边。同理,CsCl在C区间NaCl的右边。学生在体会到根据元素周期律还可以分析出每种物质在图中的位置的同时,还会尝试着列举出其他物质在坐标上的位置。虽然学生在此处还未接触到金属键的知识,今后还需要在细节上进行修正完善,但以上的学习经历并不妨碍学生体验感知—抽象—归纳—演绎的思维加工过程,终会形成获取科学知识的有效手段,并发展出积极的情感。
上述过程不仅是“变化观”“个别到一般”“元素周期律”中“量与质统一”的揭示,更是让学生体验整体性知识建构的过程。世界是整体的,我们的教育也要是整体的。教师要有意识地将学生的理解建构到“大概念”中,以确保学生获得关于世界的认识不是一些支离破碎、无关事实的集合体,而是一些彼此联系的组件所构成的整体。事实上,儿童的禀赋是人在自然中经漫漫岁月、千锤百炼、演化得了的珍贵特质,天生具有辨认复杂事物之特征的高度能力,善于从复杂事物中抓取特征、辨认异同,惯于整体联系地把握每种现象的规律。[2]如果我们再用碎片式的教学去发展所谓的“文明能力”真是罪过了。
五、“微粒间作用力”发展“化学价值观”
(一)生活生产中借助“微粒间相互作用”
问题5:氯化钠和水在性质上有哪些异同点?并说明原因。
这是让学生应用“结构决定性质”的观点解释“化学键、分子间作用力对物质性质的影响”,是用“化学价值观”看待书本知识与生活生产和自然现象的联系。由于离子键的存在,氯化钠的熔沸点异常高,而水凝聚态的变化只需克服分子间作用力(包括氢键),故熔沸点相对低。这个区别成为人类从海水中获取食盐和淡水的重要原理。氯化钠在熔融状态下能导电,水却不能,这个差异成为鉴别离子化合物与共价化合物的实验依据。像氯化钠这类离子化合物能够在水中电离而使溶液具备导电能力,既是工业上电解水时寻找合适电解质的启示,又是课堂伊始关于“手触摸电源会导电”的再次论述。至于氯化钠与水的共同点,则归结于化学键强烈的作用力,二者分解温度均异常高,这一事实指导着我们只能用电解法从水或氯化钠中获取相应的单质。当学生看到生活生产中许多现象都“事出有因”时,他们会对化学知识充满兴趣,由此产生了持续的学习动力。
(二)生物圈依赖于微粒之间的相互作用力
问题6:(1)地球的岩层中有二氧化硅、硅酸盐;地球的表层有水;地球的大气层有空气……这些物质经历了上亿年历史变迁而岿然不动,成为地球上鲜活生命绽放的无机环境,请解释这些物质稳定存在的原因?
(2)水熔沸点比相同类型分子高,这为依附于地球的生物体提供了宝贵的水源。你知道水中这种奇妙的力量是什么吗?你能说明它对整个生物圈的意义吗?
通过这两个问题,让学生感受到本节课内容对自然界物种存在、对整个生物圈的维持起着举足轻重的作用。一方面,地球上至大气层,下到地表层,它们的组成成分都存在微粒间的相互作用,这些作用使天上和地上的物质共同目睹了地球的沧海桑田而安然无恙,又维持着稳定的无机环境,最终孕育出枝繁叶茂的“生命树”。学生既被这些作用感动着,又领悟到“天上”的物体与“地上”的物体竟然遵循着同样的规律,天地达到了统一,自然界质朴的统一与和谐之美原来就暗藏于此。更叫人惊讶的是,氮气能够经受住人类精密设计的高强度设备的轰击,却耐不住低等固氮菌“简易工具”的侵蚀,这是怎样的“一物降一物”的游戏规则!那么堪称生物界中最高等的人类如何才能攻破嗤之以鼻的低等菌类隐藏的秘密呢?反过来,人类建筑能否仿照化学键而达到坚不可摧呢?如果能做到,那么2008年的汶川大地震就会有许多同胞幸免于难!一种崇高的使命感在学生内心油然而生。“润物细无声”的情感渗透才能让教育成为“一个灵魂唤醒另一个灵魂”的光辉事业。在此学生也再次体验了“有用的化学”,即化学世界的真实性(“化学价值观”)。
另一方面,水分子之间存在的奇妙力量正是氢键,它链接起DNA、蛋白质等重要生命物质的骨架。可以说,“没有氢键就没有生命”。它是地球的“美容师”,描绘着生命的蓝图。没有它,就没有蓝色的海洋、绿色的树木、金灿的瓜果,也没有世代繁衍、生生不息的动物世界,所有的一切生命现象都是来自氢键的造化。与化学键相比,氢键看似如此弱小,但正是这种微妙的作用方式,毅然撑起了生命体,撑起了整个生物圈,自然界竟是如此不可思议!
当学生在课后追问:“碘元素和硫元素的电负性相同,两者若形成共价键,属于极性还是非极性?”“氢和氟两种元素的电负性差大于1.7,为什么形成的化学键属于共价键?”“为什么元素组成化学键时,更普遍地以共价键的形式存在?”那么,在化学教学中,教师可以借助化学观带领学生去探知隐藏着无穷无尽奥秘的自然界,让课堂充满理性、流动思想、发展情感,最终叩响学生的心灵。
化学基本观念反映的是化学科学体系中的灵魂和精神,成功地落实化学基本观念教学不是空话连篇、空中楼阁,它是在原来教学的基础上,站得更高一层,以学科知识为载体、以学生活动为形式、以引发思维为过程,在教师引领之下,通过化学知识的理解运用,自觉地建构化学基本观念。
参考文献:
[1] 曾国琼.将化学观念的培养融入到《有机化学基础》教学中[J].中学化学教学参考,2013(10):10-14.
[2] 约翰·霍特.孩子是如何学习的[M].北京:京华出版社,2010:159.endprint
