棘白霉素治疗侵袭性真菌感染的研究进展
2015-07-07陈洁
陈洁
(南京市溧水区人民医院 药剂科,江苏 南京 211200)
棘白霉素治疗侵袭性真菌感染的研究进展
陈洁
(南京市溧水区人民医院 药剂科,江苏 南京 211200)
近年来,由真菌引起的侵袭性感染逐渐增加,已成为威胁人类健康的重要问题之一,尤其是对免疫功能受损的人群。棘白霉素是作用于真菌细胞壁的一类新的抗真菌药,具有疗效高且不良反应小的特点,其在临床上的应用越来越多。本文结合国内外研究报道,主要介绍棘白霉素药的作用方式、抗菌谱、抗药性、药代动力学和安全性,并就其在治疗侵袭性真菌感染中的应用加以简介。
侵袭性真菌感染;棘白霉素;抗真菌药;念珠菌病;曲霉病
在已知的十万多种真菌中,约有300种可以引起人类由浅表的皮肤黏膜到各个深部器官的感染[1]。近三十年里,由真菌引起的侵袭性感染率和死亡率日益增高,已经成为威胁人类健康的重要问题之一[1-2]。国内研究表明,真菌感染的发病率仅从1997~2000年就增加了3倍[3]。临床上常见的侵袭性真菌感染主要由念珠菌属(Candida)、曲霉属(Aspergillus)和隐球菌属(Cryptococcus)引起[4-5]。随着艾滋病的流行、肿瘤和糖尿病患者的增加,以及器官移植技术的普遍应用,使得越来越多的免疫系统受损人群成为了侵袭性真菌感染的高危人群[6]。因此,使用有效的药物治疗和预防真菌感染尤为重要。
20世纪90年代以前,两性霉素B是临床上治疗侵袭性真菌感染的唯一药物。它与随后出现的唑类药物和脂质两性霉素B都是作用于真菌细胞膜中的麦角固醇[7-8]。由于麦角固醇与哺乳动物的胆固醇结构相似,使得这几类药物对人体细胞也会产生一定的毒性。研究表明两性霉素B有明显的肾毒性[9]。而唑
类与其他药物之间的相互作用[10]、肝毒性[11]和天然抗唑类菌株(光滑念珠菌Candidaglabrata和克柔念珠菌Candidakrusei)[12]的存在也成为临床上治疗真菌感染中的重要问题。直到近十年来,棘白霉素药的出现为治疗侵袭性真菌感染提供了新的方案。本文主要介绍棘白霉素药的结构和作用方式、抗菌谱、抗药性、药代动力学、安全性,及其治疗侵袭性真菌病的临床疗效。
1 棘白霉素药的化学结构和作用方式
棘白霉素药是一类通过对真菌的自然产物进行化学修饰而形成的脂肽。目前临床上使用的3种药物卡泊芬净、米卡芬净和阿尼芬净分别是来源于Glarealozoyensis产生的纽莫康定B0、Coleophomaempedra产生的六胜肽FR901370和构巢曲霉(Aspergillusnidulans)产生的棘白霉素B0的半合成衍生物[13]。棘白霉素药的N-脂酰侧链的位置和构象对其抗真菌活性具有关键作用。图1显示了卡泊芬净、米卡芬净和阿尼芬净的化学结构[14]。
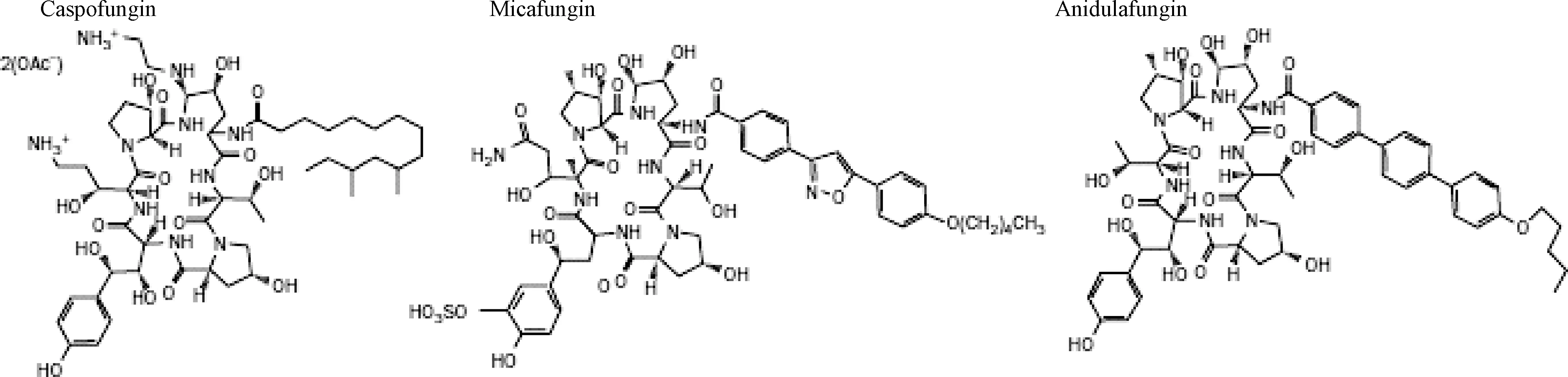
图1 棘白霉素药的化学结构Fig.1 Chemical structures of echinocandins
棘白霉素药是β-1, 3-和β-1, 6-D-葡聚糖合成酶的一种非竞争性抑制剂[15]。而β-葡聚糖是所有真菌细胞壁内层骨架结构的重要成分之一。棘白霉素药通过作用于真菌细胞的β-1, 3-葡聚糖合成酶复合体来抑制β-葡聚糖的合成,从而改变其细胞壁的结构,使其对渗透压更加敏感,最终导致细胞的裂解[13]。但是目前对于棘白霉素药在葡聚糖合成酶复合体上的具体结合部位还不清楚[14]。有研究表明,人体血清会减少棘白霉素药对葡聚糖合成酶的抑制作用[16]。与其他几类抗真菌药相比,棘白霉素的作用靶点在人体细胞中没有相似物,因此就不会对人体组织产生直接的毒性[14]。
2 抗菌谱
棘白霉素药对念珠菌属具有杀菌活性,对曲霉属有抑菌活性[14]。此外,棘白霉素对卡氏肺孢子虫(Pneumocystiscarinii)的包囊形式也有很强的活性。棘白霉素对部分真菌的不同形态具有不同的活性,如对组织胞浆菌(Histoplasmaspp.)、芽生菌(Blastomycesspp.)和球孢子菌(Coccidioidesspp.)等的菌丝形态具有较高的活性,但是对其酵母形态则显示了较高的最小抑菌浓度(MICs)。由于接合菌(zygomycetes)的细胞壁中不含有β-1, 3-葡聚糖,所以棘白霉素对其没有抗菌作用。另外,棘白霉素对镰刀菌(Fusariumspp.)、多育赛多孢(Scedosporiumpolificans)和毛孢子菌(Trichosporonspp.)也都没有明显活性[14, 17]。值得一提的是,尽管新型隐球菌(Cryptococcusneoformans)的细胞壁中也含有β-1, 3-葡聚糖,并且其β-1, 3-葡聚糖合成酶在体外对棘白霉素也非常敏感,但是棘白霉素对其却没有明显的抑菌活性[18]。
在体外试验中,棘白霉素对大部分的致病念珠菌种都显示了很强的杀菌活性,包括对唑类药具有天然抗性的克柔念珠菌和光滑念珠菌,以及对两性霉素B有抗性的葡萄牙念珠菌(Candidalusitaniae)。其中,对棘白霉素药的敏感性最强的是白念珠菌(Candidaalbicans),然后依次是光滑念珠菌、热带念珠菌(Candidatropicalis)和克柔念珠菌,而近平滑念珠菌(Candidaparapsilosis)和季也蒙念珠菌(Candidaguilliermondi)的敏感性最差[19]。Pfaller等人研究了来自全球侵袭性感染的5346株念珠菌对棘白霉素药的敏感性,结果表明卡泊芬净、米卡芬净和阿尼芬净对念珠菌种的最小抑菌浓度(MIC90)分别为0.25 μg/mL、1 μg/mL和2 μg/mL。其中除了近平滑念珠菌和季也蒙念珠菌外,卡泊芬净和阿尼芬净对其他念珠菌种的MIC值均≤2 μg/mL,而米卡芬净则对所有测试念珠菌种菌株的MIC值均≤2 μg/mL[20]。在侵袭性念珠菌感染实验模型中,用棘白霉素处理后也能明显减少脏器中念珠菌的细胞数并提高存活率。然而目前对体外实验测定的MIC值的结果是否能用来预测体内实验的结果还存在争议[17]。在一个系统念珠菌病的小鼠模型研究中,对卡泊芬净具有较高MIC值的季也蒙念珠菌和近平滑念珠菌菌株,在体内的反应剂量反而较低[21]。而在另一个报道中,卡泊芬净对感染了MIC值小于0.5 μg/mL的光滑念珠菌的小鼠是有效的,对感染了MIC值大于1 μg/mL的菌株则没有明显效果,表明体外实验与体内实验的结果有一致性[22]。
由于菌丝的生长给测定MIC值结果的判断带来很大的偏差,因此目前普遍用最低有效浓度(MEC)来描述棘白霉素对曲霉属真菌的抗菌活性。曲霉属在菌丝生长过程中,由于β-1, 3-葡聚糖聚集在菌丝的尖端,所以用MEC值来表示使菌丝尖端结构变形的最小药物浓度[23]。对526株4种曲霉属真菌的棘白霉素敏感性实验结果显示,3种棘白霉素药对超过99%的菌株的MEC值均小于0.06 μg/mL[24]。而最近的另一个报道中对8种曲霉的研究也显示了一致的结果[25]。烟曲霉(Aspergillusfumigatus)、土曲霉(Aspergillusterreus)和黄曲霉(Aspergillusflavus)对3种棘白霉素药的敏感性相当,而黑曲霉(Aspergillusniger)对卡泊芬净则更敏感[23, 26]。体外抗真菌药敏感性实验表明曲霉属真菌对阿尼芬净的敏感性最高[27]。然而当用人血清存在时,3种棘白霉素药对曲霉的抑制作用却没有明显差异[16]。由于棘白霉素药是通过静脉注射的方式给药,因此这一研究结果对临床治疗上具有重要的指导意义。多项体内试验研究结果表明,棘白霉素也可以有效减少侵袭性曲霉感染小鼠脏器中真菌细胞数,并增加感染小鼠的存活率[28-29]。尽管疗效很好,但是棘白霉素药处理小鼠后,却不能降低血清半乳甘露聚糖的水平。猜测可能是因为棘白霉素药对曲霉只有抑菌的活性[29]。
此外,念珠菌可以在一些医疗设备如内置导管上形成生物膜,而其对大多数抗真菌药都具有抗性[30]。最近的研究表明棘白霉素药可以抑制生物膜的生长,推测是因为β-1, 3-葡聚糖是生物膜中胞外基质的主要成分之一[31]。Kuhn等[32]还发现卡泊芬净和米卡芬净可以杀死生物膜中99%以上的白念珠菌和近平滑念珠菌。Rosato等[33]也报道了阿尼芬净可以有效抑制生物膜中念珠菌的生长。
3 抗药性
从2001年棘白霉素药应用到真菌感染的治疗中以来,真菌对棘白霉素药的抗性并不常见。大规模的同期监测研究也未显示临床真菌对棘白霉素药产生抗性的趋势[20]。尽管有些案例报告描述了抗性菌株导致临床治疗念珠菌病的失败,但是目前对于体外实验中真菌MIC值的增加与临床治疗的失败之间是否有相关性还存在很大争议,并且这些抗性菌株对两性霉素B和唑类药也不存在交互抗性[14, 17]。
目前研究认为真菌对棘白霉素药敏感性降低的主要原因是获得性或固有性的FKS基因突变[27, 34-35]。真菌的β-葡聚糖合成酶复合体由Fks1p(由FKS1,FKS2和FKS3基因编码)和Rho1p 2个亚基组成。而棘白霉素药的作用靶点就是FKS基因的产物[14, 17]。FKS基因突变后会导致某些位点的氨基酸改变,从而引起棘白霉素药对其基因产物的敏感性降低。在白念珠菌中,Fks1p上的2个突变的热点641-649(热点一)和1345-1346(热点二)是其对棘白霉素药抗性增加的主要原因[27]。Balashov等对85株有棘白霉素抗性的白念珠菌FKS1的基因产物研究发现,最常见的突变就是在645位的丝氨酸被脯氨酸、酪氨酸和苯丙氨酸替换[36]。在近平滑念珠菌和季也蒙念珠菌FKS1基因中天然存在的点突变也被认为是导致这2个种对棘白霉素药具有相对较低的敏感性的原因。近平滑念珠菌在660位的丙氨酸替换了脯氨酸,而季也蒙念珠菌在642位由亮氨酸取代了蛋氨酸[34, 37]。此外,其他对棘白霉素药几乎不敏感的真菌如Fusariumspp.也在Fks1的641位由酪氨酸替换了苯丙氨酸[27, 38]。除了FKS1基因突变外,FKS2基因突变也会增加菌株的抗药性,如光滑念珠菌和季也蒙念珠菌[39-40]。在烟曲霉的AfFKS1基因中人为插入一个点突变使酪氨酸替换了678位的丝氨酸后,可以使其对3种棘白霉素药的MEC值达到16 μg/mL以上[41]。
除了FKS基因突变外,体外实验中也发现念珠菌对棘白霉素药的抗性增加也与一种补偿机制以及所谓的“反常效应”(paradoxical effect)相关[27]。Walker等发现用棘白霉素处理白念珠菌后会通过蛋白激酶C(PKC)、高渗透压甘油途径、和Ca2+-磷酸酶信号途径启动一种补偿机制,增加细胞壁中几丁质的含量,从而保护细胞[42]。Stevens等首次报道了白念珠菌的“反常效应”,即在体外实验中一些棘白霉素敏感的菌株在较高浓度(supra-MICs)的棘白霉素药中能明显增加其生长的现象[43]。随后这种现象在其它念珠菌种和曲霉中都有报道[17]。研究认为“反常效应”也是通过增加细胞壁中几丁质的含量来对抗棘白霉素的作用[27]。然而,在体内实验中并未观察到“反常效应”,并且加入人血清就可以消除这种现象[17]。因此,体外实验中观察到的这种“反常效应”与临床的相关性还不确定。
对于其他对棘白霉素药有天然抗性的真菌的抗药机制还不是很清楚。有报道推测新型隐球菌和荚膜组织胞浆菌(Histoplasmacapsulatum)的抗药性与黑化作用相关[44]。
4 药代动力学
由于棘白霉素药的分子量较大,口服用药的生物利用率都不高(卡泊芬净<0.2%),因此目前临床用的3种棘白霉素药都是以静脉注射的方式给药[14]。卡泊芬净、米卡芬净和阿尼芬净具有相似的药代动力学:在静脉注射后都呈现线性的药代动力学;除了中枢神经系统和眼部之外,它们都能很好地扩散到各个组织中;扩散后,主要通过肝摄取并通过水解和N-乙酰化作用缓慢降解,因此具有较长的消除半衰期;其降解产物主要通过胆汁排出;由于棘白霉素药具有不可透析的特点,因此在治疗肾功能不全的患者时不需要增加剂量[13]。
与卡泊芬净和米卡芬净相比,阿尼芬净的药代动力学也稍有不同。阿尼芬净主要是在胆汁中进行缓慢的化学降解而非通过肝脏的代谢,并且其半衰期更长。此外,阿尼芬净的最高允许浓度相对较低,但是其分布体积相对较大[13, 17]。
目前人类对3种棘白霉素药的最大耐受剂量都还没有确定。已有研究表明,患者接受8 mg/kg的米卡芬净或者每天130 mg的阿尼芬净的给药量都没有产生明显的不良反应[45-46]。而对卡泊芬净的研究仅在猴中有报道,结果表明每天5~8 mg/kg的剂量就能使受试猴出现肝坏死的症状[14]。
5 药物相互作用及安全性
棘白霉素药具有独特的作用机制,并且与细胞色素P450和肠道或组织P-糖蛋白转运体系都没有相互作用[47]。因此棘白霉素药与其他药物之间的相互作用很少见。在3种药中卡泊芬净的药物相互作用最大,阿尼芬净最小[17]。
相对其它抗真菌药来说,棘白霉素药的副作用较小,安全性较高。目前在动物实验或者临床上观察到的副作用都不是很严重,包括发热、皮疹、头疼、低钾血症、脸红、输液反应和组胺释放[13-14, 17]。虽然在部分接受卡泊芬净治疗的患者中会出现肝功能损伤的症状,但是由于患者本身还有其他的原因可以导致这种现象,因此还不能肯定两者之间的联系[48]。
6 对侵袭性真菌病的临床疗效
临床上治疗侵袭性真菌病时,卡泊芬净的推荐用量是第1天70 mg的负荷剂量,而后每天50 mg;阿尼芬净的推荐用量是第1天200 mg的负荷剂量,接着每天100 mg的剂量;米卡芬净不需要负荷剂量,每天直接给予100 mg的剂量。卡泊芬净和米卡芬净的输液时间都要超过1 h,而阿尼芬净的输液速度则不能超过1.1 mg/min(100 mg的剂量大约需90 min)[17]。
6.1 侵袭性念珠菌病 在研究棘白霉素药用于治疗侵袭性念珠菌感染的临床实验中,采用双盲随机对照实验,对卡泊芬净、米卡芬净或阿尼芬净与两性霉素B、两性霉素B脂质体或氟康唑治疗的有效性进行评估比较,结果均显示它们的总体疗效都是相当的[49-50]。在一项比较卡泊芬净和两性霉素B的研究中[49],224个有侵袭性念珠菌感染的患者被随机分配到2组中分别2种药物的治疗。结果显示卡泊芬净组和两性霉素B组的临床有效率分别为73.4%和61.7%,2组的总体死亡率都相似,分别为34.2%和30.4%。但是卡泊芬净组的副作用明显比两性霉素B少:发热、寒颤、输液反应在两性霉素B组(32%,对应于卡泊芬净组的0.9%)中更常见,并且两性霉素B组的肾毒作用(24.8%,对应于卡泊芬净组的8.4%)和低钾血症(23.4%,对应于卡泊芬净组的9.9%)都更明显。
6.2 侵袭性曲霉病 棘白霉素药在临床上很少用于侵袭性曲霉病的初步治疗。大部分的临床研究中,棘白霉素药都是用作抢救疗法,即用于治疗对标准疗法无效或者不能耐受的侵袭性曲霉病患者[17]。Hiemenz等采用历史性队列研究的方法研究了卡泊芬净挽救疗法有效性[51]。83个接受卡泊芬净抢救疗法的患者,临床有效率为45%。在历史性队列研究组中,94.7%的患者对标准的两性霉素B或者伊曲康唑疗法不耐受或者没有效果。在排除可能的不平衡性后,卡泊芬净/标准疗法的优势率为4.1。虽然从回顾性分析中只能得到初步的结果,但是这一研究也表明了卡泊芬净的抢救疗法在侵袭性曲霉病中的有效性至少是和两性霉素B或者伊曲康唑疗法相当的。Zhang等最近研究了三唑药和棘白霉素联合治疗侵袭性曲霉病的临床有效性,结果表明在临床研究中联合疗法显示有增加成活率的的趋势[52]。
6.3 预防性治疗 接受干细胞移植、器官移植等患者是侵袭性真菌感染的高危人群,因此也有不少临床实验研究了棘白霉素药在这些人群的抗真菌预防疗法中的有效性[53]。van Burik等在一项大规模的双盲随机对照试验中,评价了米卡芬净和氟康唑作为预防患者在接受干细胞移植手术后真菌感染的有效性[54]。其中的受试患者包括了882个成人和儿童,随机接受每天1次的50 mg米卡芬净(体质量低于50 kg的患者剂量为1 mg/kg)或者400 mg 氟康唑(体质量低于50 kg的患者剂量为8 mg/kg)输液。治疗有效的定义为在整个治疗过程中没有疑似的、证实的或者可能的侵袭性真菌感染,并且在治疗后的4周内没有明确的或者可能的侵袭性真菌感染。结果显示,米卡芬净比氟康唑的有效性更高(分别为80.0%和73.5%,P<0.05),说明米卡芬净可以有效预防中性粒细胞减少症患者的侵袭性真菌感染。
7 结语
棘白霉素作为新一代的抗真菌感染药,虽然其抗真菌谱有限,但是包括了侵袭性真菌感染的2类主要致病菌:念珠菌属和曲霉属。其临床疗效与两性霉素B和唑类抗真菌药相当,但是由其引起的不良反应却较小,因此可以作为一种安全有效的替代药物。然而,棘白霉素药的价格相对较高,是目前推广其临床用药的主要限制因素。
[1] Ramana KV,Kandi S,Bharatkumar PV,et al.Invasive Fungal Infections:A Comprehensive Review[J].Am J Infect Dis Microbiol,2013,1(4):64-69.
[2] Pfaller MA,Diekema DJ.Epidemiology of invasive candidiasis:a persistent public health problem[J].Clin Microbiol Rev,2007,20(1):133-163.
[3] 郑瑞强,周韶霞,邱海波,等.综合性ICU深部真菌感染的流行病学初探[J].急诊医学,2000,9(6):392-393.
[4] Pfaller MA,Diekema DJ,Gibbs DL,et al.Results from the ARTEMIS DISK Global Antifungal Surveillance study,1997 to 2005:an 8.5-year analysis of susceptibilities of Candida species and other yeast species to fluconazole and voriconazole determined by CLSI standardized disk diffusion testing[J].J Clin Microbiol,2007,45(6):1735-1745.
[5] Enoch DA,Ludlam HA,Brown NM.Invasive fungal infections:a review of epidemiology and management options[J].J Med Microbiol,2006,55(Pt 7):809-818.
[6] Low CY,Rotstein C.Emerging fungal infections in immunocompromised patients[J].F1000 Med Rep,2011,3:14.
[7] 周巧霞,张经硕.抗真菌药物及其临床应用进展[J].抗感染药学,2008,5(1):11-15.
[8] 米佳丽,周成合,白雪.含三唑的抗微生物药物研究进展[J].中国抗生素杂志,2007,32(10):587-593.
[9] Deray G.Amphotericin B nephrotoxicity[J].J Antimicrob Chemother,2002,49 Suppl 1:37-41.
[10] Bruggemann RJ,Alffenaar JW,Blijlevens NM,et al.Clinical relevance of the pharmacokinetic interactions of azole antifungal drugs with other coadministered agents[J].Clin Infect Dis,2009,48(10):1441-1458.
[11] Zonios DI,Bennett JE.Update on azole antifungals[J].Semin Respir Crit Care Med,2008,29(2):198-210.
[12] Mulu A,Kassu A,Anagaw B,et al.Frequent detection of ‘azole’ resistant Candida species among late presenting AIDS patients in northwest Ethiopia[J].BMC Infect Dis,2013,13:82.
[13] Gregory E,Daryl DD,Peggy LC.Comparison of echinocandin antifungals[J].Ther Clin Risk Manag,2007,3(1):71-97.
[14] Denning DW.Echinocandin antifungal drugs[J].The Lancet,2003,362(9390):1142-1151.
[15] Douglas C.Fungal beta (1,3)-D-glucan synthesis[J].Med Mycol 2001,39(suppl 1):55-66.
[16] Paderu P,Garcia-Effron G,Balashov S,et al.Serum differentially alters the antifungal properties of echinocandin drugs[J].Antimicrob Agents Chemother,2007,51(6):2253-2256.
[17] Chen SC,Slavin MA,Sorrell TC.Echinocandin Antifungal Drugs in Fungal Infections[J].Drugs,2011,71(1):11-41.
[18] Maligie MA,Selitrennikoff CP.Cryptococcus neoformans resistance to echinocandins:(1,3)beta-glucan synthase activity is sensitive to echinocandins[J].Antimicrob Agents Chemother,2005,49(7):2851-2856.
[19] Pfaller MA,Boyken L,Hollis RJ,et al.In vitro susceptibilities of Candida spp.to caspofungin:four years of global surveillance[J].J Clin Microbiol,2006,44(3):760-763.
[20] Pfaller MA,Boyken L,Hollis RJ,et al.In vitro susceptibility of invasive isolates of Candida spp.to anidulafungin,caspofungin,and micafungin:six years of global surveillance[J].J Clin Microbiol,2008,46(1):150-156.
[21] Barchiesi F,Spreghini E,Tomassetti S,et al.Effects of caspofungin against Candida guilliermondii and Candida parapsilosis[J].Antimicrob Agents Chemother,2006,50(8):2719-2727.
[22] Fernandez-Silva F,Lackner M,Capilla J,et al.In Vitro Antifungal Susceptibility of Candida glabrata to Caspofungin and the Presence of FKS Mutations Correlate with Treatment Response in an Immunocompromised Murine Model of Invasive Infection[J].Antimicrob Agents Chemother,2014,58(7):3646-3649.
[23] Imhof A,Balajee SA,Marr KA.New methods to assess susceptibilities of Aspergillus isolates to caspofungin[J].J Clin Microbiol,2003,41(12):5683-5688.
[24] Pfaller MA,Boyken L,Hollis RJ,et al.In vitro susceptibility of clinical isolates of Aspergillus spp.to anidulafungin,caspofungin,and micafungin:a head-to-head comparison using the CLSI M38-A2 broth microdilution method[J].J Clin Microbiol,2009,47(10):3323-3325.
[25] Lockhart SR,Zimbeck AJ,Baddley JW,et al.In vitro echinocandin susceptibility of Aspergillus isolates from patients enrolled in the Transplant-Associated Infection Surveillance Network[J].Antimicrob Agents Chemother,2011,55(8):3944-3946.
[26] Antachopoulos C,Meletiadis J,Sein T,et al.Comparative in vitro pharmacodynamics of caspofungin,micafungin,and anidulafungin against germinated and nongerminated Aspergillus conidia[J].Antimicrob Agents Chemother,2008,52(1):321-328.
[27] Walker LA,Gow NA,Munro CA.Fungal echinocandin resistance[J].Fungal Genet Biol,2010,47(2):117-126.
[28] Bowman JC,Abruzzo GK,Flattery AM,et al.Efficacy of caspofungin against Aspergillus flavus,Aspergillus terreus,and Aspergillus nidulans[J].Antimicrob Agents Chemother,2006,50(12):4202-4205.
[29] Calvo E,Pastor FJ,Mayayo E,et al.In vitro activity and in vivo efficacy of anidulafungin in murine infections by Aspergillus flavus[J].Antimicrob Agents Chemother,2011,55(3):1290-1292.
[30] Mukherjee PK,Chandra J.Candida biofilm resistance[J].Drug Resist Updat,2004,7(4-5):301-309.
[31] Nett J,Lincoln L,Marchillo K,et al.Putative role of beta-1,3 glucans in Candida albicans biofilm resistance[J].Antimicrob Agents Chemother,2007,51(2):510-520.
[32] Kuhn DM,George T,Chandra J,et al.Antifungal susceptibility of Candida biofilms:unique efficacy of amphotericin B lipid formulations and echinocandins[J].Antimicrob Agents Chemother,2002,46(6):1173-1180.
[33] Rosato A,Piarulli M,Schiavone BP,et al.In vitro effectiveness of anidulafungin against Candida sp.biofilms[J].J Antibiot (Tokyo),2013,66(12):701-704.
[34] Perlin DS.Resistance to echinocandin-class antifungal drugs[J].Drug Resist Updat,2007,10(3):121-130.
[35] Beyda ND,Lewis RE,Garey KW.Echinocandin resistance in Candida species:mechanisms of reduced susceptibility and therapeutic approaches[J].Ann Pharmacother,2012,46(7-8):1086-1096.
[36] Balashov SV,Park S,Perlin DS.Assessing resistance to the echinocandin antifungal drug caspofungin in Candida albicans by profiling mutations in FKS1[J].Antimicrob Agents Chemother,2006,50(6):2058-2063.
[37] Garcia-Effron G,Katiyar SK,Park S,et al.A naturally occurring proline-to-alanine amino acid change in Fks1p in Candida parapsilosis,Candida orthopsilosis,and Candida metapsilosis accounts for reduced echinocandin susceptibility[J].Antimicrob Agents Chemother,2008,52(7):2305-2312.
[38] Ha YS,Covert SF,Momany M.FsFKS1,the 1,3-beta-glucan synthase from the caspofungin-resistant fungus Fusarium solani[J].Eukaryot Cell,2006,5(7):1036-1042.
[39] Katiyar S,Pfaller M,Edlind T.Candida albicans and Candida glabrata clinical isolates exhibiting reduced echinocandin susceptibility[J].Antimicrob Agents Chemother,2006,50(8):2892-2894.
[40] Garcia-Effron G,Lee S,Park S,et al.Effect of Candida glabrata FKS1 and FKS2 mutations on echinocandin sensitivity and kinetics of 1,3-beta-D-glucan synthase:implication for the existing susceptibility breakpoint[J].Antimicrob Agents Chemother,2009,53(9):3690-3699.
[41] Rocha EM,Garcia-Effron G,Park S,et al.A Ser678Pro substitution in Fks1p confers resistance to echinocandin drugs in Aspergillus fumigatus[J].Antimicrob Agents Chemother,2007,51(11):4174-4176.
[42] Walker LA,Munro CA,de Brujin I,et al.Stimulation of Chitin Synthesis Rescues Candida albicans from Echinocandins[J].PLoS Pathog,2008,4(4):e1000040.doi:10.1371/journal.ppat.1000040.
[43] Stevens DA,Ichinomiya M,Koshi Y,et al.Escape of Candida from caspofungin inhibition at concentrations above the MIC (paradoxical effect) accomplished by increased cell wall chitin; evidence for beta-1,6-glucan synthesis inhibition by caspofungin[J].Antimicrob Agents Chemother,2006,50(9):3160-3161.
[44] van Duin D,Casadevall A,Nosanchuk JD.Melanization of Cryptococcus neoformans and Histoplasma capsulatum Reduces Their Susceptibilities to Amphotericin B and Caspofungin[J].Antimicrob Agents Chemother,2002,46(11):3394-3400.
[45] Shepherd B,Thye D,White RJ,et al.Anidulafungin:a Phase 1 study to identify the maximum tolerated dose in healthy volunteers[C]. Program and abstracts of the 41st Interscience Conference on Antimicrobial Agents and Chemotherapy.Dec 16-19,2001.Chicago,USA:abstr A-36.
[46] Sirohi B,Powles R,Chopra R,et al.Assessment of maximum tolerated dose (MTD) of FK463 in cancer patients undergoing haematopoetic stem cell transplantation[C]. 41st Interscience Conference on Antimicrobial Agents and Chemotherapy.Dec 16-19,2001.Chicago,USA:abstr J-676.
[47] Kauffman CA,Carver PL.Update on echinocandin antifungals[J].Semin Respir Crit Care Med,2008,29(2):211-219.
[48] Marr KA,Hachem R,Papanicolaou G,et al.Retrospective study of the hepatic safety profile of patients concomitantly treated with caspofungin and cyclosporin A[J].Transpl Infect Dis,2004,6(3):110-116.
[49] Mora-Duarte J,Betts R,Rotstein C,et al.Comparison of Caspofungin and Amphotericin B for Invasive Candidiasis[J].N Engl J Med,2002,347(25):2020-2029.
[50] De Rosa FG,Motta I,Corcione S,et al.Anidulafungin versus fluconazole clinical focus on IDSA and ESCMID guidelines[J].Infez Med,2014,22(2):107-111.
[51] Hiemenz JW,Raad II,Maertens JA,et al.Efficacy of caspofungin as salvage therapy for invasive aspergillosis compared to standard therapy in a historical cohort[J].Eur J Clin Microbiol Infect Dis,2010,29(11):1387-1394.
[52] Zhang M,Sun WK,Wu T,et al.Efficacy of combination therapy of triazole and echinocandin in treatment of invasive aspergillosis:a systematic review of animal and human studies[J].J Thorac Dis,2014,6(2):99-108.
[53] van Burik JA.Role of new antifungal agents in prophylaxis of mycoses in high risk patients.[J].Curr Opin Infect Dis,2005,18(6):479-483.
[54] van Burik JA,Ratanatharathorn V,Stepan DE,et al.Micafungin versus fluconazole for prophylaxis against invasive fungal infections[J].Clin Infect Dis,2004,39(10):1407-1416.
(编校:王俨俨)
Application of echinocandins in invasive fungal infections
CHEN Jie
(Department of Pharmacy, Lishui District People Hospital, Nanjing 211200, China)
The frequency of invasive fungal infections has increased significantly during the past decades. It has become a major threat to human health, especially for the immunocompromised population. Echinocandins are a new class of antifungal drugs which targets the fungal cell wall. Due to their high efficacy and light adverse effects, echinocandins have been widely used in clinic. In this paper, the mechanism of action, antifungal spectrum, drug resistance, pharmacokinetics and safety of echinocandins are summarized, as well as their applications in therapy involving invasive fungal infections.
invasive fungal infections; echinocandins; antifungal drugs; candidiasis; aspergillosis
陈洁,女,学士学位,药师,研究方向:临床药学,nydlycj@163.com。
R379
A
1005-1678(2015)02-0184-05
