洋地黄对小型猪急性心肌梗死合并急性心力衰竭后左室重塑的影响
2015-07-07黄军顾晓龙董正华雷辉燕龚志华向定成
黄军,顾晓龙,董正华,雷辉燕,龚志华,向定成Δ
(1.南方医科大学 研究生学院,广东 广州 510515;2.广州军区广州总医院 心血管内科,广东 广州 510010; 3.广州军区广州总医院 超声影像科,广东 广州 510010)
洋地黄对小型猪急性心肌梗死合并急性心力衰竭后左室重塑的影响
黄军1, 2,顾晓龙2,董正华2,雷辉燕3,龚志华2,向定成2Δ
(1.南方医科大学 研究生学院,广东 广州 510515;2.广州军区广州总医院 心血管内科,广东 广州 510010; 3.广州军区广州总医院 超声影像科,广东 广州 510010)
目的 探讨洋地黄在小型猪急性心肌梗死(acute myocardial infarction,AMI)合并急性心力衰竭后左室重塑的应用价值。方法 应用球囊封堵法建立小型猪AMI合并急性心衰模型(n=8),再灌注后随机分为洋地黄组(n=4)和对照组(n=4),分别在建模后给予西地兰(0.025 mg/kg)和单纯生理盐水静注,次日洋地黄组加用地高辛0.125 mg/d治疗。超声测量2组左室容积、不同区域室壁厚度及室壁增厚率的变化,分别于AMI后7 d和1 m后处死,取心脏测量梗死面积。结果 造模后2组小型猪左室容积均增大、室壁变薄,与造模前比较差异均有统计学意义(P<0.05,P<0.01);洋地黄组用药后1、2、3 h左室容积缩小、室壁呈增厚趋势,但至7 d后2组左室容积明显增大,梗死区室壁明显变薄、局部增厚率明显降低,与用药后1、2、3 h比较差异有统计学意义(P<0.05,P<0.01);而交界区及正常区代偿性增厚,但室壁增厚率各时间点无明显差异。2组小型猪梗死面积比较差异无统计学意义。结论 AMI合并心衰动物模型上早期使用洋地黄可以显著改善血液动力学效应,但对梗死面积和近期左室重塑无明显影响。
洋地黄;急性心肌梗死;急性心力衰竭;左室重塑
随着对急性心肌梗死(acute myocardial infarction,AMI)患者行早期经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI),其死亡率有所降低,但AMI后心力衰竭的发生率仍高,且预后差[1]。AMI后左室重塑在心力衰竭的发生及发展中起着关键作用,其中神经激素的过度激活是左室重塑的重要机制[2]。洋地黄是传统的抗心力衰竭药物,大量资料证实其对神经激素方面起到有益作用[3]。但在早期AMI未实施再灌注的时代,有研究表明洋地黄对AMI后心室重塑有不利影响[4]。本文旨在通过构建AMI合并心力衰竭并再灌注小型猪模型,观察洋地黄对左室重塑的影响。
1 材料与方法
1.1 实验对象 五指山小型猪(动物许可证号4407700010),体质量(16.94±1.75)kg,雌雄不限,由广州军区广州总医院动物实验中心提供。所有动物饲养及实验过程均按照动物实验的3R原则进行。
1.2 方法
1.2.1 术前准备:猪禁食8 h,肌肉注射氯胺酮200 mg,速眠新0.5 mL,咪达唑仑5 mg诱导麻醉,持续泵入氯胺酮+咪达唑仑维持麻醉。采用MP50-肢体及V1导联心电监护(飞利浦公司),心电图机定时记录心电图。术前予青霉素240万U加入0.9%NaCl 100 mL中静滴预防感染。
1.2.2 急性心肌梗死合并急性左心衰模型建立及分组
①动物准备:小型猪麻醉后固定,常规脱毛、消毒、铺巾,外科分离暴露右侧股动、静脉,直视下穿刺股、静动脉分别植入6F和7F鞘管,经静脉鞘管注入肝素100 U/kg,手术过程中每隔1 h追加1000 U。
② 血液动力学测定:经股静脉鞘管送入Swan-Ganz-导管(爱德华生命科学公司),测量术前肺动脉楔嵌压(pulmonary capillary wedge pressure,PCWP),同步完成超声心动图测量。
③ AMI合并心力衰竭模型制作:以重新塑形后的5FJL3.5-指引导管(美敦力公司)行左冠状动脉造影,将3.0 mm×15 mm-冠状动脉扩张球囊导管(美敦力公司)送至前降支(left anterior descending,LAD)近中段,以4~6个大气压充盈球囊,封堵30 s行缺血预适应,共预适应5次,每次间隔5 min,然后持续封堵120 min,连续监测PCWP变化。模型建立成功标准:胸前导联心电图ST段持续抬高(0.2 mV,PCWP>18 mmHg)。
④ 分组及给药:模型建立成功后随机分为洋地黄组及对照组,洋地黄组予以西地兰(上海旭东海普药业,H31021178 )0.025 mg/kg+0.9%氯化钠20 mL静脉注射20 min;对照组予以0.9%氯化钠20 mL静脉注射20 min。术后肌肉注射青霉素240万U/天,连续2 d。
⑤ 合并用药:2组均于术后服用阿司匹林0.1 g、氯吡格雷75 mg、辛伐他汀20 mg、依那普利5 mg 1次/天治疗,其中洋地黄组加用地高辛(赛诺菲安万特杭州,H33021738)0.125 mg/d。
1.2.3 超声心动图测定结果:由专人采用IE33 S/N型-彩色超声诊断仪(飞利浦公司),于术前、造模后、用药后1、2、3、24 h、7 d及1 m时使用Simpson法测量左室舒张末期容积(left ventricular enddiastolic volume,LVEDV)、左室收缩末期容积(left ventricular endsystolic volume,LVESV),使用胸骨旁短轴切面测量左室正常区(WNT)、交界区(WBT)及梗死区(WIT)室壁厚度的变化。并计算分析7 d及1 m 3个区局部室壁增厚率(%),即为[(室壁收缩期厚度-舒张期厚度)/舒张期厚度]×100%。
1.2.4 组织形态学观察:2组小型猪中各有2只分别喂养7 d和1 m后快速静注10%KCl 10 mL处死,解剖并取出心脏。从左室基底部向心尖部连续切成5~10 mm的心肌片,用相机拍照,使用Image J 1.34图像分析系统测量梗死面积。
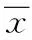
2 结果
2.1 小型猪一般情况 共有11只小型猪用于制作AMI合并心衰模型,其中3只在建模过程中死亡,1只死于穿刺后大出血,1只死于室颤,1只死于麻醉意外。其余8只成功建立AMI合并心衰模型,洋地黄组和对照组各4只。2组均在球囊封堵30 min左右达到心衰标准,PCWP分别为(23.75±4.19)mmHg和(22.50±5.75)mmHg,2者比较差异无统计学意义。
2.2 超声心动图检查
2.2.1 2组小型猪AMI后心脏超声指标的变化:结果显示:与造模前相比,2组LVEDV及LVESV均在造模成功后明显增大(P<0.05,P<0.01),其中对照组左室24 h内维持在扩大状态,而洋地黄组在用药后1、2、3 h左室呈现明显的缩小趋势;至7 d及1 m时2组均明显增大(P<0.05,P<0.01),上述各时间点的组间差异无统计学意义。与造模前相比,2组WIT在造模后均明显下降(P<0.05,P<0.01);洋地黄组用药后2、3 h时呈上升趋势,而对照组在用药后1、2 h仍呈下降趋势;至7 d及1 m时2组均明显下降。2组WBT在造模后明显降低(P<0.05,P<0.01);至7 d及1 m时2组逐渐增加。2组WNT造模后均明显下降(P<0.05,P<0.01);洋地黄组用药后24 h内呈明显上升趋势,而对照组上升幅度低于洋地黄组;至7 d与1 m时2组基本上升至正常。见表1。
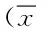


组别时间LVEDV(mL)LVESV(mL)WIT(mm)WBT(mm)WNT(mm)对照组术前造模后用药后1h2h3h24h7d1m19.2±5.96.2±0.94.9±0.45.2±0.25.2±0.225.0±6.311.5±3.3**4.1±0.4**4.5±0.5*4.2±0.2**23.3±4.210.2±2.2*4.0±0.5**4.5±0.6*4.4±0.5*23.3±3.611.2±1.5*3.9±0.2**4.5±0.4*4.3±0.7*24.0±5.910.2±2.2*4.1±0.5*4.5±0.4*4.6±0.422.5±3.111.0±0.8*4.1±0.6*4.5±0.3*5.0±0.630.7±2.9*15.0±2.4**3.8±0.3**4.6±0.3*5.3±0.338.0±1.4**20.5±7.8**3.6±0.0**4.9±0.25.1±0.6洋地黄组术前造模后用药后1h2h3h24h7d1m18.5±5.56.5±2.94.9±0.65.1±0.55.2±0.423.7±5.813.2±4.1*4.1±0.5*4.4±0.5*4.3±0.3**19.7±3.49.7±3.64.0±0.5*4.7±0.34.6±0.2**18.5±6.89.2±4.64.3±0.74.6±0.24.6±0.3**20.0±4.79.2±3.64.4±0.44.6±0.24.7±0.2**23.6±5.711.3±2.94.2±0.54.5±0.4*4.9±0.228.0±7.0*15.3±5.8*3.8±0.4*4.6±0.15.1±0.240.0±1.4**22.0±2.8*3.6±0.2**4.9±0.15.0±0.2
用药时间为球囊封堵后2 h,Sacculus block after 2 h;*P<0.05,**P<0.01,与术前相比,compared with preoperative
2.2 2组小型猪AMI后局部室壁增厚率比较 结果显示:2组梗死区室壁增厚率较交界区及正常区明显减低(P<0.01);洋地黄组的室壁增厚率与对照组比较差异无统计学意义。见表2。

表2 2组小型猪7d及1m时3个区局部室壁增厚率比较(%)Tab.2 Comparison of local wall thickening of three region in two groups(%)
2.3 2组梗死面积比较 2组小型猪AMI后7 d及1 m梗死面积洋地黄组均略小于对照组,但组间比较差异均无统计学意义,见表3;2组小型猪心肌梗死后组织形态学改变见图1。小型猪心肌梗死后梗死区心肌显著变白,变薄;心脏正常区心肌红润。白色是坏死区;红色是正常区。

表3 小型猪AMI后7d及1m梗死面积比较(%)Tab.3 Comparison of infarct size of pigs with AMI after 7 d and 1 m(%)
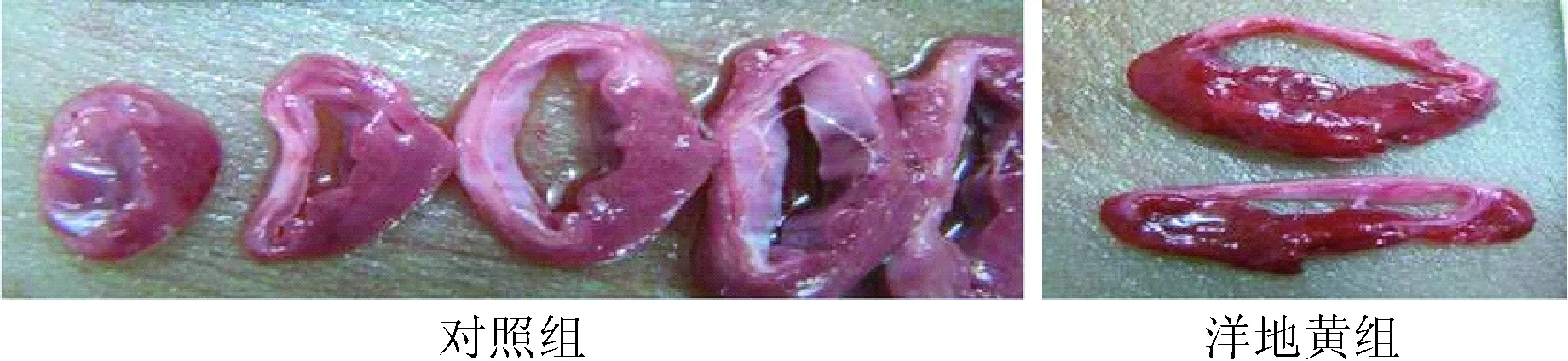
图1 2组小型猪心肌梗死后组织形态学变化Fig.1 Changes of infarct size of pigs with AMI
3 讨论
3.1 洋地黄的应用机制 洋地黄作为临床上应用最为广泛的一种强心药物,在治疗AMI、心律失常等心脏疾病方面具有显著疗效。临床上常用的洋地黄甙类主要包括:地高辛、西地兰、洋地黄毒甙和哇巴因,但对其确切作用机制尚未有统一的临床标准。目前,临床上普遍认为洋地黄主要是通过抑制心肌细胞膜上Na+-K+-ATP酶的活性,进而抑制心肌细胞将Na+泵出到细胞外,引起心肌细胞内Na+浓度升高,促使心肌细胞内过多的Na+通过细胞膜上的Na+-Ca2+交换机制而被泵出细胞外,同时将细胞外的Ca2+摄入心肌细胞内,进而提高心肌细胞内可利用Ca2+的浓度,最终导致心肌细胞的兴奋—收缩偶联作用增强,表现为心肌收缩力增加,达到强化机体心肌功能的作用。
3.2 洋地黄对心肌梗死面积的影响 传统的观念认为,心肌梗死后早期使用洋地黄可以增加氧耗量而导致梗死面积增加,早期动物试验亦证实了早期使用洋地黄可增加梗死面积[5],但本研究结果显示,早期使用洋地黄并未增加心肌梗死面积。尽管由于样本量的限制,本研究结果的组间差异没有达到统计学意义,但其差异的趋势已非常明确,提示在心肌梗死后的早期使用洋地黄在改善血液动力学结果的同时,并没有显示出不利于左室重塑的效应。这与早期文献中的结论不一致,可能与当时采用的非再灌注模型有关,本文是在心肌梗死后实施的再灌注,表明在再灌注时代应该重新评价洋地黄的作用。
3.3 洋地黄对左室重塑的影响 AMI后早期心室重塑主要表现为梗死区膨张、室壁变薄、室腔扩大等改变[6-7]。Korup等[8]研究发现AMI患者3 h内即出现左室膨展。国内也有研究表明犬心梗后1 h LVEDV及LVESV明显增大[9]。本研究与上述观点一致,表明小型猪AMI早期即出现左室容积增大,室壁变薄。本研究通过在AMI合并心力衰竭并再灌注的小型猪模型上应用洋地黄后早期左室容积呈下降趋势,同时左室3个区室壁厚度均有所增厚,而对照组变化不明显,提示在AMI合并心力衰竭时使用洋地黄可以显著增强心肌收缩力,缩小左室容积;由于西地兰为一次性给药,至24 h时疗效基本消失,因此至24 h 2组左室容积及厚度基本一致;至7 d及1 m时2组容积均明显增大,梗死区室壁明显变薄,而交界区及正常区室壁增厚。上述结果提示在AMI后早期使用洋地黄在改善血液动力学的同时,可能具有抑制左室腔扩大、室壁变薄的效应,但后期该效应逐步消失。然而Sabbah HN等[10]研究表明在急性心梗合并心功能不全的犬模型长期服用地高辛可以维持心功能,但并不能防止心室进行性增大。由于该研究为心梗3 w后心衰开始用药,并未对洋地黄在AMI早期的影响进行研究,与本研究洋地黄后期效应基本一致。亦有传统观念认为,早期使用洋地黄不利于左室的重塑[11-12],本研究结果显示,在实施再灌注治疗后的心肌梗死合并心力衰竭时,洋地黄的使用至少未显示出不利于左室重塑的趋势,提示短期小剂量实施洋地黄再灌注治疗,具有较为良好的强心作用,可使机体心肌收缩能力加强,有利于疾病的治疗和改善机体心功能。从理论上分析,小剂量洋地黄具有内抑迷走神经作用[13-14],完全可以在心肌梗死后早期神经内分泌高度激活状态下发挥有益的效应,进而改善机体血液流动力学和心肌功能[15]。本研究结果印证了上述假设,但尚需进一步扩大样本量加以证实。
[1] Antoni ML,Hoogslag GE,Boden H,et al.Cardiovascular mortality and heart failure risk score for patients after ST-segment elevation acute myocardial infarction treated with primary percutaneous coronary intervention (Data from the Leiden MISSION Infarct Registry)[J].Am J Cardiol,2012,109(2):187-194.
[2] Opie LH,Commerford PJ,Gersh BJ,et al.Controversies in ventricular remodelling[J].Lancet,2006,367(9507):356-367.
[3] Gheorghiade M,van Veldhuisen DJ,Colucci WS.Contemporary use of digoxin in the management of cardiovascular disorders[J].Circulation,2006,113(21):2556-2564.
[4] Lynch JJ,Lucchesi BR.Effect of digoxin on the extent of injury and the severity of arrhythmias during acute myocardial ischemia and infarction in the dog[J].J Cardiovasc Pharmacol,1988,11(2):193-203.
[5] Maroko PR,Kjekshus JK,Sobel BE,et al.Factors influencing infarct size following experimental coronary artery occlusions[J].Circulation,1971,43(1):67-82.
[6] Sutton MG,Sharpe N.Left ventricular remodeling after myocardial infarction: pathophysiology and therapy[J].Circulation,2000,101(25):2981-2988.
[7] 张和细.心房颤动洋地黄中毒同时合并脾梗死1例[J].临床心血管病杂志,2014,30(5):458-459.
[8] Korup E,Dalsgaard D,Nyvad O,et al.Comparison of degrees of left ventricular dilation within three hours and up to six days after onset of first acute myocardial infarction[J].Am J Cardiol,1997,80(4):449-453.
[9] 王健,康春松,郑艳萍,等.超声心动图评价犬急性心肌梗死早期左心室重构的实验研究[J].中华医学超声杂志(电子版),2008,5(2):229-234.
[10] Sabbah HN,Shimoyama H,Kono T,et al.Effects of long-term monotherapy with enalapril,metoprolol,and digoxin on the progression of left ventricular dysfunction and dilation in dogs with reduced ejection fraction[J].Circulation,1994,89(6):2852-2859.
[11] Guadalajara-Boo JF.Is digitalis currently useful for heart failure treatment?[J].Arch Cardiol Mex,2014,84(4):310-313.
[12] Leshina LG,Bulko OV.Plants regeneration from genetically transformed root and callus cultures of periwinkle Vinca minor L.and foxglove purple Digitalis purpurea L[J].Tsitol Genet,2014,48(5):36-42.
[13] Gheorghiade M,Ferguson D.Digoxin.A neurohormonal modulator in heart failure?[J].Circulation,1991,84(5):2181-2186.
[14] Weigand KM1,Laursen M,Swarts HG,et al.Na(+),K(+)-ATPase isoform selectivity for digitalis-like compounds is determined by two amino acids in the first extracellular loop[J].Chem Res Toxicol,2014,27(12):2082-2092.
[15] Gonano LA,Petroff MV.Subcellular mechanisms underlying digitalis-induced arrhythmias: role of calcium/calmodulin-dependent kinase II (CaMKII) in the transition from an inotropic to an arrhythmogenic effect[J].Heart Lung Circ,2014,23(12):1118-1124.
(编校:吴茜)
Effect of digitalis on left ventricular remodeling after microswine with acute heart failue after acute myocardial infarction
HUANG Jun1,2,GU Xiao-long2,DONG Zheng-hua2,LEI Hui-yan3,GONG Zhi-hua2,XIANG Ding-cheng2
(1.Graduate School Southern Medical University, Guangzhou 510515, China; 2.Department of Cardiology, Guangzhou General Hospital of Guangzhou Military, Guangzhou 510010, China; 3.Department of Ultrasonography, Guangzhou General Hospital of Guangzhou Military, Guangzhou 510010, China)
ObjectiveTo explore application value of digitalis on left ventricular remodeling in microswine with acute heart failure after acute myocardial infarction (AMI).MethodsAnimal models of acute heart failure after AMI were developed by inflating a balloon in left anterior descending artery in 8 microswines.And those animals were randomly divided into digitalis group(n=4) and control group(n=4) after reperfusion by deflating the balloon.A dose of Lanatoside C(0.025 mg/kg) or the equivalent volume of saline was intravenously injected after model establishment in digitalis group and control group respectively, followed by digoxin 0.125 mg/d in digitalis group.The changes of left ventricular volume, the thickness of ventricular walls and the thickening rate of ventricular walls were measured in different stages after AMI.The hearts of the animals were harvested to measure the infarction area after executed respectively at 7th day and 1 month.ResultsThe left ventricular volumes were enlarged and the thickness of ventricular wall in the infarction area were decreased in two groups after AMI,the difference with before AMI was statistically significant (P<0.05,P<0.01).The left ventricular volume and the thickness of ventricular wall were reversed at 1, 2, 3 hours after intravenous Lanatoside C in digitalis group, but there were no changes in the control group.However, the above different tendency between two groups were disappeared and the ventricular volume went enlargement when the infarction wall went thinning at the 7th day and 1 month.The thickening rate of infarction wall was remarkably decreased after AMI (P<0.05) , while there was no significant changes in the border area and the non-infarction area.The infarction area was not significantly different between the two groups. ConclusionDigitalis may significantly improve the hemodynamic disorders, but don’t show any impacts on the infarct size and the left ventricular remodeling in the microswine model.
digitalis; acute myocardial infarction; acute heart failure; left ventricular remodeling
黄军,男,硕士在读,研究方向:冠心病、急性心肌梗死后心室重塑,E-mail:huangjunsin@foxmail.com ;向定成,通讯作者,男,主任医师、教授 、博士研究生导师,研究方向:冠脉及主动脉疾病,E-mail:dingxiangcheng1212@163.com 。
R541.6
A
1005-1678(2015)02-0021-04
