利用 ITS技术研究苹果砧木遗传多样性
2015-07-07罗思谦王彦钱关泽
罗思谦,王彦,钱关泽
(聊城大学 生命科学学院,山东 聊城 252300)
利用 ITS技术研究苹果砧木遗传多样性
罗思谦,王彦,钱关泽Δ
(聊城大学 生命科学学院,山东 聊城 252300)
目的 探索苹果属植物野生砧木间的亲缘关系与杂交亲和性间的联系。 方法 对24个来自中国不同地域的野生苹果属砧木样品使用nrDNA ITS序列分析,并结合对苹果属植物砧木杂交亲和性的研究。 结果 本研究成功测出24个样本的序列并做出遗传距离矩阵图与遗传树状图。结论 苹果属植物野生砧木间的亲缘关系和砧木杂交亲和性之间有一定的联系。
砧木; ITS;亲缘关系
砧木(rootstock)指进行植物嫁接时接穗以下的植株,整植的果树、树体的根段枝段都可以作为砧木。砧木的作用在于固定和支撑接穗,与接穗愈合后形成植株生长、结果。优良的砧木与接穗嫁接亲和性好,生长旺盛,同时具有抗旱、寒、盐碱等效果。是现代农业尤其是果树业发展不可或缺的重要工具之一。中国苹果嫁接技术历史悠久,从古代的“以柰接柰”到现在各种营养型砧木、矮化型砧木、抗性砧木的大范围的普及应用已经有1500多年的历史。但中国野生苹果砧木繁多,同时由于种间杂交、地理隔离、无融合生殖等多方面的原因由苹果属植物的遗传多样性非常复杂,形态性状变异多端,形成了大量的种间过渡类群和地理类型。这些类群或类型有的与亲本相似而被归于亲本中,有的与亲本形态差异较大,因而被作为独立的种对待。虽然有些个体形态上几乎一样,但这些包括亲本和杂交后代的大量类型间的遗传信息并不一致,因此在进行苹果嫁接时表现出不同的亲和性。如杨进[1]和韩振海[2]都报道山荆子与苹果亲和力强,乔化,早果高产,但有“小脚”现象;同为湖北海棠的变种,平邑甜茶嫁接苹果亲和力强,乔化,产量中等,而产于泰山的泰山海棠亲和力较差,但具有一定矮化效应。杨进发现山荆子不抗盐,在碱性土中易发生黄叶病;而于敬等[3]报告山西房山山荆子却比较抗盐有些地理类型嫁接苹果生长势超过山荆子[4]。但也有些嫁接亲和力不强;其他种如花叶海棠和陇东海棠[5]及滇池海棠等嫁接苹果均有一定亲和性,多矮化,但也均出现“大脚”或“小脚”现象。
ITS(internal transcribed spacer):内转录间隔区。植物细胞中对RNA进行编码的基因组是一个高度重复的串联序列,其中ITS位于nrDNA非编码转录区18S和26S之间。其特点在于通过不等交换和基因转换经历快速的协同进化使重复单位在基因组内变得一致,同时协同进化对来自不同亲本种类的重复单位不起作用[6],所以ITS序列所有选择压力小,中度保守型。其适合属间[7]、属下和种间的系统分类学研究[8-9]。迄今为止,已成功应用于很多分类群的系统学研究中,被普遍认为适合确定植物属间及属内的系统发生关系[10-12]。同时在苹果属内成功的案例也很多如利用ITS冯婷婷等[13]得出变叶海棠是由陇东海棠与花叶海棠杂交而来。唐建民[14]为进一步研究变叶海棠的杂交起源利用ITS序列对变叶海棠进行了测序分析并提供了分子依据。
1 材料与方法
1.1 实验材料 实验所选材料均由全国采集而来,涉及山东,云南,四川,湖北,湖南,江苏,浙江,广东等多个省份。材料均选择生长旺盛且无病虫害的植株进行采集,主要选择嫩叶进行采集,放入密封袋编号并用硅胶干燥保存。

表1 实验材料来源Tab.1 Source of materials
1.2 样本基因组DNA的提取 将干燥好的样本叶片置于研钵中加入石英砂研磨成为粉末状,将其置于EP离心管中。将经过预冷的CTAB free缓冲提取液800 μL置于EP离心管中,上下激烈震荡使之混匀后水浴10 min,为首次提取多酚等杂质,3000 r/min离心5 min,将上清液弃除。将β-巯基乙醇提前加入到CTAB裂解液中,密封65 ℃预热,将预热好的混合CTAB裂解液迅速加入,并65 ℃水浴2 h,期间10 min上下颠覆震动一次,离心5000 r/min、10 min并取上清液。加入等体积的氯仿异戊醇,冷却至室温后,上下剧烈震荡使之混匀,静置10 min,离心10 min,将上层水相移至新EP离心管中。并重复一次。加入2/3体积异丙醇与1/4体积的5 mol/L的NaCl溶液,颠倒混匀后置于-20 ℃冰箱中5 min,12000 r/min 10 min,沉淀DNA,70%乙醇洗涤3次,置于无菌操作台晾干,加入200 μL纯水或 1×TE缓冲液及RNA酶1 μL,4 ℃过夜保存。
1.3 将提取出来的基因组DNA进行ITS分子标记 参考White[15]对苹果属ITS序列扩增方法及测序扩增引物的设计,使用引物为IT4 5’-TCCTCCGCTTATTGATATGC-3’IT5 5’-GGAAGTAAAAGTCGTAACAAGG-3’对其进行ITS-PCR扩增。使用50 μL体系进行扩增。取Template 1 μL,Forward Primer 2 μL,Reverse Primer 2 μL,Reverse Primer 1 μL, 2×Taq PCR MasterMix混合物1 μL,再加RNase-free Water补至50 μL。
最终最适宜的扩增程序为94 ℃预变性2 min,94 ℃变性30 s,48.5 ℃退火30 s,72 ℃延伸30 s,30个循环,72 ℃延伸2 min。扩增完成之后进行ITS-PCR产物的检测,经过琼脂糖凝胶电泳进行检测。
2 结果
2.1 ITS-PCR产物纯化及测序 使用DNA回收试剂盒(购于Genstar公司)回收及纯化目的片段的PCR产物,步骤如下:将琼脂糖凝胶中的目的DNA片段(尽量将目的所需片段全部切下以保持回收效率),放入干净的EP离心管中,标号并 称取重量。向切下的凝胶块中加入3倍体积的Buffer PG,1 mg可视为1 μL。50 ℃水浴15 min,水浴期间为保胶块的充分溶解需不断的震荡离心管。如有未溶解彻底的凝胶块,可补加Buffer PG并继续水浴几分钟直至完全溶解。之后检测pH值,如pH大于7.5,为使其pH值降到5~7可向其中加入3M醋酸钠。将收集管放入胶回收的吸附柱内,并加入200 μL Buffer PS然后放入离心机12000 r/min 2 min,将收集管中的废液弃掉。将上面第3步中所得到的溶液加入到吸附柱中,将收集管放置吸附柱中,室温下静置 5 min, 12000 r/min 2 min,弃废液。加入5000 μL Buffer PG到吸附管中,12000 r/min 1 min,弃废液,将吸附柱放入到收集管中。加入事先已经加入无水乙醇的650 μL Buffer PW与吸附柱中,12000 r/min离心1 min,弃废液,将吸附柱放回收集管中。12000 r/min离心2 min,弃废液,室温下放置以至彻底晾干。此步骤主要为去除吸附柱中的残留乙醇,如乙醇有残留将会影响后续的酶促反应。准备新的EP离心管,将吸附柱放入并标号,向吸附柱中的吸附膜种间位置悬空滴加pH值为8.5的50 μL Buffer EB,静置于室温环境下3 min后12000 r/min离心2 min,收集目的片段溶液并与-20 ℃进行保存。为保证回收质量最后得到的洗脱液体积不得低于30 μL。将纯化好的PCR产物送至生工公司上海测序部进行DNA测序(见图1、图2)。

图1 部分苹果属植物总DNA琼脂糖电泳1.湖北海棠;2.陇东海棠;3.河南海棠;4.三叶海棠;5.滇池海棠;6.垂丝海棠;7.毛山荆子;8.尖嘴林檎;9.山荆子;10.稻城海棠;11.日瓦海棠;12.丽江山荆子;13.西府海棠;14.平邑甜茶;15.海棠花;16.锡金海棠;17.乔佬斯基海棠;18.BH40;19.B118Fig.1 Total DNA of some samples of Malus on agarose gel1.Malus hupehensis; 2.Malus kansuensis; 3.Henan begonia; 4.Clover begonia; 5.Dianchi Lake begonia; 6.Malus halliana; 7.Moriyama Ko; 8.Malus melliana; 9.M.baccata; 10.Daocheng begonia; 11.Geneva begonia; 12.M.rockii sub; 13.Malus micromalus; 14.Malus hupehensis; 15.Begonia flower; 16.Sikkim crabapple; 17.Joe guy Si Ji begonia; 18.BH40; 19.B118
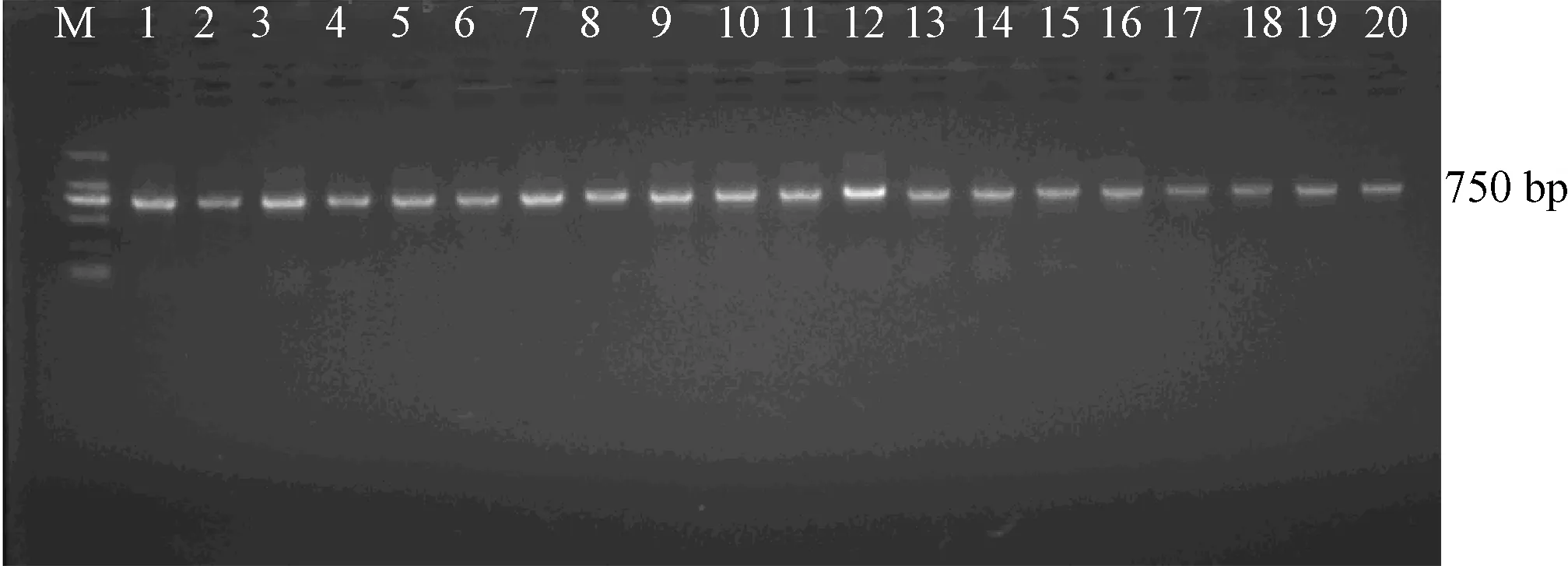
图2 部分样品ITS-PCR产物琼脂糖电泳检测图M=marker;1.湖北海棠;2.陇东海棠;3.河南海棠;4.三叶海棠;5.滇池海棠;6.垂丝海棠;7.毛山荆子;8.尖嘴林檎;9.山荆子;10.稻城海棠;11.日瓦海棠;12.丽江山荆子;13.西府海棠;14.平邑甜茶;15.海棠花;16.锡金海棠;17.乔佬斯基海棠;18.BH40;19.B118;20.美1Fig.2 Agarose gel electrophoresis map of PCR products amplified of ITSM=marker;1.Malus hupehensis; 2.Malus kansuensis; 3.Henan begonia; 4.Clover begonia; 5.Dianchi Lake begonia; 6.Malus halliana; 7.Moriyama Ko; 8.Malus melliana; 9.M.baccata; 10.Daocheng begonia; 11.Geneva begonia; 12.M.rockii sub; 13.Malus micromalus; 14.Malus hupehensis; 15.Begonia flower; 16.Sikkim crabapple; 17.Joe guy Si Ji begonia; 18.BH40; 19.B118;20.American 1
2.2 测序结果的处理 得到测序结果之后,通过Chromas软件查看测序序列的质量和碱基峰图中峰形的变化,如果峰图中出现套峰过多,为保证测序结果的可靠性则应该重新进行测序。对于机读度数不准或者未正常读数应该根据碱基峰图中的峰形给予纠正。采用ContigExpress软件对反向测序及双向测通的序列进行拼接,然后使用ClustalX软件进行调整和序列对比。利用MAGE5首先计算各个ITS序列中ITS1、5.8S以及ITS2的长度和其分别的GC含量,见表2。同时检测种子植物的特有保守基因序列5’-GAATTGCAGAATC-3’是否存在于5.8S中。见图3,图4。
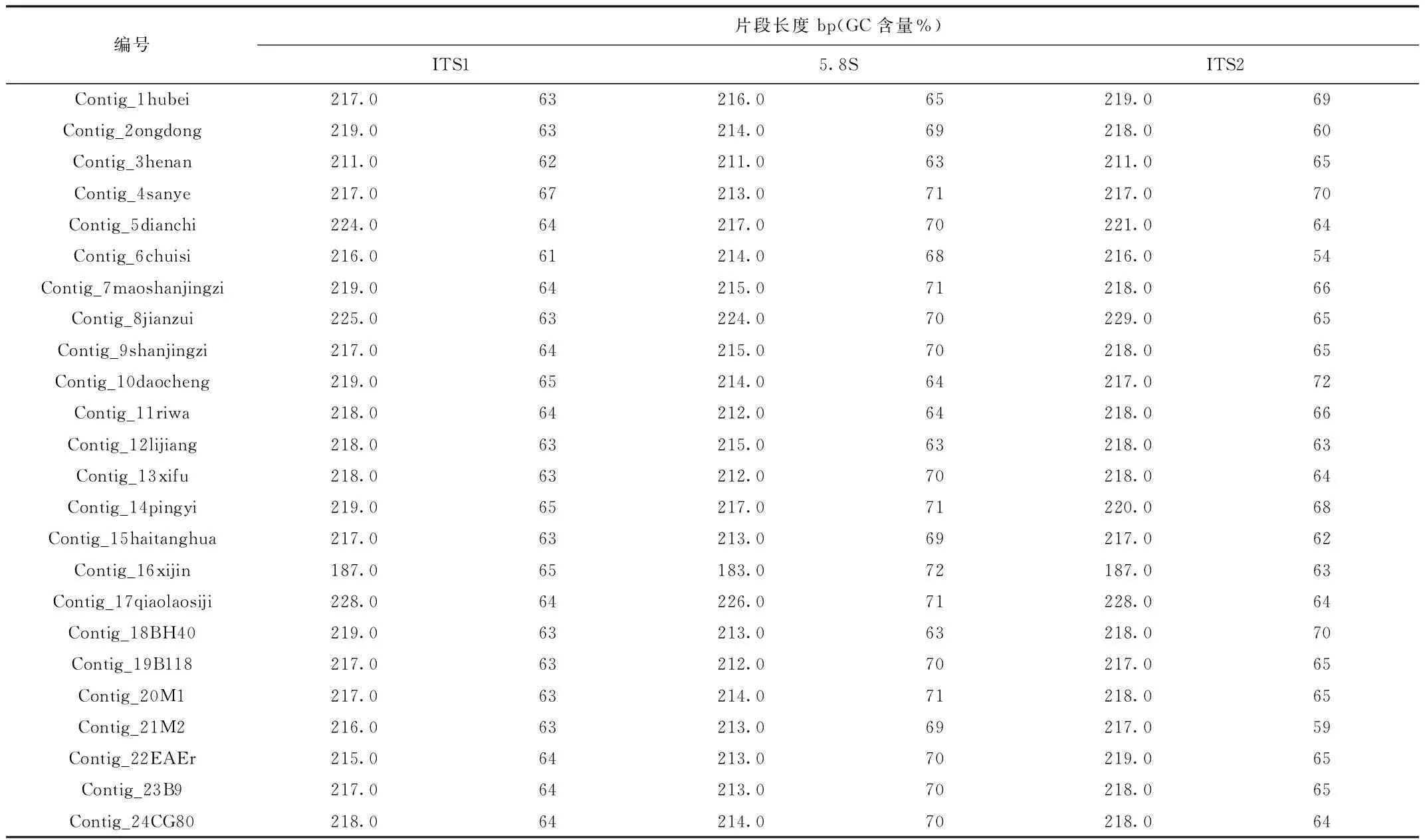
表2 苹果属中ITS1、5.8S和ITS2特征Tab.2 The characteristics of ITS1,5.8S and ITS2 in Malus
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
[1]
[2]1.22
[3]0.21 1.21
[4]1.23 0.10 1.22
[5]1.39 0.26 1.40 0.31
[6]1.25 0.05 1.23 0.06 0.28
[7]1.19 0.04 1.18 0.06 0.26 0.01
逆变器工作在第i状态时,施加在定子绕组上的电压空间矢量ui(SaSbSc)所处位置及指向总是与F的位置及指向一致的。但因F按六步转动,而(SaSbSc)组合的开关状态还有(0 0 0)和(1 1 1)二种,对电机本体来说,这二种开关状态下电枢三相对称短路,气隙合成磁动势趋近于零,将电压空间矢量u0(0 0 0)和u7(1 1 1)称为零矢量。
[8]0.33 1.28 0.28 1.29 1.47 1.27 1.23
[9]1.22 0.04 1.21 0.08 0.27 0.02 0.01 1.25
[10]1.26 0.06 1.28 0.11 0.30 0.07 0.05 1.34 0.06
[11]1.23 0.06 1.26 0.11 0.31 0.07 0.06 1.23 0.06 0.07
[12]1.19 0.04 1.18 0.06 0.26 0.01 0.00 1.23 0.01 0.05 0.06
[13]1.20 0.04 1.20 0.08 0.27 0.03 0.02 1.25 0.03 0.05 0.04 0.02
[14]1.23 0.10 1.27 0.13 0.32 0.09 0.08 1.36 0.09 0.11 0.10 0.08 0.09
[16]1.50 0.68 1.57 0.74 0.71 0.67 0.68 1.58 0.68 0.72 0.70 0.68 0.67 0.74 0.68
[17]0.26 1.19 0.14 1.19 1.43 1.19 1.14 0.29 1.17 1.27 1.20 1.14 1.17 1.31 1.15 1.52
[18]1.27 0.13 1.30 0.19 0.36 0.16 0.15 1.33 0.15 0.16 0.15 0.15 0.14 0.17 0.13 0.78 1.22
[19]1.21 0.04 1.20 0.08 0.28 0.04 0.03 1.25 0.04 0.06 0.04 0.03 0.01 0.10 0.02 0.70 1.18 0.15
[20]1.21 0.03 1.20 0.08 0.27 0.04 0.03 1.25 0.03 0.05 0.04 0.03 0.01 0.09 0.01 0.69 1.18 0.15 0.01
[21]1.21 0.03 1.20 0.08 0.27 0.04 0.03 1.25 0.03 0.05 0.04 0.03 0.01 0.09 0.01 0.69 1.18 0.15 0.01 0.00
[22]1.12 0.10 1.17 0.13 0.29 0.09 0.08 1.21 0.09 0.11 0.09 0.08 0.08 0.10 0.08 0.75 1.12 0.16 0.09 0.08 0.08
[23]1.21 0.03 1.20 0.09 0.28 0.04 0.03 1.25 0.03 0.05 0.04 0.03 0.01 0.09 0.01 0.68 1.18 0.15 0.01 0.00 0.00 0.08
[24]1.21 0.03 1.20 0.08 0.27 0.04 0.03 1.25 0.03 0.05 0.04 0.03 0.01 0.09 0.01 0.69 1.18 0.15 0.01 0.00 0.00 0.08 0.00
图3 基于苹果属ITS序列的遗传距离矩阵图
Fig.3 Genetic distance of Malus species and based on ITS swquences

图4 基于ITS序列的邻接NJ树Fig.4 The neighbor-joining tree based on ITS sequences
3 讨论
通过图4可以看出三叶海棠M.toringo、山荆子M.baccata、毛山荆子M.mandsurica、丽江山荆子M.rockii以及湖北海棠M.hupehensis、平邑甜茶M.hupehensis var.mengshanensis亲缘关系较近。大量的野外调查的标本也显示,这些类群间形态特征近似,形态变异复杂,性状过渡现象非常普遍,常存在难以鉴别的标本,对这些类群的分类处理仍存在较大的争议。锡金海棠M.sikkimensis、陇东海棠M.kansuensis、日瓦海棠与稻城海棠M.daochengensis聚集到了一起,也证实了其亲缘关系较为接近。河南海棠M.honanensis、滇池海棠M.yunanensis和尖嘴林檎M.melliana 以及乔劳斯基林檎M.tschonoskii较为接近。同时结果也显示湖北海棠、平邑甜茶、山荆子等与实验中的几个苹果品种距离较近,这在一定程度上说明了为什么以湖北海棠为主的山荆子组植物会成为目前应用最广泛的苹果砧木,而且以湖北海棠与平邑甜茶作为苹果砧木进行嫁接是亲和性良好[16]。通过本实验可以看出苹果属砧木嫁接的亲和性与品种之间的亲缘关系有关,亲缘关系越近的种嫁接的亲和性越高。
本研究在核DNA组中采用ITS方法进行序列测序,尽管能揭示出一定的种间亲缘关系,但依旧存在一定的局限性。叶绿体DNA的进化相对比较保守,所以对种内类群和新近分化类群所提供的信息位点不足,所以有必要寻找进化速率更加快速的叶绿体DNA进行研究。同时苹果属植物倍性复杂,杂交频繁,所以有必要采用单拷贝或低拷贝核基因组进行研究,进一步揭示杂交事件和异源多倍体物种的形成及其间的亲缘关系。
[1] 杨进.中国苹果砧木资源[M].济南:山东科学技术出版社,1990.37-39.
[2] 韩振海等.落叶果树种质资源学[M].北京:中国农业出版社,1994.
[3] 于敬.我省苹果砧木与栽培品种的应用问题[J].山西果树,1980(1):5-8.
[4] 河北农业大学果树教研组.苹果砧木试验总结[J].河北农大科技,1974(3): 6-29.
[5] 陈斌.花叶海棠作苹果砧木利用的调查初报[J].重庆师专学报,2001.20(2): 108-109.
[6] Campbell CS, Wojciechowski MF, Baldwin BG, et al.Persistent nuclear ribosomal DNA sequence polymorphism in the Amelanchier agamic complex (Rosaceae)[J].Mol Biol Evol,1997,14(1):81-90.
[7] Baldwin BG,Sanderson MJ,Porter JM, et al.Molecular phylogenetics of Calycadenia (Compositae) based on ITS Sequences f nuclear ribosomal DNA: chromosomal and morphological evolution reexamined[J].Am J Bot,1993:222-238.
[8] Sang T;Crawford DJ;Stuessy YF.Utility of low-copy nuclear gene sequences in plant phylogenetics[J].Crlt Rev Biochem Mol Biol, 2002,37(3):121-147.
[9] Baldwin BG, Sanderson MJ, Porter JM, et al.The ITS region of nuclear ribosomal DNA: a valuable source of evidence on angiosperm phylogeny[J].Ann Mo Bot Gard, 1995:247-277.
[10] Zomlefer WB, Williams NH, Whitten WM, et al.Generic circumscription and relationships in the tribe Melanthieae, with emphasis on Zigadenus: evidence form ITS and trnL-F sequence data[J].Am J Bot, 2001,88(9):1657-1669.
[11] Reeves G, Chase MW, Donoghue P, et al.Molecular systematics of Iridaceae: evidence form four plastid DNA regions[J].Am J Bot, 2001,88(11):2074-2087.
[12] Davis CC, Anderson WR, Donoghue MJ.Phylogeny of Malpighiaceae: evidence from, chloroplast ndhF and trnL-F nucleotide sequences[J].Am J Bot, 2001,88(10):1830-1846.
[13] 冯婷婷.变叶海棠 (Malus toringoides Hughes) 杂种起源的新分子证据[D].西南大学, 2007.
[14] 唐建民, 周志钦, 冯婷婷, 等.基于细胞核 ITS 序列的变叶海棠起源新证据[J].果树学报, 2009,26(003):265-270.
[15] White TJ, Bruns T, Lee S, et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J].Methods Mol Biol, 1990:315-322.
[16] 钱关泽.苹果属(Malus Mill.)分类学研究[D].南京林业大学植物学,2005.
(编校:谭玲)
Using ITS to research the genetic diversity of apple rootstocks
LUO Si-qian, WANG Yan, QIAN Guan-zeΔ
(College of Life Science, Liaocheng University, Liaocheng 252300, China)
ObjectiveTo explore the relationship between the genetic relationship and the cross compatibility of the wild rootstocks which belong to malus mill plants.MethodsWith the antecedent study in the cross compatibility of the rootstocks of malus mill plants, this paper focuses on the nrDNA ITS sequence analysis in the samples of the wild rootstocks which belong to malus mill plants from different 24 regions of China.ResultsIt was successfully that having measured the sequence of 24 samples and having made the genetic distance matrix and genetic tree diagram.ConclusionThere is a certain relationship between the genetic relationship and the cross compatibility of the wild rootstocks which belong to malus mill plants.
rootstocks; ITS; kinship
国家自然基金(31070619,31170178), 山东省自然基金(ZR2011CM045)。
罗思谦,男,硕士,研究方向:资源植物与演化植物学,E-mail:120109690@qq.com;钱关泽,通讯作者,男,博士,教授,研究方向:种子植物分类学等,E-mail:qianguanze@lcu.edu.cn。
S685.99
A
1005-1678(2015)05-0025-04
