实时荧光定量PCR和常规PCR检测肝水解肽样品中牛、猪源性成分的对比研究
2015-07-07余燕何素婷王自强邓锋
余燕,何素婷,王自强,邓锋Δ
(1.广东省食品药品检验所,广东 广州 510180;2 上海市食品药品检验所,上海 201203)
实时荧光定量PCR和常规PCR检测肝水解肽样品中牛、猪源性成分的对比研究
余燕1,何素婷2,王自强2,邓锋1Δ
(1.广东省食品药品检验所,广东 广州 510180;2 上海市食品药品检验所,上海 201203)
目的 对比实时荧光定量PCR与常规PCR检测肝水解肽样品中牛、猪源性成分的有效性。方法 对牛、猪源性肝水解肽样品肝脏至上清液工艺段样品进行DNA提取,采用实时荧光定量PCR和常规PCR同时检测样品中的DNA。结果 实时荧光定量PCR和常规PCR在猪源、牛源肝水解肽从肝脏到酶解液的各工艺步骤段样品中,均检测到动物源性DNA,在上清液至超滤液四中,均未检测出动物源性DNA。结论 两种方法均可用在检测肝水解肽样品中牛、猪源性成分。实时荧光定量PCR同时还具有快速、简便、不污染环境、重复性好的特点,可明显提高工作质量及效率。
肝水解肽;荧光定量PCR;常规PCR;牛源性成分;猪源性成分
肝水解肽(heparolysate)是由牛或猪的肝脏经酶类水解提取的低分子量多肽类物质,含有多肽类、氨基酸类、核酸类等物质[1],促进正常肝细胞的增殖和再生,对四氯化碳诱导的肝细胞损伤有较好的保护作用,降低谷丙转氨酶,促进病变组织恢复[2],用于慢性肝炎、肝硬化等疾病的辅助治疗[3]。鉴于疯牛病和羊瘙痒病的确诊,凡是动物组织来源的药品均被列于高风险品种。由于历史原因,质量控制基本靠成品的质量标准,原料及中间产品的生产工艺基本没有质量要求。该制剂生产厂家多,各厂家的生产工艺均不尽相同:如肝脏来源、水解酶的种类、水解条件、水解程度及超滤处理等。建立一个能鉴别真伪、评价优劣,监控质量稳定性、均一性的质量标准是关键。目前,有关动物源性成分的检测方法包括形态学分类方法、细胞学鉴定方法、生物化学鉴定方法及分子生物学方法等[4]。分子生物学中的PCR方法因具有特异性强、灵敏度高且简便快速等优点,而成为商品中动物源性材质鉴别的有效方法[5],并在保健品、药品、饲料、食品中的鉴定研究中得到广泛应用[6-12]。本研究拟采用荧光定量PCR与常规PCR来鉴别肝水解肽从肝脏到酶解液的各工艺步骤段样品中的动物源性,通过比较2种方法检测肝水解肽样品的有效性,以评价实时荧光定量PCR技术测定生化药物动物源性的价值。
1 材料与方法
1.1 仪器 Ultrospec 2100 核酸蛋白快速测定仪(购自美国GE公司);Gene Amp® PCR System 9700 核酸扩增仪(购自美国AB公司);Bio-rad DNA凝胶电泳仪(购自美国Bio-rad公司);Bio-rad凝胶成像系统(购自美国Bio-rad公司);Applied Biosystems 7300 Real-time PCR system(购自美国AB公司)。
1.2 试剂 检测试剂盒Real Time PCR Porcine DNA Detection Kit、Real time PCR bovine DNA Detection kit(购自大连宝生物工程有限公司)。Premix Taq扩增反应液(购自Takara 公司);提取试剂盒分别为DNA Isolation Reagent for Meat and Meat Products(购自Takara公司)。Mnl I核酸限制性内切酶、Sau3A I核酸限制性内切酶(购自NEB)。水为自制灭菌Milli-Q 纯净水。

1.4 引物序列 猪、牛引物序列参考国家标准及出入境检验检疫行业标准中的引物的DNA序列[13-14]交由上海生工生物工程公司合成;猪的上游引物序列为5-GCCTAAATCTCCCCTCAATGGTA-3,下游引物序列为5- ATGAAAGAGGCAAATAGATTTTCG-3;牛的上游引物序列为5- GCCATATACTCTCCTTGGTGACA-3,下游引物序列为5- GTAGGCTTGGGAATAGTACGA-3。
1.5 样品检测
1.5.1 常规PCR检测:采用DNA Isolation Reagent for Meat and Meat Products 提取试剂盒对肝水解肽样品进行DNA提取。其中对肝至上清液工艺段样品,称取20 mg样品直接按试剂说明书进行提取;而对超滤液至注射液工艺段样品,均取3 mL进行冻干浓缩,将浓缩物加200 μL水复溶,吸取20 μL溶液进行DNPremix Taq 25 μL,引物各1 μL(10 mmol/L, DNA模板1 μL,去离子水补足50 μL。电泳条件:电压 90 V,时间30 min,用Gel red染色20 min,置于成像系统观察电泳结果。
1.5.2 荧光定量PCR检测:采用Applied Biosystems 7300 Real-time PCR仪扩增,扩增体系为25 μL,2×Premix 12.5 μL,Primer Mix 1 μL,Proble Mix 1 μL,DNA模板1 μL,去离子水补足25 μL。反应条件为95 ℃,10 s;95 ℃,5 s;60 ℃,31 s,共40个循环。
1.5.3 PCR产物的酶切验证:酶切条件:猪源性阳性对照PCR产物按照Mnl I核酸限制性内切酶的酶切反应条件操作。牛源性阳性对照PCR产物按照Sau3A I核酸限制性内切酶核酸限制性内切酶的酶切反应条件操作。
2 结果
2.1 肝水解肽样品(牛、猪源性)样品的常规PCR产物琼脂糖电泳 肝水解肽样品(牛源性)样品用PCR法扩增出271 bp的牛基因,肝水解肽样品(猪源性)样品用PCR法扩增出212 bp的牛基因,其大小与预期结果相符。从肝脏到酶解液的各工艺步骤段样品中,均检测到牛、猪源性DNA,在上清液及超滤液四中,全部都未检测出牛、猪源性DNA。见图1、图2。
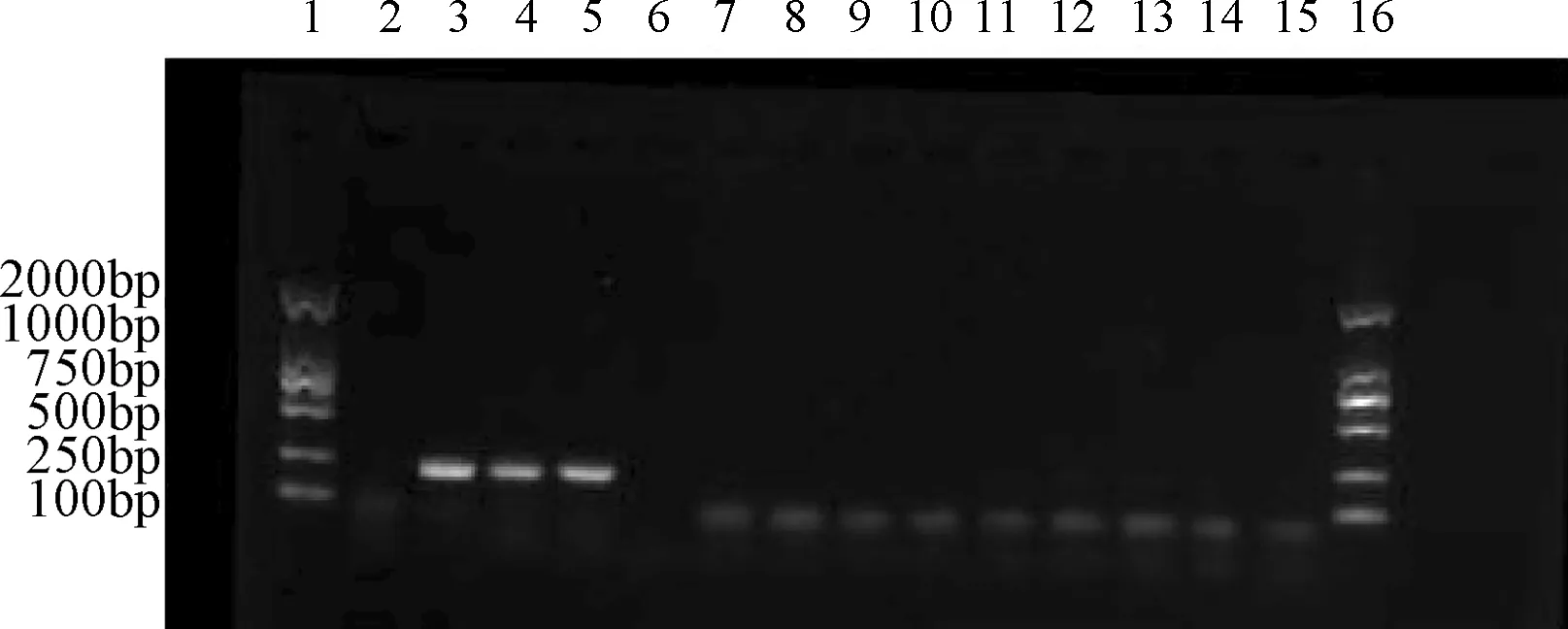
图1 猪源性的肝水解肽样品的常规PCR产物琼脂糖电泳图1.Marker;2.无;3.猪肝;4.匀浆液;5.酶解液;7.上清液;8.超滤液一;9.超滤液二;10.超滤液三;11.超滤液四;12-14.扩增空白;15.阴性对照;16.MarkerFig.1 Amplification result of porcine derived materials in hydrolysate samples1.Marker;2.Nothing;3.Pork liver;4.Homogenate;5.Enzymatic hydrolysate;7.Supernatant;8.Ultrafiltrate 1;9.Ultrafiltrate 2;10.Ultrafiltrate 3;11.Ultrafiltrate 4;12-14.Amplification blank;15.Negative control;16.Marker
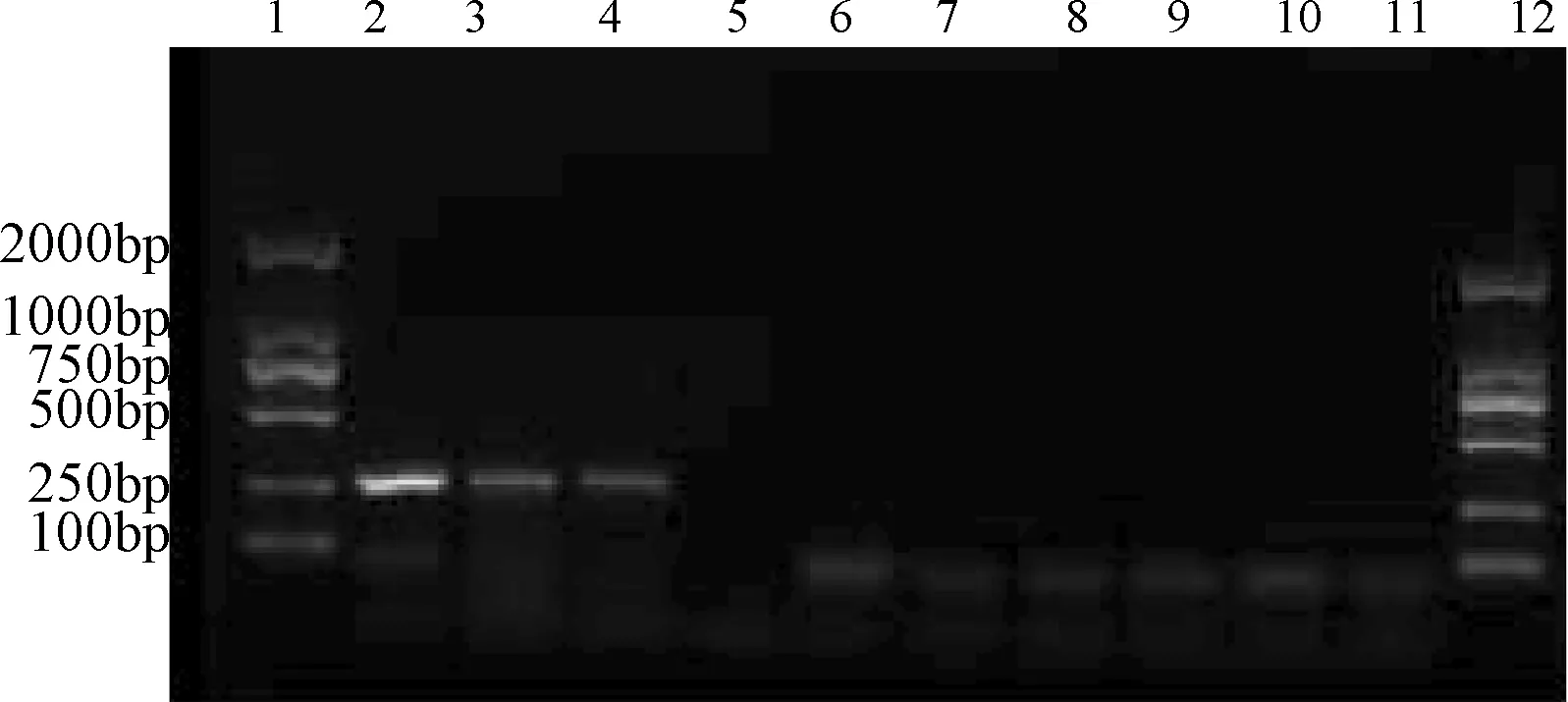
图2 牛源性的肝水解肽样品的常规PCR产物琼脂糖电泳图1.Marker;2.牛肝;3.匀浆液;4.酶解液;5.上清液;6.超滤液一;7.超滤液二;8.超滤液三;9.超滤液四;10.扩增空白;11.阴性对照;12.MarkerFig.2 Amplification result of bovine derived materials in hydrolysate samples 1.Marker;2.beef liver;3.Homogenate;4.Enzymatic hydrolysate;5.Supernatant;6.Ultrafiltrate 1;7.Ultrafiltrate 2;8.Ultrafiltrate 3;9.Ultrafiltrate 4;10.Amplification blank;11.Negative control;12.Marker
2.2 PCR产物的酶切验证 针对阳性结果,分别对扩增产物进行了酶切验证,271bp的牛源性PCR产物经酶切的得到214bp和57bp的DNA片段,确证为牛源性成分。212bp的猪源性PCR产物经酶切的得到196bp和16bp的DNA片段,确证为猪源性成分。见图3。
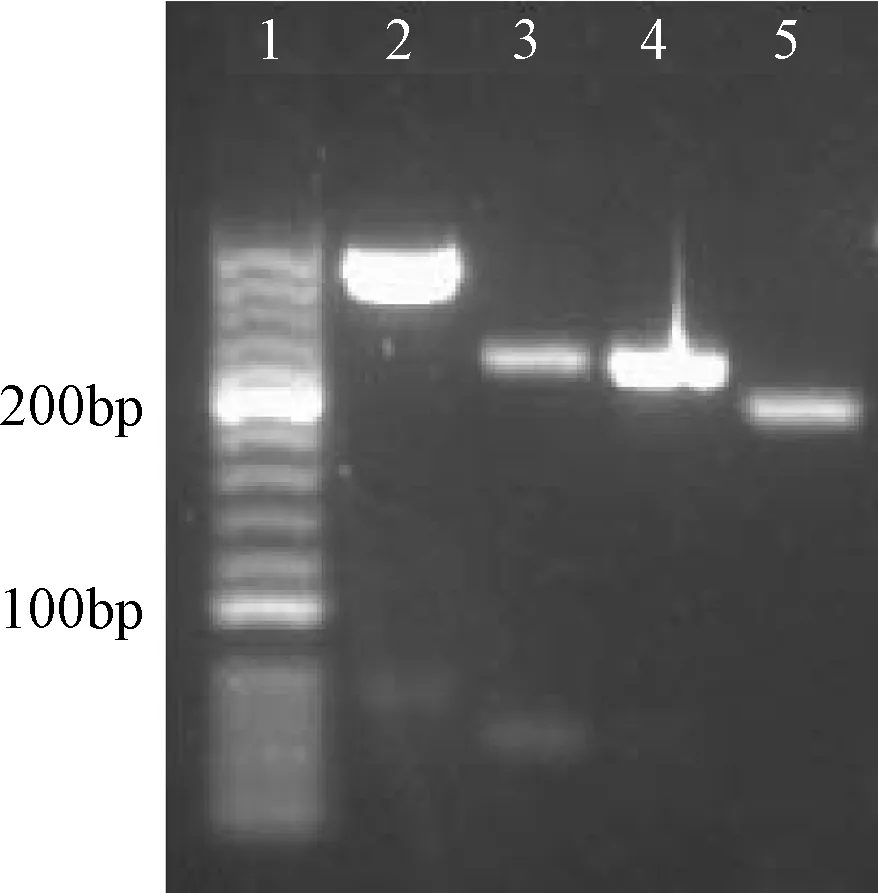
图3 牛、猪源性PCR产物限制性酶切电泳图1.20bpDNA Marker;2.牛PCR产物;3.牛酶切产物;4.猪PCR产物;5.猪酶切产物Fig.3 Restriction enzyme result of bovine and porcine derived materials in hydrolysate samples1.20bpDNA Marker;2.Beef PCR product;3.Beef restricted DNA products;4.Pork PCR product;5.Pork restricted DNA products
2.3 肝水解肽各工艺步骤段样品荧光定量PCR的检测结果 分别按试剂盒操作要求对检测肝水解肽样品(牛、猪源性样品),DNA提取液进行实时荧光PCR检测,并根据样品的Ct值对结果进行判定。检测结果与常规PCR相同,肝水解肽样品(牛、猪源性样品)DNA提取液在使用相对应的物种检测试剂盒进行实时荧光PCR扩增时,酶解液及其之前的检测结果及阳性对照有扩增曲线均为阳性,上清液至注射液检测,未出现扩增曲线或出现扩增曲线,但Ct值大于35.0,结果为阴性。见图4、图5。
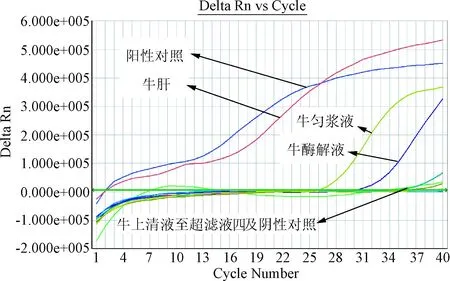
图4 牛源性肝水解肽样品荧光定量扩增图Fig.4 Bovine derived materials in hydrolysate samples by real-time fluorescence quantitative PCR
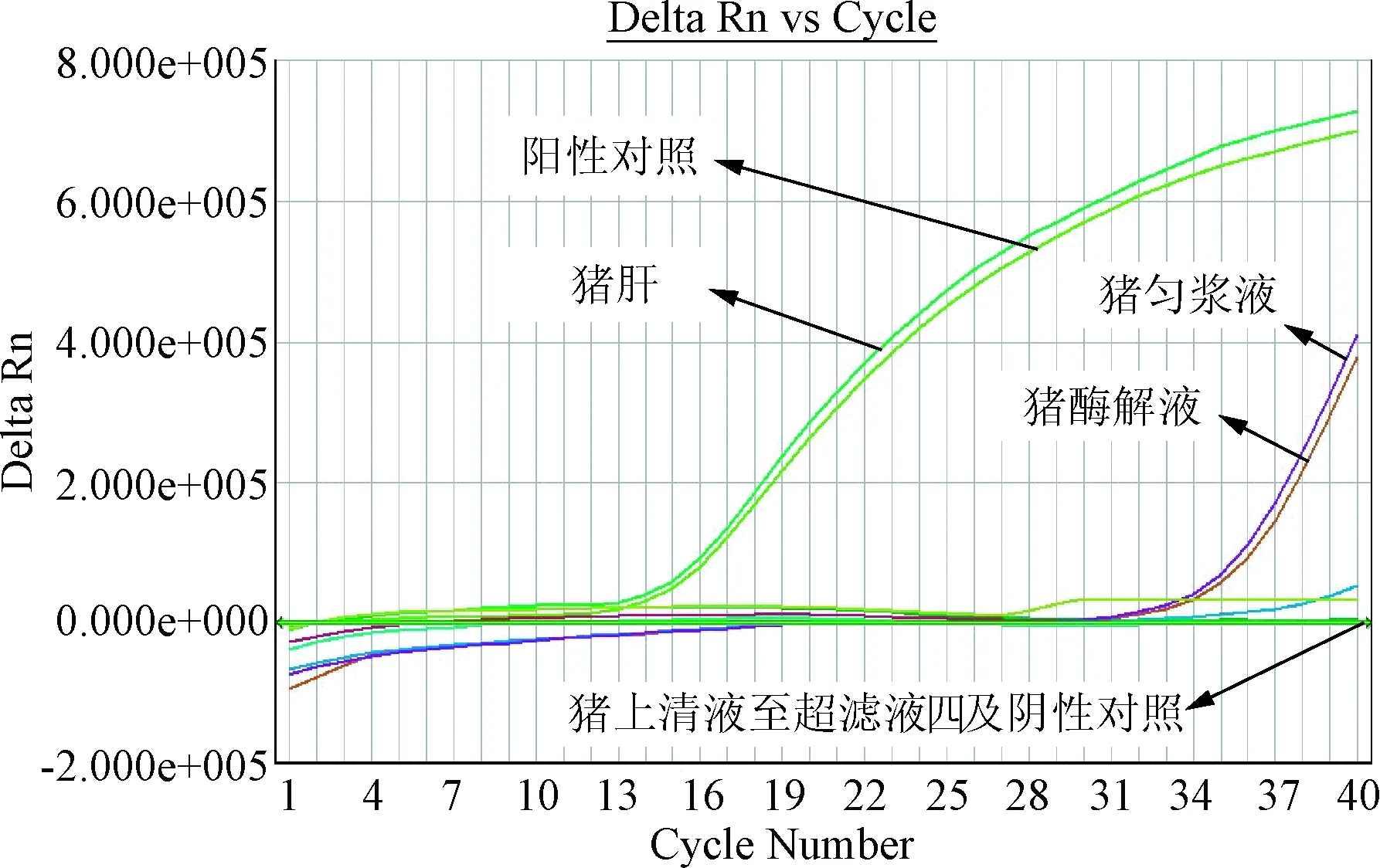
图5 猪源性肝水解肽样品荧光定量扩增图Fig.5 Porcine derived materials in hydrolysate samples by real-time fluorescence quantitative PCR
3 讨论
目前,生化药物大多以猪、牛、羊等动物的脏器组织为原料,经过分离提取获得,不同动物种属提取的生物大分子[15]。动物种属来源鉴别方法目前在美国药典37版、英国药典2013版、日本药局方2011版、欧洲药典8.0版及中国药典2010年版均未收载。我国目前现有的猪、牛及羊PCR种属鉴别的相关标准均参照中国出入镜检验检疫行业标准[13-14]。本实验以生化药物中有代表性的肝水解肽为研究对照,研究结果表明荧光定量PCR和常规PCR均可对肝水解肽各工艺步骤段样品中酶解液之前的各工艺步骤段样品进行猪、牛源性成分的检测,这和一些文献报道的荧光定量PCR技术检测敏感性高于常规PCR不一致[16]。分析原因为猪(牛)肝经过多个工艺步骤的处理,上清液至注射液各工艺步骤段样品特别是在超滤步骤中,采用超滤膜去除对大分子物质,使得样品中残留的大分子DNA量大大减少,当模板量较低时,无论是荧光定量PCR技术还是常规PCR检测结果均为阴性。何素婷等[17]研究常规PCR检测肝水解肽样品结果中发现常规PCR可以对肝水解肽样品各工艺步骤段中超滤液四之前的样品进行猪、牛源性成分的检测。这个结果差异分析原因为各自使用DNA提取的试剂盒不一致,导致结果有差别。本研究使用的DNA试剂盒为DNA Isolation Reagent for Meat and Meat Products,其主要是针对肉类制品,故对于猪(牛)肝、猪(牛)匀浆液、猪(牛)酶解液这一些提取DNA比较合适。而后续上清液至注射液各工艺步骤段样品因几乎不含肉类,加之后续步骤超滤对DNA损失的影响,故DNA未能被提取出来,所以荧光定量PCR和常规PCR检测结果均为阴性。当然浓缩的过程也可能会导致DNA的模板量低于检测限,需要进一步实验核实。
同常规PCR相比,荧光定量PCR检测肝水解肽样品中牛、猪源性成分更为简单,耗时短。
[1] 李勇. 生物活性肽研究现状和进展[J].食品与发酵工业,2007,33(1):3-9.
[2] 傅颖,梅松,王茵. 新生牛肝活性肽对小鼠的免疫增强作用[J].中国生物制品学杂志,2008,21(1): 47-50.
[3] Fukuda Y,Sawata M,Washizuka M,et al. Effect of liver hydroly-sate on hepatic proliferation in regenerating rat liver[J].Nippon Yakurigaku Zasshi,1999,114(4):233-238.
[4] 陈文炳,邵碧英,李寿崧,等.加工食品中若干动物成分的PCR检测技术应用研究[J].食品科学,2005,26 (8):338-342.
[5] Huang Q,Xu T,Wang GY,et al.Species-specific identification of ruminant components contaminating industrial crude porcine heparin using real-time fluorescent qualitative and quantitative PCR[J]. Anal Bioanal Chem,2012,402(4):1625-1634.
[6] 杨宝华,宗卉,林庆燕,等.用分子生物学方法鉴别检测动物源性饲料中的牛羊源性成分[J].中国畜牧杂志,2002,38(1):3-5.
[7] 高丹丹,曹郁生,王迎华.PCR技术在食品动物源性检测中的应用[J].食品研究与开发,2007,28(1):141-144.
[8] 陈颖,钱增敏,徐宝梁,等.保健品中牛羊源性成分的PCR检测[J].食品科学,2004,25(10):215-218.
[9] 王丽媛,叶建荣,李兴民,等.PCR技术检测食品与饲料中动物源成分[J].保鲜与加工,2006,6(4):33-36.
[10] Tartaglia M, Saulle E, Pestalozza S, et al.Detection of bovine mito-chondrial DNA in ruminant feeds: a molecular approach to test for the presence of bovine derived materials[J]. J Food Prot, 1998,61(5): 513-518.
[11] Tartaglia M,Saulle E. Rapid communication: Nucleotide sequence of procine and ovine tRNA and ATPase mitochondrial genes[J]. J Anim Sci,1998,76(8): 2207-2208.
[12] Lahiff S,Glennon M,O'Brien L,et al. Species -specific PCR for the identification of ovine, procine and chicken species in meat and bone meal( MBM)[J]. Mol Cell Probes,2001,15(1): 27-35.
[13] GB/T 21101—2007, 动物源性饲料中猪源性成分定性检测方法 PCR方法[S], 2007.
[14] SN/T 2051—2008, 食品、化妆品和饲料中牛羊猪源性成分检测方法实时PCR法[S], 2008.
[15] 蒋桂香,李延平,刘中原,等.肝水解肽的制备及相对分子质量分布研究[J].中国生化药物杂志,2012,33(5):603-606.
[16] 林潮双,陈文思,卢建溪,等.荧光定量PCR与RT-PCR技术检测HCV-RNA的比较观察[J].中国实验室诊断学,2000,4(4):176-178.
[17] 何素婷,段徐华,邵泓,等.肝水解肽样品中牛源及猪源性成分的 PCR 检测[J].药物分析杂志,2012,32(6):1064-1068.
(编校:王冬梅)
Comparative study of bovine and porcine derived materials in hydrolysate samples by real-time fluorescence quantitative PCR and general PCR
YU Yan1, HE Su-ting2, WANG Zi-qiang2, DENG Feng1Δ
(1. Guangdong Institute for Food and Drug Control, Guangzhou 510180, China; 2. Shanghai Institute for Food and Drug Control, Shanghai 201203, China)
ObjectiveTo compare real-time fluorescence quantitative PCR with general PCR in detecting bovine and porcine derived materials in hydrolysate samples.MethodsDNA were extracted from hydrolysate samples which prepared by different steps by real-time fluorescence quantitative PCR and general PCR.ResultsDNA of bovine and porcine could be detected by real-time fluorescence quantitative PCR and general PCR in samples prepared in the processes before enzymolysis solution, but not detected in samples from supermatant to the fourth ultrafiltrate.ConclusionBoth real-time fluorescence quantitative PCR and general PCR can be applied to detect the fragments in hydrolysate samples.And real-time fluorescence quantitative PCR has the advantage such as rapid,convenient, non-environment-polluted, good repeatability, which improves the quality and efficiency.
hydrolysate; real-time fluorescence quantitative PCR; general PCR;bovine derived materials; porcine derived materials
广东省医学科研基金(B2014093、A2013158)
余燕,女,硕士,主管药师,研究方向:分子生物学相关技术在药物检验中的应用;E-mail:yuyan921124 @126.com;邓锋,通讯作者,男,硕士,副主任药师,研究方向:分子生物学相关技术在药物检验中的应用,E-mail:494409425@qq.com。
R917
A
1005-1678(2015)05-0018-03
