四种莲子心生物碱对H2O2诱导血管内皮细胞损伤的保护作用
2015-07-07张玉玲杨光明李萍潘扬
张玉玲,杨光明,李萍,潘扬
(南京中医药大学 药学院,江苏 南京 210046)
四种莲子心生物碱对H2O2诱导血管内皮细胞损伤的保护作用
张玉玲,杨光明,李萍,潘扬Δ
(南京中医药大学 药学院,江苏 南京 210046)
目的 探讨中药莲子心中4种生物碱莲心季铵碱(Lot)、莲心碱(Lien)、异莲心碱(Iso)和甲基莲心碱(Nef)对H2O2诱导人脐静脉内皮细胞株ECV304氧化损伤的保护作用。方法 采用MTT法测定不同浓度Lot、Lien、Iso和Nef 对正常和H2O2损伤ECV304细胞活性的影响,通过比色法测定并比较各组细胞一氧化氮(NO)及一氧化氮合酶(NOS)的水平。结果 Lot、Lien、Iso和Nef对正常ECV304细胞形态和活性均无影响;Lot为100 μmol/L, Lien、Iso和Nef为0.1 μmol/L时,对H2O2致损内皮细胞活性有较好的缓解作用,此时细胞活性分别为H2O2损伤组的112.8%、129.3%、125.6和118.2%(P<0.01或0.05)。4种生物碱在上述剂量时对H2O2致损内皮细胞形态的改善作用与阳性药卡托普利基本相近,除Lot的作用较弱外,Lien、Iso和Nef均可使受损内皮细胞的细胞间隙缩小,细胞彼此相连增强,细胞边界变清晰。另外,且4种莲子心生物碱均可提高H2O2致伤内皮细胞的NO浓度(P<0.05),增加损伤内皮细胞的NOS活性(P<0.05)。结论 莲心季铵碱、莲心碱、异莲心碱和甲基莲心碱均对H2O2诱导内皮细胞损伤的有一定的保护作用,其作用机制可能是通过增加NOS生成提高血管内皮细胞释放NO,从而发挥保护内皮的功能。
莲心季铵碱;莲心碱;异莲心碱;甲基莲心碱;血管内皮细胞;H2O2诱导损伤
当前我国心血管疾病(cardiovascular disease,CVD)的发病率在不断攀升,发病年龄也有所提前,这种不断上升趋势主要与人们生活水平提高、生活习惯改变、人口老龄化、环境不断变化等导致CVD的危险因素持续增长有关,已成为我国当今社会人群健康所面临的重要公共卫生问题,加强心血管疾病的防治已刻不容缓。血管内皮细胞位于血流与平滑肌细胞之间,其损伤和功能的改变在多种CVD发病过程中起着至关重要的作用,尤其是对动脉粥样硬化发病的始动环节。内皮功能障碍主要表现为一氧化氮(NO)等内皮依赖性舒张因子(endothelium derived relaxing factor,EDRF)分泌减少或生物利用度降低,而内皮素(endothelin,ET)等内皮依赖性收缩因子(endothelium derived contracting factor,EDCF)分泌增多[1]。氧化应激引起的内皮细胞氧化损伤是引起血管内皮功能障碍的重要原因,它使氧自由基大量产生,引起细胞膜脂质过氧化、蛋白质和核酸变性,导致内皮不可逆损伤;同时活性氧还参与以内皮细胞脱落为特征的“失巢凋亡”[2]。目前,H2O2诱导内皮细胞分泌NO失衡导致内皮细胞凋亡越来越受到人们的关注,因此对NO水平进行调控有望成为治疗氧自由基引起的内皮细胞凋亡异常相关心血管疾病的有效策略。而利用祖国传统中医药改善细胞功能、保护内皮细胞免受损伤是防治CVD的重要手段之一[3]。
莲子心为常用中药,来源于睡莲科植物睡莲成熟种子NelumbonuciferaGaertn.的绿色幼叶及胚根,具有清心安神、去热,交通心肾、涩精止血之功效[4]。莲子心中异喹啉类生物碱是其主要活性成分,其中以莲心季铵碱(Lot)、莲心碱(Lien)、异莲心碱(Iso)和甲基莲心碱(Nef)为代表[5-6]。在前期研究中,本课题组已获得了纯度较高的这4种生物碱,并对它们的光(波)谱数据进行了详细的解析[7-8]。近年来,很多研究已发现Nef对损伤的内皮细胞具有保护作用[9-11],但至今尚未见对这4种生物碱保护受损内皮细胞作用比较的研究报道。本文拟采用形态学观察和MTT法测定Lot、Lien、Iso和Nef 对正常和H2O2损伤人脐静脉内皮细胞株ECV304活性的影响,并通过比色法测定各组细胞一氧化氮(NO)及一氧化氮合酶(NOS)的水平,以评估莲子心4种生物碱对损伤内皮细胞的保护功能。
1 材料与方法
1.1 材料
1.1.1 主要实验仪器:酶标仪(BIORAD,USA);倒置相差显微镜(OLYMPUS bx-50);CO2培养箱(Forma3111,USA);Countess全自动细胞计数仪(Invitrogen,USA);酶联免疫检测仪(BIORAD,USA);L-650Y超声波细胞破碎机(上海皓庄仪器有限公司)。
1.1.2 药品与试剂:莲心季铵碱、莲心碱、异莲心碱和甲基莲心碱,均从莲科植物Nelumbo nucifera Gaertn. 种子的幼叶及胚根分离纯化得到,并经UV、IR、NMR和MS鉴定结构[5-6],HPLC面积归一化法分析,4种生物碱纯度均大于95%。4种生物碱均用DMSO溶解配成高浓度的母液备用。
RPMI-1640培养液(美国GIBCO,P1520);小牛血清(杭州四季清生物工程材料有限公司);噻唑蓝(MTT,上海伯奥生物科技公司);二甲基亚砜(DMSO,上海凌锋化学试剂有限公司);次黄嘌呤[Hypoxanthine,SIGMA(Cell Culture Tested),086K06621];黄嘌呤氧化酶(Xanthine Oxidase,IGMA,024K37841);NO及NOS试剂盒(南京建成生物工程研究所);卡托普利(Captopril,Fluka)。
1.1.3 细胞株:人脐静脉内皮细胞细胞株ECV304(中科院上海生化细胞研究所,由本校王明艳教授传代并惠赠),按照文献方法进行体外培养[12]。
1.2 细胞悬液的制备 常规方法复苏冻存的ECV304细胞,用RPMI-1640完全培养液培养,待细胞铺满培养瓶底时,弃去培养液,加入0.25%胰蛋白酶液消化成细胞悬液,PBS缓冲液洗2~3遍,换新鲜细胞培养液,混匀,即得细胞悬液。
1.3 H2O2体外诱导内皮细胞的损伤 取上述细胞悬液,使终浓度约为1×105个/mL,接种于24孔培养板中,每孔180 μL,每孔加入不同浓度H2O2和生理盐水各10 μL,使H2O2终浓度分别为0,0.1,0.2,0.4,1,2和4 mmol/L,于CO2培养箱中培养24 h后,倒置相差显微镜观察细胞的形态及生长状况,每孔加入50 μL 10 mg /mL MTT溶液,孵育4 h,倾去上清,每孔加100 μL DMSO,振荡10 min,使蓝紫色结晶充分溶解,酶标仪上于490 nm处测定OD值,按下式计算各组增值抑制率。

1.4 4种生物碱对正常内皮细胞活性的作用 取细胞悬液,按上法操作,实验分组:①空白对照组:正常细胞培养,不加药物;②阳性对照组:加卡托普利(Cap)使终浓度为10 μmol/L;③给药组:Lot组、Lien组、Iso组、Nef组,每个药物分别设4个终浓度:100、10、1、0.1 μmol/L。培养24 h后,显微镜下观察细胞的形态及生长状况,MTT法测定各孔的OD值。
1.5 不同浓度的4种生物碱对H2O2损伤内皮细胞活性的影响 取细胞悬液,按上法操作,实验分组:①空白对照组:正常细胞培养,不加药物及H2O2;②模型(H2O2)组:仅加H2O2;③阳性对照组:Cap(终浓度为10 μmol/L)+H2O2;④给药组:Lot组(Lot+H2O2)、Lien组(Lien+H2O2)、Iso组(Iso+H2O2)、Nef组(Nef+H2O2),每个药物分别设4个终浓度:100、10、1、0.1 μmol/L。H2O2造模终浓度根据“1.1.3”项下结果来确定。培养24 h后,显微镜下观察细胞的形态及生长状况,MTT法测定各组OD值。

1.7 NOS活性的测定 本法的原理在于NOS催化L-Arg和分子氧反应生成NO,NO与亲核性物质生成有色化合物,在530 nm波长下测定其吸光度,根据吸光度的大小可计算出NOS活性。按照“1.4”项下方法进行操作,按NOS试剂盒说明书操作,530 nm波长、0.5 cm光径,比色,并按下式计算各组细胞NOS活性。

(消光系数ε:L/nmol;体积:mL;光径:cm;反应时间:min)
1.8 统计学方法 采用SPSS统计软件的One-Way ANOVA过程进行单因素方差分析及均值多重比较,以P<0.05为差异有统计学意义。
2 结果
2.1 H2O2致损内皮细胞浓度的确定 在倒置相差显微镜下观察:空白对照组与0.1 mmol/L H2O2损伤组血管内皮细胞在形态上基本无差别,细胞生长状态良好,贴壁较牢,细胞间连接紧密,细胞呈多角形或短梭形,边界清楚,大小均匀。0.2、0.4 mmol/L H2O2损伤组血管内皮细胞呈现收缩、变圆,胞体变小,细胞间隙增宽,部分细胞脱落现象。1、2、4 mmol/L H2O2损伤组血管内皮细胞则出现胞膜边缘不清晰,部分胞膜不完整,甚至损伤破裂,有较多细胞脱落,并形成大片脱失区。见图1。

图1 不同浓度H2O2致损内皮细胞的形态学观察(×200)A.空白对照;B. 0.1 mmol/L H2O2;C. 0.2 mmol/L H2O2;D. 0.4 mmol/L H2O2Fig.1 Different concentrations of H2O2-induced damage morphology of endothelial cells (×200)A.control group; B. 0.1 mmol/L H2O2 group; C. 0.2 mmol/L H2O2 group;D.0.4 mmol/L H2O2 group (×200)
MTT法测定结果表明:与空白对照组相比,除0.1 mmol/L H2O2组OD值差异无统计学意义外,其他各浓度损伤组OD值均显著降低(P<0.05或0.01)。H2O2浓度与对内皮细胞增殖抑制呈现明显的量效关系,H2O2浓度大,抑制作用越大。0.4 mmol/L即可明显抑制内皮细胞的增殖(P<0.01)。综合上述形态学的观察,本实验以终浓度为0.4 mmol/L的H2O2作为模型组,其抑制率约为35%左右。见表1。

表1 不同浓度H2O2致损内皮细胞MTT测定(n=4)Tab. 1 Different concentrations of H2O2-induced damage of endothelial cells MTT assay(n=4)
*P<0.05,**P<0.01,与空白对照相比, compared with control group
2.2 4种生物碱对正常内皮细胞活性的影响 MTT法测定表明:与空白对照相比,阳性对照(Cap,10 μmol/L))、给药组(Lot,Lien,Iso和Nef)各剂量(0.1~100 μmol/L)的OD值均无统计学意义,提示与阳性药物一样,Lot、Lien、ISO和Nef对血管内皮细胞无明显的毒性。见表2。
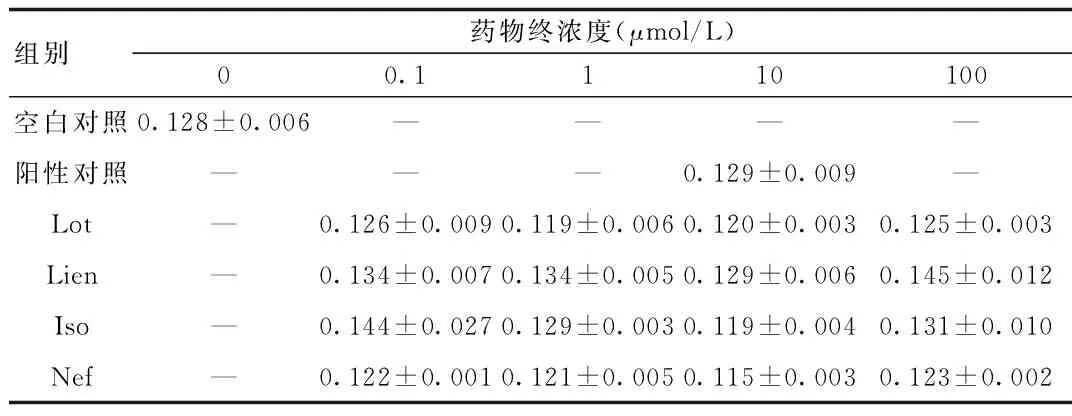
表2 4种生物碱对正常内皮细胞活性的影响(n=4)Tab.2 Effects of four alkaloids on normal endothelial cell activity(n=4)
2.3 不同浓度的4种生物碱对H2O2致损内皮细胞增殖的影响 MTT法测定表明:4种生物碱对H2O2致损内皮细胞增殖产生促进作用的最低浓度各不相同,Lien+H2O2组和Iso+H2O2组0.1 μmol/L、Nef+H2O2组10 μmol/L及Lot+H2O2组100 μmol/L的OD值均显著高于模型组(P<0.05或0.01)。除Lot外,Lien、Iso和Nef均随着剂量的增加,对细胞增殖的抑制作用也不断增大。同时发现:3者浓度高于100 μmol/L时,药物显示的是抑制受损细胞增殖的作用,因此本实验采用Lot为100 μmol/L,Lien、Iso和Nef均为0.1 μmol/L的药物剂量为治疗剂量进行以下研究,此时细胞活性分别为H2O2损伤组的112.8%、1129.3%、125.6和118.2%(P<0.01或0.05)。见表3。

表3 不同浓度的4种生物碱对H2O2致损内皮细胞增殖的影响(n=4)Tab.3 Four different concentrations of H2O2-induced damage alkaloids on the proliferation of endothelial cells(n=4)
**P<0.01,与空白对照相比,compared with control group;#P<0.05,##P<0.01,与模型组相比,compared with model group
2.4 4种生物碱对H2O2致损内皮细胞形态的影响 在倒置相差显微镜下观察:与空白对照相比,阳性药物Cap+H2O2组血管内皮细胞与之形态相似,生长状态良好,贴壁较牢,连接紧密,边界清楚,呈多角形或短梭形,部分变圆,大小均匀。4种生物碱在治疗剂量时对H2O2致损内皮细胞形态的改善作用与阳性药物基本相近,除Lot的作用稍差外,Lien、Iso和Nef均可使受损内皮细胞的细胞间隙缩小,细胞彼此相连增强,细胞边界变清晰。见图2。

图2 4种生物碱对H2O2致损内皮细胞形态的影响(×200)A. 模型组;B. Cap+H2O2;C. Lot+H2O2;D. Lien+H2O2;E. Iso+H2O2;F. Nef+H2O2Fig.2 Four alkaloids on H2O2-induced loss of endothelial cell morphology(×200)B. Model group; B. Cap+H2O2 group;C. Lot+H2O2 group;D. Lien+H2O2 group;E. Iso+H2O2 group;F. Nef+H2O2 group
2.5 4种生物碱对H2O2致损内皮细胞NO水平的影响 结果表明:与空白对照组(52.82 μmol/L)相比,模型组NO浓度(29.35 μmol/L)显著降低(P<0.05),说明H2O2诱损内皮细胞模型已具备。与模型组相比,4种生物碱除Lot的NO浓度无统计学意义外,Lien(51.45 μmol/L)、Iso(44.83 μmol/L)和Neo(53.99 μmol/L)与阳性对照Cap(52.44 μmol/L)一样,NO浓度均显著提高(P<0.05)。Lien、Iso和Neo与阳性对照组相比,NO浓度的提升并无统计学差异。3种莲子心生物碱之间NO浓度也无统计学差异,但以Nef的最高。见图3。
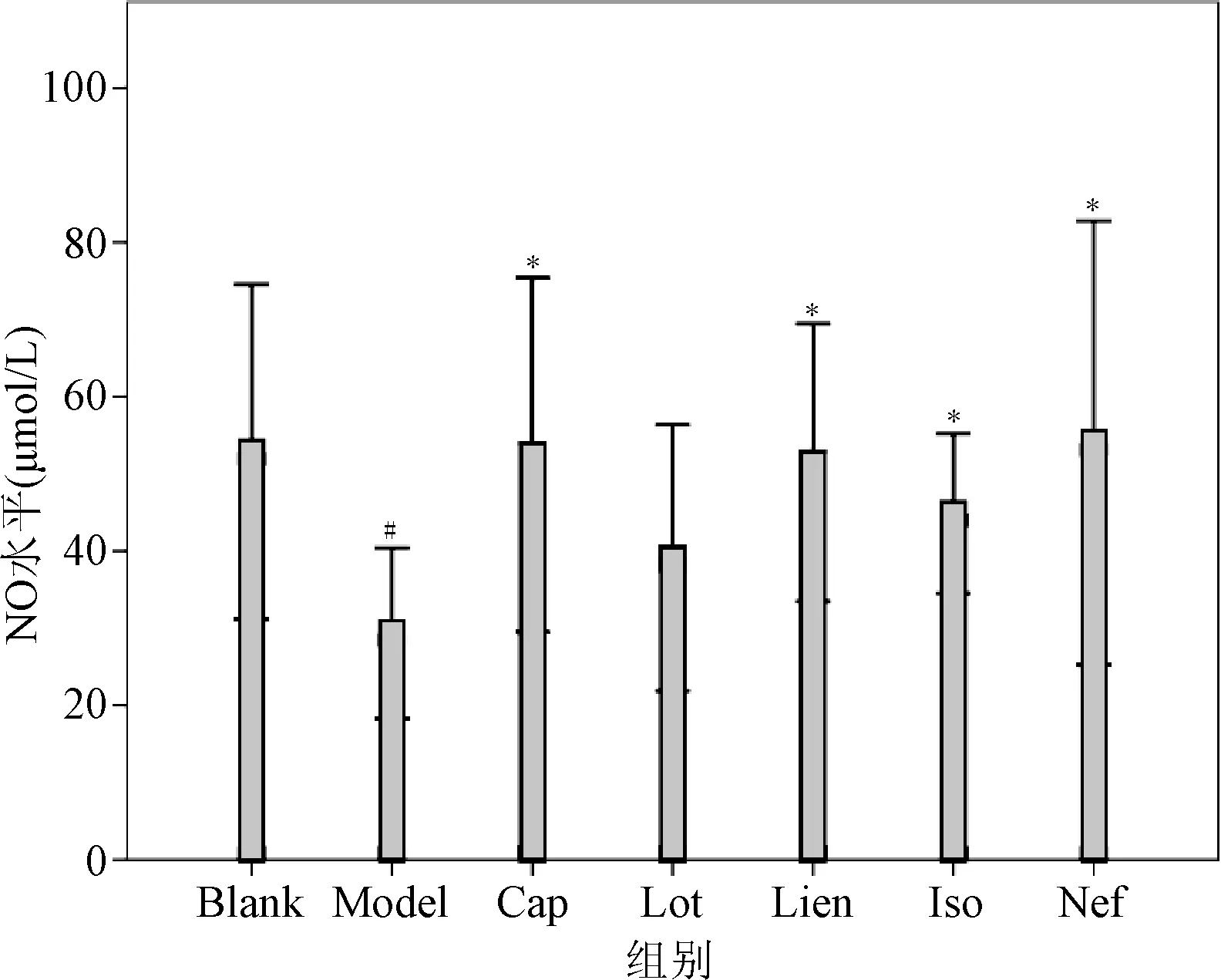
图3 4种生物碱对H2O2致损内皮细胞NO浓度的影响(n=4)*P<0.05,与空白对照相比;#P<0.05,与模型组相比Fig.3 Effects of four alkaloids on H2O2-induced loss of endothelial NO concentration cells(n=4)*P<0.05,compared with blank group; #P<0.05,compared with model group
2.6 4种生物碱对H2O2致损内皮细胞NOS水平的影响 结果表明:与空白对照组(8.25 μmol/L)相比,模型组NOS活性(5.57 μmol/L)显著降低(P<0.05),说明H2O2诱损内皮细胞模型已具备。与模型组相比,4种生物碱Lot(7.84 μmol/L)、Lien(8.12 μmol/L)、Iso(8.16 μmol/L)和Neo(8.24 μmol/L)与阳性对照Cap(8.10 μmol/L)一样,NOS活性均显著提高(P<0.05)。4种莲子心生物碱与阳性对照组相比,NOS活性的提升差异并无统计学意义。4种莲子心生物碱之间NOS活性差异也无统计学意义,但以Lot的最低。见图4。
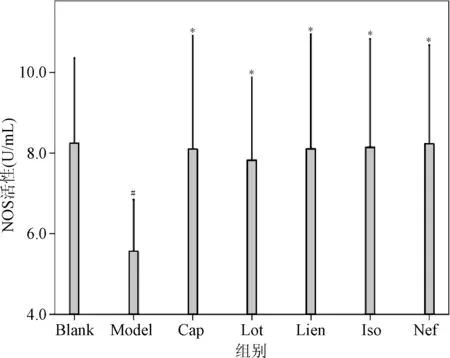
图4 4种生物碱对H2O2致损内皮细胞NOS活性的影响(n=4)*P<0.05,与空白对照相比;#P<0.05,与模型组相比Fig.4 Four alkaloids on H2O2-induced endothelial cell damage NOS activity(n=4)*P<0.05,compared with blank group; #P<0.05,compared with model group
3 讨论
由于人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)的原代培养有难度,因此失去体内原代细胞的一些特点内皮细胞株应运而生。ECV304细胞是较为经典的人脐静脉内皮自发转化形成的细胞系,尽管先前有学者对其能否替代HUVEC提出疑问[13],但它仍被作为血管内皮细胞的模型在国内广泛应用[14]。最近有学者还建立了nanoLC-ESI/MS/MS对ECV304细胞的蛋白质组学研究的方法并对其进行了初步的分析,为内皮损伤机制的蛋白质组学研究奠定了实验基础[15]。
H2O2是体内氧化代谢的中间产物,是一种活性氧,同时H2O2很易穿透细胞膜到达胞内位点,因此积累到一定程度会造成细胞损伤,但H2O2产生过多或暴露时间过长也会造成内皮细胞不可逆损伤。综合MTT测定和形态学的观察,本实验以终浓度为0.4 mmol/L的H2O2作为模型组,从形态学上看虽然内皮细胞收缩、变圆,胞体变小,细胞间隙增宽,但细胞边界尚清楚,形状亦有一定规则,细胞彼此仍然相连,部分细胞有脱落现象,说明仅有少量细胞出现坏死、死亡,其各项指标与正常状态已有区别,同时其抑制率约为35%,此时施加保护因子来抑制细胞损伤最佳。
形态学观察和MTT法测定结果表明,Lot、Lien、ISO和Nef对正常ECV304的细胞形态和活性均无影响;Lot为100 μmol/L,以及Lien、Iso和Nef均为0.1 μmol/L时,对H2O2致损内皮细胞活性有较好的缓解作用,此时细胞活性分别为H2O2损伤组的112.8%、129.3%、125.6和118.2%(P<0.01或0.05)。4种生物碱在上述剂量时对H2O2致损内皮细胞形态的改善作用与阳性药卡托普利基本相近,除Lot的作用稍差外,Lien、Iso和Nef均可使受损内皮细胞的细胞间隙缩小,细胞彼此相连增强,细胞边界变清晰。比色法测定结果还表明,Lien、ISO和Nef均可提高H2O2致损内皮细胞的NO浓度(P<0.05);且这4种莲子心生物碱均可增加损伤内皮细胞的NOS活性(P<0.05)。
综上所述,莲心季铵碱、莲心碱、异莲心碱和甲基莲心碱(特别是后3者)对H2O2诱导的内皮细胞损伤有一定的保护作用,其作用机制可能是通过增加NOS生成提高血管内皮细胞释放NO,从而发挥保护内皮的功能。
[1] Schmieder RE.Endothelial dysfunction:how can one intervene at the beginning of the cardiovascular continuum?[J].J Hypertens Suppl,2006,24 (2):S31-35.
[2] Callaghan MJ,Ceradini DJ,Gurtner GC.Hyperglycemiainduced reactive oxygen species and impaired endothelial progenitor cell function[J].Antioxid Redox Signal,2005,7 (11-12):1476-1482.
[3] 曲政军,李运伦. 中医药保护血管内皮细胞作用机制的研究进展[J].中西医结合心脑血管病杂志,2008,6(3):320-323.
[4] 李娟,夏延斌. 莲子心生物碱保健功能研究进展[J].粮食与油脂,2010,1:40-43.
[5] 张弦,潘扬. 植物莲中生物碱类成分的研究概况[J].南京中医药大学学报(自然科学版),2002,18(6):382-384.
[6] 张京梅,李鹏跃,王岚,等.莲子心总生物碱的提取分离及药效学初步研究[J].中国实验方剂学杂志,2009,15(6):26-28.
[7] 潘扬,杨光明,蔡宝昌,等.莲心季铵碱的结构解析与鉴定[J].中草药,2004,35(5):501-03.
[8] 潘扬,杨光明,蔡宝昌. 核磁共振谱分析莲子心中酚性生物碱的结构[J].南京中医药大学学报(自然科学版),2005,21(6):371-373.
[9] 吴远明,贾菊芳,李勇军,等. 甲基莲心碱对氧自由基损伤血管内皮细胞的保护作用[J].中国药理学与毒理学,1997,11(1):27-30.
[10] 张赛丹,彭振宇,刘韶,等. 甲基莲心碱对LPC诱导内皮细胞损伤的保护作用及与ADMA的关系[J].中国中药杂志,2008,33(21):2526-2529.
[11] 李桂林,梁尚栋. 甲基莲心碱对糖尿病血管内皮细胞和交感神经节损伤的作用及机理研究[D].南昌:南昌大学,2011.
[12] 赵翔,张沙,肖军军,等. RPMI-1640和DMEM培养基中肝癌细胞系BEL-7402与HepG-2的生长状态比较[J].中国组织工程研究与临床康复,2011,15(11):2002-2005.
[13] Suda K,Rothen-Rutishauser B,Gunthert M,et al.Phenotypic characterization of human umbilical vein endothelial (ECV304) and urinary carcinoma (T24) cells:endothelial versus epithelial features[J].In Vitro Cell Dev Biol Anim,2001,37 (8):5055-5014.
[14] 吴其夏,邱劲.ECV304细胞可作为一般模型、工具或靶用于生物医学和药学研究[J].中国病理生理杂志,2004,20 (1):139-142.
[15] 李菊玲,曾耀英,季煜华,等. nanoLC-ESI/MS/MS在ECV304细胞蛋白质组学研究中的应[J].中国病理生理杂志,2009,25(1):205-208.
(编校:吴茜)
Protective effects of four alkaloids of embryo loti on H2O2-induced oxidative damage of vascular endothelial cells
ZHANG Yu-ling,YANG Guang-ming,LI Ping, PAN YangΔ
(School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210046, China)
ObjectiveTo observe protective effects of four active liposoluble alkaloids of a Chinese herb, lotusine (Lot), liensinine (Lien), isoliensinine (Iso) and neferine (Nef) of embryo loti (the green embryo), against H2O2-induced oxidative damage on human umbilical vascular endothelial cell ECV-304.MethodsThe protective effects of Lot, Lien, Iso and Nef on the survival of normal and oxidatively damaged ECV 304 cells were studied by cell morphology observation and 3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyl tetrazolium (MTT) assay. The levels of nitric oxide (NO) and nitric oxide synthase (NOS) were measured using colorimetric assay.ResultsLot, Lien, Iso and Nef did not affect cell morphology and cell viability of normal ECV 304 cells. The survival of oxidative damaged vascular endothelial cells was rescued by incubating with Lot at 100 μmol/L, and Lien, Iso and Nef at 0.1 μmol/L. The proliferative activity of medicated groups increased to 112.8%, 129.3%, 125.6 and 118.2%, respectively (P<0.01 or 0.05), relative to that of the group with H2O2induced oxidative damage. The four alkaloids restrained oxidative injury of endothelial cells induced by H2O2and the protective influences were similar with captopril, which served as a positive control. Each alkaloid except Lot reduced intercellular space and increased the connections of oxidative damaged cells, concomitant with more recognizable cell borders. Lien, Iso and Nef also increased the concentration of NO (P<0.05). Besides, all of the four alkaloids activated NOS in damaged vascular endothelial cells (P<0.05).ConclusionThe four alkaloids of embryo loti, especially Lien, Iso and Nef, have certain protective effects against H2O2-induced oxidative damage on vascular endothelial cells. The protective mechanism may be promotion of NO release through the increase of NOS production.
lotusine; liensinine; isoliensinine; neferine; vascular endothelial cells; H2O2-induced oxidative damage
国家自然科学基金(81373295);江苏省高校优势学科建设工程资助项目(ysxk-2014)
张玉玲,女,硕士在读,研究方向:中药化学与生物技术研究,E-mail:95794608@qq.com;潘扬,通讯作者,男,博士、研究员、博士生导师,研究方向:生物制药及中药作用机理,E-mail:y.pan2006@163.com。
R932
A
1005-1678(2015)03-0001-05
