莲子心化学成分及其抑制蛋白二硫键异构酶活性研究
2017-08-30杨勇李希珍张庆贺卢丹
杨勇 李希珍 张庆贺+卢丹
[摘要]蛋白质二硫键异构酶既能抑制肿瘤细胞凋亡,又能促进肿瘤细胞浸润转移,在肿瘤的发展进程中具有关键作用。为了研究中药莲子心是否对该酶活性有影响,该文首先对莲子心的化学成分进行了提取分离,得到12个单体化合物,其中N甲基乌药碱、山柰酚、金圣草素7O新橘皮糖苷和甘露醇为首次从该药材中分离得到。随后该文研究了莲子心中主要的生物碱成分N甲基乌药碱、莲心碱、异莲心碱和甲基莲心碱对蛋白质二硫键异构酶活性的影响,首次发现它们均具有抑制蛋白二硫键异构酶活性的作用,其中N甲基乌药碱活性最强(IC50 14 μmol·L-1)。
[关键词]莲子心; 生物碱; 蛋白二硫键异构酶; 抗肿瘤
Studies on the chemical components of Nelumbinis Plumula and
the inhibitory activity on protein disulfide isomerase
YANG Yong1, LI Xizhen1,2, ZHANG Qinghe1, LU Dan1*
(1 School of Pharmaceutical Science, Jinlin University, Changchun 130021, China;
2 Cangzhou Medical College, Cangzhou 061000, China)
[Abstract]Increasing evidence suggested that protein disulfide isomerase supported the survival and progression of several cancers Nelumbinis Plumula is a Chinese traditional herb which showed antitumor activity To find if the Nelumbinis Plumula affect protein disulfide isomerase activity, we studied its chemical constituents, and 12 monomeric compounds were isolated by means of solvent extraction, silica gel column chromatography, preparative HPLC and recrystallization Among them, Nmethylcoclaurine, kaempferol, chrysoeriol7Oneohesperidoside and mannitol were obtained for the first time Following, we tested the compounds inhibitory activity on protein disulfide isomerase The results showed that Nmethylcoclaurine, neferine, liensinine and isoliensinine could inhibit the activity of protein disulfide isomerase in vitro, their IC50 values were 14, 29, 40 and 54 μmol·L-1, respectively
[Key words]Nelumbinis Plumula; alkaloid; protein disulfide isomerase; antitumor
蛋白质二硫键异构酶(protein disulfide isomerase,PDI)是一类在内质网中催化二硫键形成、断裂、重组的氧化还原酶。研究表明PDI在淋巴癌、肾癌、卵巢癌、前列腺癌、肺癌、雄性生殖细胞癌、脑和中枢神经系统癌症中的表达显著增高[12]。PDI在肿瘤的发展进程中具有关键作用,既能抑制肿瘤细胞凋亡[35],又能促进肿瘤细胞浸润转移[67]。因此,以PDI为靶点研发新的抗癌药物日益引起重视。莲子心Nelumbinis Plumula是睡莲科水生植物莲Nelumbo nucifera Gaertn的成熟种子中的幼叶及胚根经干燥而得。为2015年版《中国药典》收录药材。研究表明,莲子心主要活性成分为生物碱类化合物[810],具有抗肿瘤[1113]、保护心血管功能[1416]、抑制肝纤维化[1718]等药理作用。本研究利用溶液萃取和硅胶柱色谱、制备高效液相色谱法和重结晶等方法对莲子心乙醇提取物中的化学成分进行了分离纯化和结构确证,共得到12个单体化合物,其中N甲基乌药碱、山柰酚、金圣草素7O新橘皮糖苷、甘露醇为首次从莲子心中分离得到。通过研究N甲基乌药碱、莲心碱、异莲心碱和甲基莲心碱对PDI活性的影响,首次发现这些苄基异喹啉类生物碱具有抑制PDI活性的作用,即进一步说明了莲子心的抗肿瘤作用机制,又为寻找新的PDI抑制劑提供了科学依据。
1材料
11仪器
Waters Model 500制备型高效液相色谱仪;Shodex R1201示差检测器,N2000色谱工作站数据处理系统;YMC半制备色谱柱(20 mm×250 mm,5 μm);WRS2A型熔点测定仪(上海轩澄仪器有限公司);ZF7 型手提式紫外检测灯(上海宝山顾村电光仪器厂);ARX600型和ARX500型核磁共振仪(德国Bruker公司);Synergy H1全功能微孔板检测仪(美国Bio Tek),Gen5 209数据分析软件,GraphPad Prism 7数据分析软件。endprint
12试药
薄层色谱硅胶G(青岛海洋化工有限公司),柱色谱硅胶(200~300目,青岛海洋化工有限公司),十八烷基硅烷键合硅胶(ODS,北京绿百草科技发展有限公司),莲心碱高氯酸盐(批号111696200501,中国食品药品检定研究院),牛肝蛋白质二硫键异构酶(P3818,Sigma),牛胰岛素(I4011,Sigma),二硫苏糖醇(DTT,D9779,Sigma),试剂为分析纯,水为纯净水。莲子心,购于长春中药批发市场,经吉林大学药学院王广树教授鉴定为莲子心。
2方法
21提取与分离
取莲子心10 kg,粉碎,用80%乙醇室温浸提3次,乙醇用量分别为10,8,8倍,浸提时间分别为48,24,24 h,合并提取液,过滤,回收溶剂至无醇味,得到莲子心提取物(21 kg)。提取物适当稀释后用石油醚萃取,回收溶剂得石油醚层(2712 g)和水层。水层浓缩至每毫升含有04 g生药,用9%盐酸溶液调节pH 1~2,静置,至析出沉淀不再增多,抽滤,得沉淀(109 g)和滤液。滤液用氨水调节pH 9~10,用氯仿萃取数次,回收氯仿得莲子心总生物碱(1062 g)。
取石油醚部分100 g,经过硅胶柱色谱分离(石油醚乙酸乙酯65∶1~1∶1),得到55个流分Fr1~55,根据TLC检测结果合并为12个组分,其中Fr7经硅胶柱色谱(石油醚氯仿60∶1~1∶1;石油醚乙酸乙酯30∶1~1∶1)和甲醇重结晶得到化合物11(197 mg)。
取总生物碱106 g,经过硅胶柱色谱(石油醚乙酸乙酯二乙胺60∶1∶1~1∶1∶1)得到98个流分,根据TLC检测结果合并成21个组分,其中Fr4经硅胶柱色谱(石油醚氯仿二乙胺60∶1∶1~1∶1∶1)和甲醇重结晶得到化合物1(204 mg);组分Fr10采用硅胶柱色谱(石油醚氯仿二乙胺60∶1∶1~1∶1∶1;石油醚乙酸乙酯二乙胺20∶1∶1~1∶1∶1)、反相硅胶柱色谱(甲醇水60∶40~100∶0)、半制备高效液相(YMC 20 mm×250 mm,5 μm;流动相甲醇水二乙胺800∶200∶01~750∶250∶01;流速10 mL·min-1;示差检测器)进行分离纯化,甲醇重结晶,得到化合物2(208 mg)、化合物3(228 mg)和化合物4(215 mg);组分Fr18经硅胶柱色谱(石油醚氯仿二乙胺60∶1∶1~1∶1∶1)和甲醇重结晶得化合物12(214 mg)。
取沉淀部分100 g,蒸馏水洗至中性,甲醇溶解,过滤,滤液浓缩至每毫升含有02 g生药,经D101型大孔树脂柱纯化,依次用蒸馏水、10%乙醇、50%乙醇洗脱,收集50%乙醇洗脱液,蒸干(685 g),经硅胶柱色谱(氯仿甲醇水40∶1∶1~1∶1∶1)得30个流分,Fr7和Fr9经甲醇重结晶得化合物10(218 mg);和化合物8(178 mg);Fr14经硅胶柱色谱(乙酸乙酯甲醇水55∶1∶1~1∶1∶1,25∶1∶1~1∶1∶1)和甲醇重结晶得化合物5(184 mg)、化合物6(225 mg)、化合物7(231 mg)、化合物9(198 mg)。
进一步研究化合物N甲基乌药碱(Nmethycoclaurine,1)、甲基莲心碱(neferine,2)、异莲心碱(isoliensinine,3)和莲心碱(liensinine,4)对PDI活性作用的影响。化合物结构式见图1。
22生物活性研究
221储备液制备
取适量牛胰岛素用01 mol·L-1 HCl溶液溶解制成浓度为13 mmol·L-1储备液,4 ℃冰箱保存。取适量DTT加去离子水制成05 mol·L-1 DTT储备液,-18 ℃冻存。含01 mol·L-1磷酸二氢钾和2 mmol·L-1 EDTA的pH 70的缓冲盐储备液,常温保存。取适量PDI加上述缓冲液制成58 g·L-1 PDI储备液,-18 ℃冻存。
222实验步骤
2221配制α溶液取1 μL DTT储备液,加水999 μL稀释至05 mmol·L-1,混匀,即得,置于冰浴中。
2222配制β溶液按照59∶1的比例,分别量取缓冲盐储备液与α溶液,混匀,即得,置于冰浴中。
2223配制γ溶液量取PDI储备液适量,加β溶液稀释至PDI浓度为16 μmol·L-1的溶液,混匀,即得,置于冰浴中。
2224配制δ溶液按照10∶1∶189的比例,依次量取胰岛素储备液、DTT储备液、β溶液,轻轻混匀至溶液澄清,即得,置于冰浴中。
2225测定取黑色底透384孔板,在垂直相邻的2个孔中分别加入β溶液39 μL,在接着垂直相邻的2个孔中分别加入β溶液31 μL,在接着垂直相邻的2个孔中分别加入γ溶液31 μL,在接着垂直相邻的孔(Sample)中分别加入γ溶液31 μL,加入个数等于供试品溶液的个数的2倍。在前3对反应中加入DMSO 1 μL,在其他反应中加入供试品溶液1 μL。37 ℃孵育1 h。取出,除第1反应的2个孔外,其余孔中分别加入δ溶液8 μL。立即置Bio Tek微孔板监测仪620 nm下测定吸光值,每5 min读数1次,检测2 h。
23实验原理
胰岛素的A,B 2条链是通过2个二硫键连接在一起的,PDI还原酶破坏二硫键,A链保持溶解状态,B链发生聚合导致吸光度(540~650 nm)增加。因此通过检测反应液吸光度可测定PDI的活性。
3结果
31PDI抑制活性
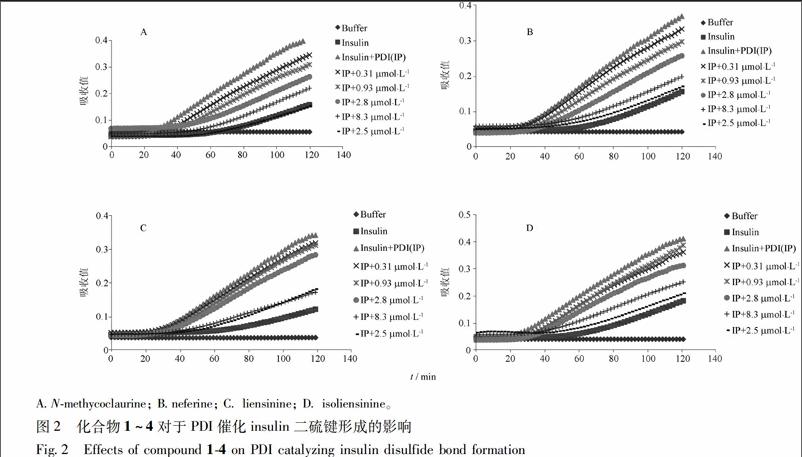
该4种生物碱均能抑制PDI活性,并且25 μmol·L-1的抑制效果都是最好,更接近只加胰岛素组的吸收值,见图1。而031 μmol·L-1时,4种生物碱抑制活性明显低于其他浓度,但依然有明顯的抑制效果。其中Nmethycolaurine组中,当浓度为25 μmol·L-1时(IP+25 μmol·L-1曲线),其吸收曲线与单纯加入insulin的曲线基本重合,表明25 μmol·L-1的Nmethycolaurine可以把实验体系中的PDI活性基本完全抑制,见图2A。当药物浓度递减时,抑制程度也递减。Neferine组中,IP+25 μmol·L-1曲线虽然没有与Insulin曲线重合,但也非常接近。可见其高浓度抑制效果较好。Liensinine组中,031,091 μmol·L-1抑制效果接近;而83 μmol·L-1曲线与25 μmol·L-1曲线几乎重合,暗示浓度超过83 μmol·L-1时,liensinine对PDI的抑制效果已经饱和。endprint
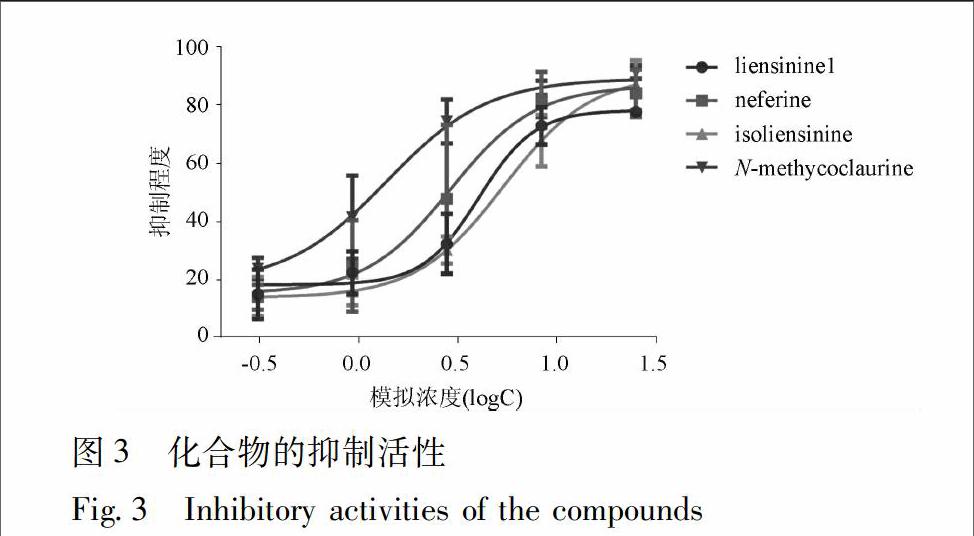
为量化上述4种生物碱在抑制PDI活性中的差异,计算上述4种生物碱分别在031,093,83,25 μmol·L-1下的抑制效率,通过5个点模拟浓度与抑制程度的曲线,见图3。其中Nmethycolaurine曲线在给定浓度下,均在其他3个曲线上方,其抑制效果最好(与图2推断一致),IC50也是4组数据中最小。根据本次实验的数据显示,4种生物碱对PDI的抑制强度由高到低可能是Nmethycoclaurine(IC50 14 μmol·L-1),neferine(IC50 29 μmol·L-1),liensinine(IC50 40 μmol·L-1)以及 isoliensinine(IC50 54 μmol·L-1)。其中Nmethycoclaurine与isoliensinine之间的差异具有统计学差异(P=003)。
32化合物提取分离和结构鉴定
本研究从莲子心乙醇提取物中分离鉴定了12个单体化合物。首次分离出N甲基乌药碱、山柰酚、金圣草素7O新橘皮糖苷以及甘露醇。
化合物1白色粉末(甲醇),mp 180~182 ℃。TLC检测,置紫外光灯(365 nm)下检视为蓝色荧光,改良的碘化铋钾为显色剂,105 ℃加热显色,日光下检视为橘黄色斑点。ESIMS m/z 300 [M+H]+。1HNMR(DMSOd6,600 MHz)δ:363(2H,m,H1),277(1H,m,H3a),313(1H,m,H3b),268(1H,m,H4a),272(1H,m,H4b),652(1H,s,H5),638(1H,s,H8),273(1H,m,H11a),302(1H,m,H11b),699(2H,d,J=84 Hz,H2′,6′),669(2H,d,J=84 Hz,H3′,5′),364(3H,s,OCH3),243(3H,s,NCH3),915(1H,s,7OH),871(1H,s,4′OH);13CNMR(DMSOd6,150 MHz) δ:641(C1),465(C3),245(C4),1144(C5),1452(C6),1443(C7),1115(C8),1303(C9),1261(C10),395(C11),1280(C1′),1301(C2′,6′),1149(C3′,5′),1551(C4′),552(OCH3),423(NCH3)。经与文献数据[19]对比,确定化合物1为N甲基乌药碱(Nmethycoclaurine)。
化合物2淡黄色粉末(甲醇),mp 59~61 ℃,易溶于甲醇、氯仿,微溶于石油醚。TCL检测,置紫外光灯(364 nm)下检视为蓝色荧光,改良的碘化铋钾为显色剂,105 ℃加热日光灯下检视为橘黄色斑点。ESIMS m/z 626 [M+H]+。13CNMR(CDCl3,150 MHz)δ:644(C1),423(2NCH3),468(C3),254(C4),1290(C4a),1111(C5),1473(C6),558(6OCH3),1483(C7),1122(C8),1303(C8a),406(C9),1317(C10),1302(C11),1132(C12),1442(C13),555(C13OCH3),1133(C14),1302(C15),647(C1′),426(2′NCH3),474(C3′),258(C4′),1257(C4′a),1110(C5′),1464(C6′),549(6′OCH3),1472(C7′),556(7′OCH3),1194(C8′),1299(C8′a),403(C9′),1298(C10′),1226(C11′),1439(C12′),1576(C13′),1171(C14′),1244(C15′)。经与文献数据[20]对比,确定化合物2为甲基莲心碱(neferine)。
化合物3淡黄色粉末(甲醇),mp 70~72 ℃,易溶于甲醇、氯仿,微溶于石油醚。TCL检测,置紫外光灯(365 nm)下检视为蓝色荧光,改良的碘化铋钾为显色剂,105 ℃加热日光灯下检视为橘黄色斑点。ESIMS m/z 612 [M+H]+。13CNMR(CDCl3,150 MHz)δ:642(C1),422(2NCH3),460(C3),249(C4),1304(C4a),1109(C5),1445(C6),549(6OCH3),1455(C7),1133(C8),1312(C8a),402(C9),1314(C10),1302(C11),1132(C12),1427(C13),552(C13OCH3),1140(C14),1302(C15),645(C1′),424(2′NCH3),469(C3′),258(C4′),1253(C4′a),1122(C5′),1433(C6′),555(6′OCH3),1453(C7′),1191(C8′),1301(C8′a),396(C9′),1316(C10′),1110(C11′),1487(C12′),1576(C13′),1157(C14′),1251(C15′)。经与文献数据[20]对比,确定化合物3为异莲心碱(isoliensinine)
化合物4白色无定形粉末(甲醇),mp 96~98 ℃,易溶于甲醇、氯仿,微溶于石油醚。以莲心碱标准品为对照,进行TLC检验。分别以3个溶剂系统展开:氯仿甲醇二乙胺(20∶1∶1)、乙酸乙酯甲醇二乙胺(18∶1∶1)和丙酮甲醇二乙胺(30∶1∶1),以改良的碘化铋钾为显色剂。化合物4色谱中,在与莲心碱对照品色谱相应的位置上,显相同颜色的斑点;置紫外光灯(365 nm)下检视,显相同的荧光斑点,Rf分别为053,039,051。因此确定化合物4为莲心碱(liensinine)。
化合物5黄色粉末(甲醇),mp 188~190 ℃。三氯化铁铁氰化钾反应阳性,提示结构中有酚羟基存在;盐酸镁粉反应阳性,Molish 反应阳性。ESIMS m/z 612 [M+H]+。13CNMR(CD3OD,125 MHz)δ:1594(C2),1356(C3),1795(C4),1632(C5),1010(C6),1663(C7),948(C8),1586(C9),1056(C10),1232(C1′),1176(C2′),1458(C3′),1499(C4′),1160(C5′),1235(C6′)1047(Glc1),787(Glc2),758(Glc3),714(Glc4),773(Glc5),685(Glc6),1024(Rha1),723(Rha2),722(Rha3),741(Rha4),689(Rha5),179(Rha6)。經与文献数据[21]对比,确定化合物5为芦丁(rutin,quercetin3Orutinoside)。endprint
化合物6黄色针晶(甲醇),mp 329~331 ℃。三氯化铁铁氰化钾反应呈阳性,提示结构中有酚羟基存在;盐酸镁粉反应呈阳性。ESIMS m/z 287[M+H]+。1HNMR(C5D5N,500 MHz)δ:694(1H,s,H3),673(2H,s,H6,H8),792(1H,d,J=25 Hz,H2′),730(1H,d,J=80 Hz,H5′),754(1H,d,J=80 Hz,H6′);DEPTQSP(C5D5N,125 MHz)δ:1659(C2),1050(C3),1838(C4),1595(C5),1009(C6),1668(C7),958(C8),1642(C9),1060(C10),1206(C1′),1156(C2′),1487(C3′),1526(C4′),1179(C5′),1240(C6′)。经与文献数据[22]对比,确定化合物6为木犀草素(luteolin,3′,4′,5,7tetrahydroxyflavone)。
化合物7黄色粉末(甲醇),mp 218~222 ℃。盐酸镁粉反应呈阳性,Molish反应呈阳性。ESIMS m/z 465[M+H]+。1HNMR(CD3OD,600 MHz)δ:622(1H,s,H6),641(1H,s,H8),761(1H,d,J=84 Hz,H2′),689(1H,d,J=84 Hz,H5′),760(1H,dd,J=84,20 Hz,H6′),527(1H,d,J=77 Hz,Glc1);13CNMR(CD3OD,150 MHz)δ:1570(C2),1342(C3),1781(C4),1616(C5),985(C6),1646(C7),933(C8),1576(C9),1043(C10),1216(C1′),1146(C2′),1445(C3′),1484(C4′),1161(C5′),1218(C6′),1029(Glc1),743(Glc2),769(Glc3),698(Glc4),767(Glc5),611(Glc6)。经与文献数据[23]对比,确定化合物7为金丝桃苷(hyperoside,quercetin3Ogalactoside)。
化合物8黄色无定形粉末(甲醇),mp 268~270 ℃。三氯化铁铁氰化钾反应阳性,提示结构中有酚羟基存在;盐酸镁粉反应阳性,Molish 反应阳性。ESIMS m/z 433[M+H]+。1HNMR(DMSOd6,600 MHz)δ:678(1H,s,H3),628(1H,s,H6),802(2H,d,J=90 Hz,H2′,6′),689(2H,d,J=90 Hz,H3′,5′),500(1H,d,J=108 Hz,Glc1),378(1H,d,J=102 Hz,Glc2),460(1H,m,Glc3),384(1H,t,J=90 Hz,Glc4),354(1H,m,Glc5),498(1H,d,J=102 Hz,Glc6),479(1H,d,J=102 Hz,Glc6);13CNMR(DMSOd6,150 MHz)δ:1644(C2),1029(C3),1826(C4),1616(C5),986(C6),1631(C7),1045(C8),1565(C9),1051(C10),1221(C1′),1294(C2′),1163(C3′),1609(C4′),1162(C5′),1294(C6′),738(Glc1),713(Glc2),791(Glc3),710(Glc4),823(Glc5),618(Glc6)。经与文献数据[24]对比,确定化合物8为牡荆苷(vitexin,apigenin8CβDglucopyranoside)。
化合物9黄色粉末(甲醇),mp 226~228 ℃。三氯化铁铁氰化钾反应阳性,提示结构中有酚羟基存在;盐酸镁粉反应阳性。ESIMS m/z 285[M-H]-。13 CNMR(DMSOd6,150 MHz)δ:1468(C2),1357(C3),1759(C4),1607(C5),982(C6),1640(C7),935(C8),1562(C9),1030(C10),1217(C1′),1295(C2′),1154(C3′),1592(C4′),1154(C5′),1295(C6′)。经与文献数据[25]对比,确定化合物9为山柰酚(kaempferol,3,4′,5,7tetrahydroxyflavone)。
化合物10淡黃色粉末(甲醇),mp 128~129 ℃,易溶于甲醇,不溶于氯仿、乙酸乙酯。三氯化铁铁氰化钾反应阳性,提示结构中含有酚羟基;盐酸镁粉反应阳性。ESIMS m/z 609[M+H]+。1HNMR(DMSOd6,600 MHz)δ:693(1H,s,H3),636(1H,d,J=24 Hz,H6),681(1H,d,J=24 Hz,H8),752(1H,d,J=24 Hz,H2′),751(1H,dd,J=90,2,4 Hz,H5′),691(1H,d,J=90 Hz,H6′),383(3H,s,3′OCH3),516(1H,d,J=78 Hz,Glc1),528(1H,d,J=60 Hz,Rha1),115(3H,d,J=66 Hz,Rha6);13 CNMR(DMSOd6,150 MHz)δ:1641(C2),1034(C3),1819(C4),1600(C5),993(C6),1625(C7),946(C8),1569(C9),1054(C10),1212(C1′),1103(C2′),1508(C3′),559(3′OCH3),1480(C4′),1157(C5′),1203(C6′),979(Glc1),771(Glc2),770(Glc3),696(Glc4),763(Glc5),604(Glc6),1004(Rha1),704(Rha2),703(Rha3),718(Rha4),682(Rha5),179(Rha6)。经与文献数据[26]对比,确定化合物10为金圣草素7O新橘皮糖苷(chrysoeriol7Oneohesperidoside)。endprint
化合物11白色无定型粉末(甲醇),溶于甲醇、乙醚等有机溶剂,不溶于水。1HNMR(CDCl3,600 MHz)δ:088(3H,t,J=78 Hz,CH3),126(26H,m,13×CH2),159(2H,br s,CH2CH2Cl),342(2H,s,CH2Cl);13CNMR(CDCl3,150 MHz)δ:178(C1),232(C2),334(C3),297(C4~13),319(C14),227(C15),141(C16)。经与文献数据[27]对比,确定化合物11为氯代正十六烷(1chlorohexadecane)。
化合物12白色斜方状针晶(甲醇),mp 166~168 ℃,易溶于水,略溶于乙醇。1HNMR(D2O,500 MHz)δ:372(4H,m,H1,6),361(2H,dd,J=10,61 Hz,H2,5)、361(2H,dd,J=130,70 Hz,H3,4)。13CNMR(D2O,125 MHz)δ:645(C1,C6),706(C2,C5),724(C3,C4)。经与文献数据[30]对比,确定化合物12为甘露醇(Dmannitol)。
4讨论
苄基异喹啉类生物碱是生物碱中一类重要生理活性极强的生物碱,因其独特的结构,在抗肿瘤方面显示了较强的活性[31]。莲子心中的生物碱属于此类生物碱,莲子心的抗肿瘤活性已有很多报道[1113],蛋白质二硫键异构酶(PDI)参与肿瘤的病理过程也已得到证实[17]。为了了解PDI是否与来源于莲子心的生物碱有相互作用,研究了莲子心中的N甲基乌药碱、莲心碱、异莲心碱和甲基莲心碱对PDI的抑制效果,其中N甲基乌药碱为首次从莲子心中分离得到。
研究发现上述4种生物碱均有抑制PDI活性的作用。通过计算IC50,发现4种生物碱对PDI的抑制强度由高到低可能是N甲基乌药碱,甲基莲心碱,莲心碱以及异莲心碱。目前数据显示N甲基乌药碱与异莲心碱之间存在显著的统计学差异(
P<005)。从化学结构上看只有N甲基乌药碱是单苄基异喹啉型生物碱,甲基莲心碱,莲心碱以及异莲心碱均为双苄基异喹啉型生物碱,但由于数据量的局限,无法确定单苄基异喹啉型生物碱对PDI抑制活性强于双苄基异喹啉型生物碱。研究表明,N甲基乌药碱等可以作为PDI活性的体外模型中的抑制剂。然而,在体内病理环境下,N甲基乌药碱能否依然抑制PDI活性而达到治疗效果还需要更多的深入研究。
[参考文献]
[1]Shili Xu, Saranya Sankar, Nouri Neamati Protein disulfide isomerase: a promising target for cancer therapy [J] Drug Discov Today, 2014, 19(3): 222
[2]Alaiya A A, Almohanna M, Aslam M, et al Proteomicsbased signature for human benign prostate hyperplasia and prostate adenocarcinoma [J] Int J Oncol, 2011, 38(4): 1047
[3]Hoffstrom B G, Kaplan A, Letso R, et al Inhibitors of protein disulfide isomerase suppress apoptosis induced by misfolded proteins [J] Nat Chem Biol, 2010, 6(12): 900
[4]Lovat P E, Corazzari M, Armstrong J L, et al Increasing melanoma cell death using inhibitors of protein disulfide isomerases to abrogate survival responses to endoplasmic reticulum stress [J] Cancer Res, 2008, 68(13): 5363
[5]Xu S, Butkevich A N, Yamada R, et al Discovery of an orally active smallmolecule irreversible inhibitor of protein disulfide isomerase for ovarian cancer treatment [J] Proc Natl Acad Sci U S A, 2012, 109(4): 16348
[6]Sipes N J, Miller D A, Bascom C C, et al Altered regulation of protein disulfide isomerase in cells resistant to the growthinhibitory effects of transforming growth factor beta 1 [J] Cell Growth Differ, 1990, 1(5): 241
[7]Khan M M, Simizu S, Suzuki T, et al Protein disulfide isomerasemediated disulfide bonds regulate the gelatinolytic activity and secretion of matrix metalloproteinase9 [J] Exp Cell Res, 2012, 318(8): 904
[8]李萍,楊光明,张玉玲,等 莲子心脂溶性生物碱的分离、鉴定 [J] 食品与生物技术学报,2016,35(1):19endprint
[9]张京梅,李鹏越,王岚,等 莲子心总生物碱的提取分离及药效学初步研究 [J] 中国实验方剂学杂志,2009,15(6):26
[10]邵建,刘艳丽,李笑然,等 莲子心化学成分的研究 [J] 中草药,2016,47(10):1661
[11]周靜,李国兵,郑怡,等 莲心碱对乳腺癌细胞MDAMB231自噬功能的影响 [J] 第三军医大学学报,2016,37(7):629
[12]徐斌,张天禹,谭宁,等 莲心碱促进膀胱癌5637细胞凋亡增强Caspase7表达及活化 [J] 天津医药,2015,43(7):724
[13]周雅君,时菁,田耕,等 甲基莲心碱体外抑制人肝癌细胞增殖和侵袭的作用机制研究 [J] 中国药理学通报,2016,32(11):1539
[14]Dong Z X, Zhao X, Gu D F, et al Comparative effects of liensinine and neferine on the human etheragogorelated gene potassium channel and pharmacological activity analysis [J] Cell Physiol Biochem, 2012, 29(3/4): 431
[15]苏伟,龚少愚,高枫,等 莲子心对不稳定心绞痛患者生活质量及基质金属蛋白酶9和基质金属蛋白酶抑制因子1 mRNA表达水平的影响 [J] 中华中医药杂志,2014,29(8):2640
[16]周代星,占成业,何雪心 甲基莲心碱对AngII诱导血管平滑肌细胞增殖及ERK /NFκB通路的影响[J] 中国新药杂志,2009,18(15):1440
[17]施京红,赵秋菊,丁辉,等 莲子心对肝纤维化大鼠的抗脂质过氧化作用研究 [J] 中药材,2016,39(8):1871
[18]刘志勇,易坚,邹小明莲子心萃取物抑制大鼠肝纤维化的作用机制研究 [J] 中国临床药理学杂志,2015,31(17):1749
[19]雷雨,吴立军,毕丹,等 野独活茎化学成分的分离与鉴定 [J] 沈阳药科大学学报,2009,26(2):104
[20]潘扬,杨光明,蔡宝昌 核磁共振谱分析莲子心中酚性生物碱的结构 [J] 南京中医药大学学报,2005,21(6):371
[21]文静,袁小红,刘卓 夹竹桃的化学成分研究 [J] 安徽农业科学,2015,43(9):65
[22]胡峻 荆芥(穗)有效部位化学成分及其质量标准研究 [D] 北京:北京中医药大学,2005
[23]赵小亮 荷叶化学成分和黄山药皂苷类化学成分及生物活性的研究 [D] 北京:北京协和医学院,2011
[24]刘旭阳 多枝雾水葛化学成分研究 [D] 广州:广东药学院,2014
[25]陈海芳 沙棘叶总黄酮提取工艺和化学成分研究 [D] 杨凌:西北农林科技大学,2006
[26]马双刚,袁绍鹏,侯琦,等 山香圆叶中黄酮苷类成分及其抗炎活性研究 [J] 中国中药杂志,2013,38(11):1747
[27]朱云,沈卫平,金红梅 正十六烷基磺酰氯的合成 [J] 合成化学,2001, 9(1):70
[28]尹伟,宋祖荣,刘金旗,等 桂花的化学成分研究 [J] 中国中药杂志,2015,40(4):679
[29]陶冉莲子心非酚性成分化学和酚性生物碱药理研究 [D] 南京:南京中医药大学,2008
[30]付东兴 罗汉果块根内生真菌及其次级代谢产物研究 [D] 南宁:广西大学,2012
[31]李学哲,朴惠顺 异喹啉类生物碱的抗肿瘤作用及机制的研究进展 [J] 华西药学杂志,2014,29(1):94
[责任编辑丁广治]endprint
