微波辅助提取莲子心多糖的工艺优化及其抗氧化活性研究
2022-08-05胡罗松郑青松文雨欣王和德杨雄志翟永贞张霞李冰
胡罗松,郑青松,文雨欣,王和德,杨雄志,翟永贞,张霞,3,李冰,3*
(1.广州酒家集团利口福食品有限公司,广东 广州 511442;2.华南理工大学食品科学与工程学院,广东 广州 510640;3.广东省天然产物绿色加工与产品安全重点实验室,广东 广州 510640)
从自然资源中分离提取出来的天然生物活性多糖因具有抗氧化[1]、抗炎[2]、降血糖[3]、提高机体免疫力[4]、抗菌[5]、抗病毒[6]、抗肿瘤[7]、调节肠道菌群[8]等生物活性而被人们广泛关注,在保健食品和医药领域具有广阔的应用前景。
莲子心(Plumula nelumbinis)为睡莲科(Nymphaeaceae)莲属植物莲(Nelumbo nucifera Gaertn.)的成熟种子中间的绿色幼叶及胚根[9]。《中国药典》收录记载:莲子心具有清心火、平肝火、清心安神等作用。莲子心多糖是莲子心中的主要化学成分之一[10],但国内外关于莲子心多糖的研究较少。目前关于莲子心多糖的提取方法主要局限于热水浸提法[11-12],新型提取方法(如超声辅助提取、酶辅助提取和微波辅助提取等)应用较少。其中微波辅助提取法(microwave-assisted extraction,MAE)是一种短时间内高效提取莲子心多糖的新型辅助提取方法[13]。多糖提取过程中常常伴随着色素类杂质。大孔树脂法常被用来去除多糖提取物中色素类杂质[14]。本文首先利用响应面优化方法对微波辅助提取莲子心多糖的工艺进行优化,然后利用大孔树脂AB-8进行莲子心多糖的脱色处理,最后对其抗氧化活性进行测定,建立一种高效提取莲子心多糖的方法,得到一种具有较好抗氧化活性的莲子心多糖,为开发天然的抗氧化产品提供了依据。
1 材料与方法
1.1 材料与仪器
干燥莲子心:湘潭莲子生产基地。利用小型中草药粉碎机进行粉碎,得到莲子心粉末备用;乙醇、苯酚、浓硫酸(均为分析纯):国药集团化学试剂有限公司;大孔树脂AB-8:上海联硕生物科技有限公司。
高速中草药粉碎机(XL-20B型):广州旭朗有限公司;微波萃取仪(Milestone Ethos):北京莱伯泰科仪器股份有限公司;旋转蒸发仪(RV 10 auto FLEX):德国IKA公司;高速冷冻离心机(3-30KS):美国Sigma公司;真空冷冻干燥机(Wizard2.0):美国VirTis公司;紫外可见分光光度计(Carry 50 Conce):美国Varian公司。
1.2 试验方法
1.2.1 莲子心多糖的提取
取粉碎后的莲子心粉末,以蒸馏水为提取溶剂,利用微波萃取仪提取得到莲子心多糖提取液,离心(6 000 r/min,5 min)、抽滤(0.45 μm 水系膜),除去微小固体杂质。减压真空浓缩后,加入4倍体积的无水乙醇,4℃条件下,放置 12 h,6 000 r/min离心 3 min,取沉淀,冷冻干燥得到莲子心粗多糖。
1.2.2 单因素试验设计
1.2.2.1 微波功率对莲子心多糖得率的影响
精确称取1 g莲子心粉末,加入25 mL去离子水[液料比 25 ∶1(mL/g)],分别在 300、400、500、600、700、800 W的功率下,微波辅助提取4 min,考察微波功率对莲子心多糖得率的影响。
1.2.2.2 液料比对莲子心多糖得率的影响
精确称取 1g莲子心粉末,分别加入 10、15、20、25、30mL 去离子水 [液料比分别为10∶1、15∶1、20∶1、25∶1、30 ∶1(mL/g)],在 600 W 下,微波辅助提取 4 min,考察液料比对莲子心多糖得率的影响。
1.2.2.3 微波时间对莲子心多糖得率的影响
精确称取1 g莲子心粉末,加入25 mL去离子水[液料比 25 ∶1(mL/g)],在 600 W 下,分别微波辅助提取 1、2、3、4、5、6 min,考察微波时间对莲子心多糖得率的影响。
1.2.3 响应面优化试验设计
在单因素试验结果的基础上,选择适合的因素水平,利用Box-Behnken试验设计进行三因素三水平响应面优化试验,试验因素和水平设计见表1。

表1 Box-Behnken试验设计因素与水平Table 1 Box-Behnken experiment design factors and level
1.2.4 大孔树脂脱色试验
参考张玉等[14]的方法,利用AB-8大孔树脂对莲子心多糖进行脱色处理。取莲子心多糖粉末,用蒸馏水配制成1 mg/mL莲子心多糖溶液。设定脱色温度40℃、脱色时间60 min、大孔树脂添加量4 g,采用单因素试验考察大孔树脂添加量(2、3、4、5、6 g/20 mL)、脱色时间(20、40、60、80、100 min)、脱色温度(30、40、50、60、70℃)对莲子心多糖脱色率和保留率的影响。
1.2.5 多糖得率测定
利用苯酚-硫酸法对多糖含量进行测定,以葡萄糖为标准品绘制标准曲线。准确称取1.000 g于105℃充分干燥的葡萄糖,溶于1 000 mL蒸馏水,制成1 mg/mL葡萄糖标准储备液。继续取1.0 mL葡萄糖储备液稀释至100 mL,得到100 μg/mL葡萄糖标准储备液。精密量取 100 μg/mL 葡萄糖标准储备液 0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mL,分别置于试管中,加蒸馏水至2 mL。加入现配的6%苯酚溶液1 mL,摇匀,再加入95%浓硫酸5 mL,充分振荡后于40℃保温20 min,冷却至25℃,利用紫外可见分光光度计在490 nm处测定吸光度。以葡萄糖浓度为横坐标,吸光度为纵坐标绘制葡萄糖标准曲线[Y=0.025 5X-0.190 7(R2=0.998 8)],依据葡萄糖标准曲线可计算样品多糖得率与纯度,计算公式如下。
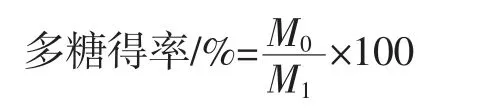
式中:M0为利用标准曲线计算得到的样品中多糖质量,g;M1为样品的质量,g。
1.2.6 抗氧化活性测定
1.2.6.1 DPPH自由基清除率的测定
参考Ma等[15]的方法并稍作修改。取脱色后的莲子心多糖,溶于蒸馏水,配制0.2 mg/mL~2.0 mg/mL的多糖溶液,用乙醇配制60 μmol/L DPPH溶液,各取150 μL多糖样品和DPPH溶液,加到96孔板,混合均匀后,暗处反应30 min,517 nm处测定吸光度。以蒸馏水代替样品做空白对照,乙醇代替DPPH作本底对照,抗坏血酸(VC)作阳性对照。DPPH自由基清除率计算公式如下。
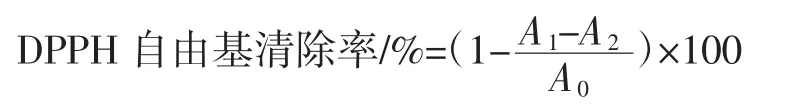
式中:A1为样品吸光度;A2为本底对照吸光度;A0为空白对照吸光度。
1.2.6.2 ABTS+自由基清除率的测定
参考Chen等[16]的方法,配制7 mmol/LABTS溶液和2.45 mmol/L过硫酸钾溶液,将二者等体积混合,置于暗处反应12 h。然后用无水乙醇稀释,直至混合溶液在734 nm处吸光度在0.70±0.05,得到ABTS工作液。取20 μL脱色后莲子心多糖溶液(0.2 mg/mL~2.0 mg/mL)与180 μL ABTS工作液混合,25℃振动孵化5 min,734 nm处测定吸光度。以蒸馏水代替样品做空白对照,乙醇代替ABTS作本底对照,VC作阳性对照。ABTS+自由基清除率计算公式如下。
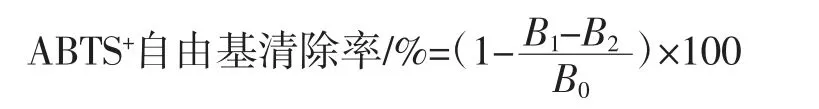
式中:B1为样品吸光度;B2为本底对照吸光度;B0为空白对照吸光度。
1.2.6.3 超氧阴离子自由基清除率的测定
参考Liang等[17]的方法,配制0.1 mol/L的Tris-HCl缓冲溶液(pH8.2),6 mmol/L的邻苯三酚溶液。取30 μL脱色后的莲子心多糖溶液(0.2 mg/mL~2.0 mg/mL),加入150 μL缓冲溶液,25℃反应10 min,VC作为阳性对照。之后加入30 μL配制好的邻苯三酚溶液,325 nm处测定吸光度(30 s测定一次,持续5 min)。超氧阴离子自由基清除率计算公式如下。
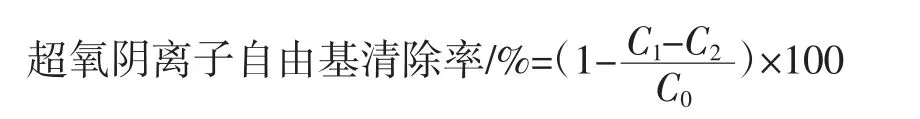
式中:C0为邻苯三酚自氧化后的吸光度;C1为加入样品后的吸光度。
1.2.7 数据处理
以上所有试验至少重复3次,试验结果采用平均值±标准差表示。所有数据均采用IBM SPSS 22.0进行统计分析,不同组数据采用单因素方差分析,并使用Origin 9.0软件进行绘图。显著性水平为p<0.05。
2 结果与分析
2.1 多糖提取单因素试验结果
2.1.1 微波功率对莲子心多糖得率的影响
设定液料比为 25∶1(mL/g)、微波时间为 4 min,在300 W~800 W内,考察微波功率对莲子心多糖得率的影响,结果如图1所示。
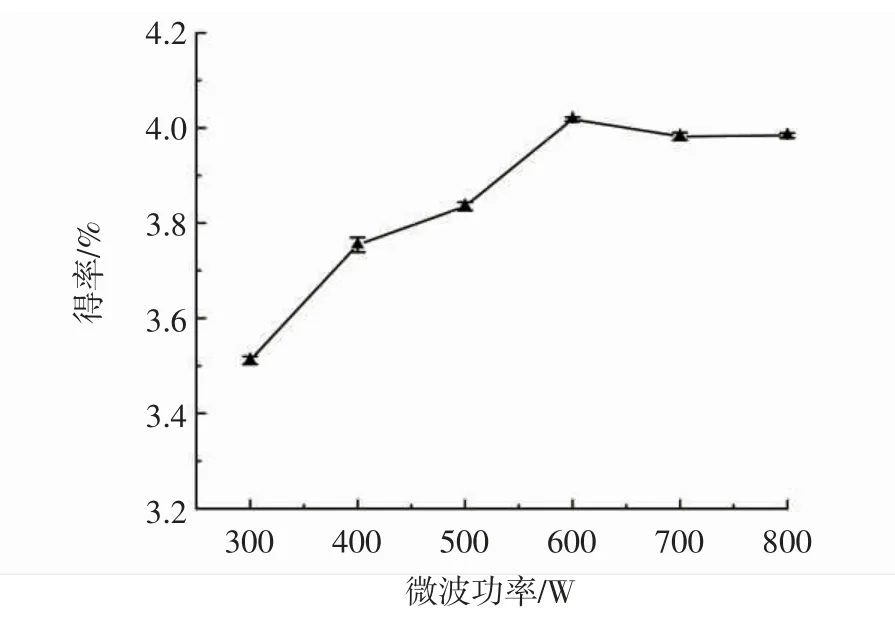
图1 微波功率对多糖得率的影响Fig.1 The influence of microwave power on the yield of polysaccharide
如图1所示,随着微波功率的增加,莲子心多糖得率逐渐上升,到600 W时得率最高,之后继续增加微波功率,莲子心多糖得率变化趋势平稳。提高微波功率,有利于促进多糖的渗出及扩散,但是微波功率达到一定时,多糖的渗出与扩散达到平衡,这时即使继续增加微波功率也难以促进多糖的提取。所以,微波辅助提取莲子心多糖的功率选择600 W较为适宜。
2.1.2 液料比对莲子心多糖得率的影响
设定微波功率为600 W、微波时间为4 min、在液料比 10∶1(mL/g)~30 ∶1(mL/g)内,考察液料比对莲子心多糖得率的影响,结果见图2。
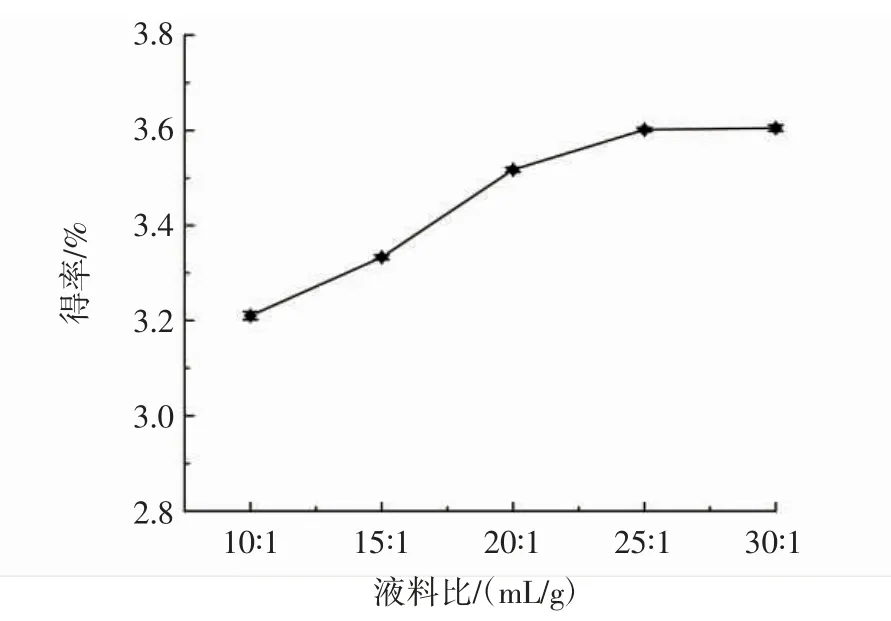
图2 液料比对多糖得率的影响Fig.2 The influence of liquid-to-material ratio on the yield of polysaccharide
如图2所示,随着溶剂体积不断增大,莲子心多糖得率呈逐步上升的趋势,在液料比大于25∶1(mL/g)时,多糖得率的变化趋势趋于平缓。溶剂体积增加,有利于增加多糖浓度差,可促进多糖的扩散。但是,当多糖的扩散达到平衡时,再增加溶剂体积作用也不大,反而会增加后续浓缩工艺的压力。因此,莲子心多糖的液料比选择25∶1(mL/g)较合适。
2.1.3 微波时间对莲子心多糖得率的影响
设定微波功率为600 W、液料比为25∶1(mL/g)、在微波时间1 min~6 min内考察微波时间对莲子心多糖得率的影响,结果见图3。

图3 微波时间对多糖得率的影响Fig.3 The influence of microwave time on the yield of polysaccharide
如图3所示,随着微波时间的延长,莲子心多糖得率上升趋势明显,在4 min时达到最大值,在4 min~6 min多糖得率基本不变。因此,考虑减少能量损耗和高效提取的目的,提取莲子心多糖的微波时间在4 min左右较为合适。
2.2 响应面试验结果与分析
2.2.1 响应面试验结果
根据单因素试验结果,利用Box-Behnken试验设计进行三因素三水平响应面优化,表2为试验设计及结果。
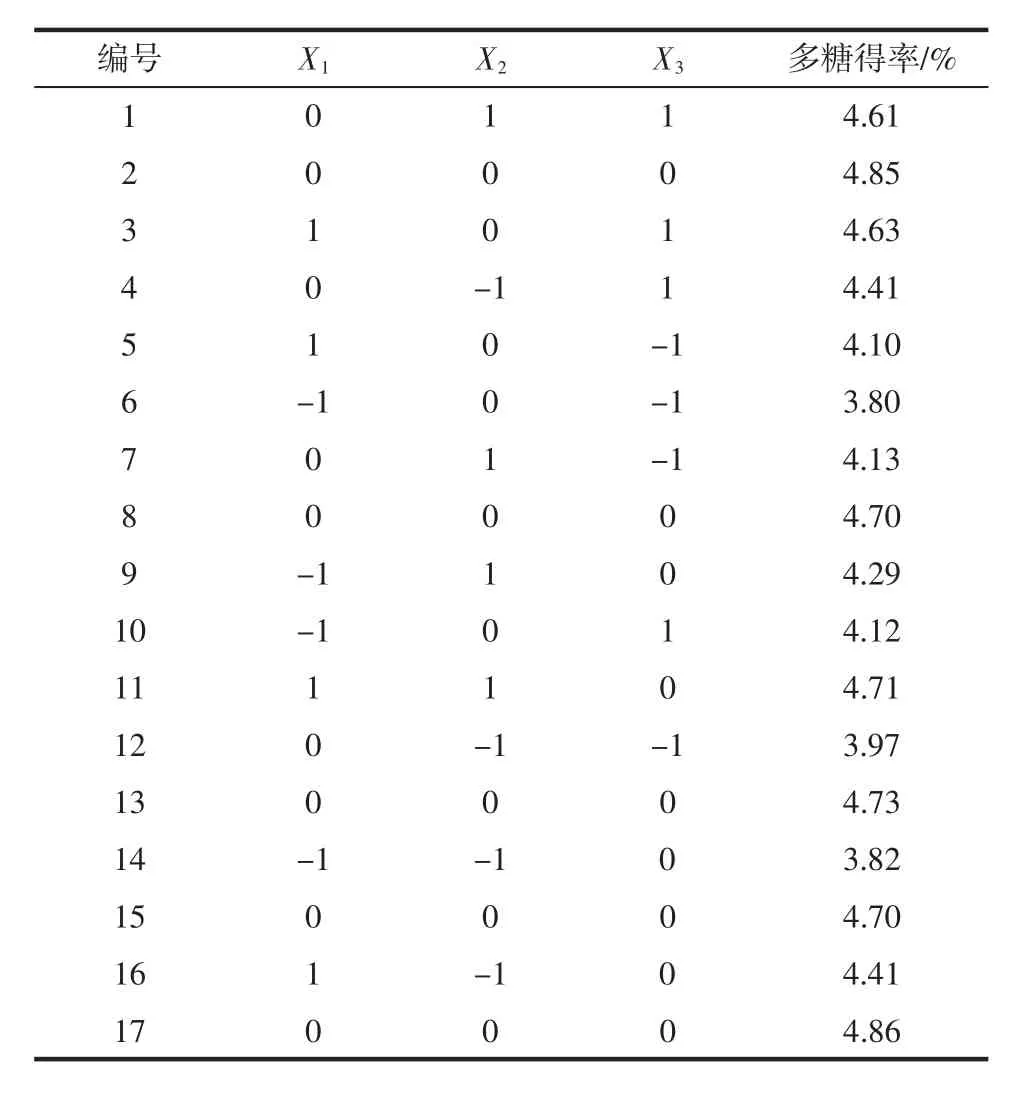
表2 Box-Behnken试验设计及结果Table 2 Box-Behnken experiment design and results
通过多项式回归分析得到一个二次多项式,可用来预测微波辅助提取莲子心多糖的得率,回归方程为Y=4.77+0.23X1+0.14X2+0.22X3-0.044X1X2+0.053X1X3-0.009 5X2X3-0.29X12-0.17X22-0.32X32。
方差分析和多元回归分析如表3所示。
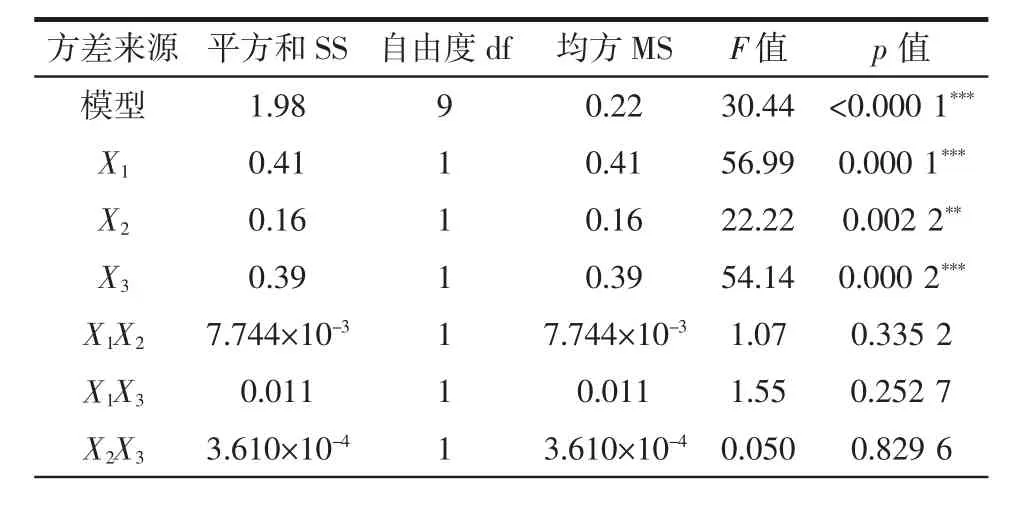
表3 回归模型的方差分析Table 3 Analysis of variance table for regression model
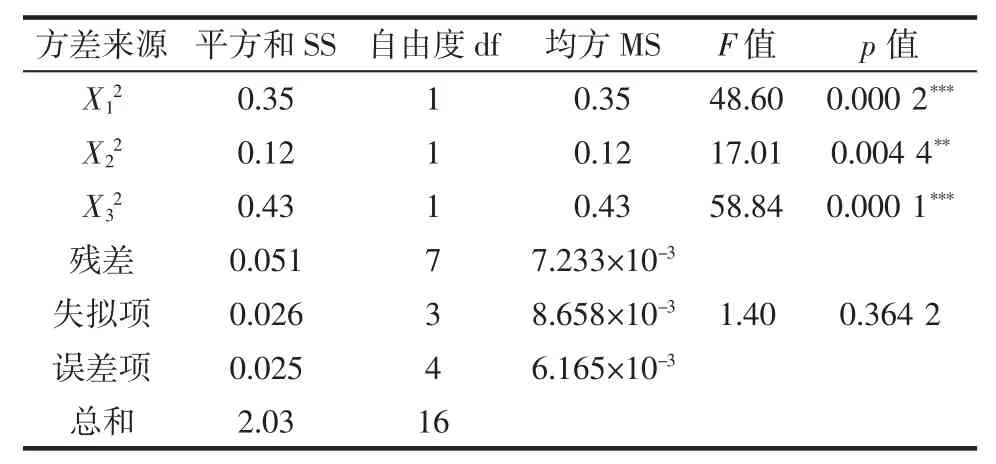
续表3 回归模型的方差分析Continue table 3 Analysis of variance table for regression model
由表3可知,模型的F值为30.44,p值小于0.001,说明模型建立具有显著性,并且模型的失拟项p>0.05,不显著,说明可以通过该模型来预测微波辅助提取莲子心多糖的最优提取条件。在回归模型中,X1、X3、X12、X32对莲子心多糖得率的影响高度显著,X2、X22对莲子心多糖得率影响极显著,而X1X2、X1X3、X2X3影响不显著,说明3种因素本身均对莲子心多糖得率有较大影响,但3种因素间的交互作用并不显著。
2.2.2 响应面分析
响应面和等高线图见图4。

图4 微波功率、液料比和微波时间对莲子心多糖得率影响的响应面和等高线图Fig.4 Response surfaces plots and contour plots showing the effects of microwave power,liquid-solid ration,extraction time,on the Plumula nelumbinis polysaccharide yield
由图4可知,液料比和微波时间均对得率有较大影响,在28∶1(mL/g)和4.5 min附近时有最大得率,等高线图呈现不明显的椭圆状,结合方差分析结果,二者之间相互作用并不显著。在微波功率为680 W、微波时间为4.5 min时有最大得率,等高线图为圆形,结合方差分析结果可知微波功率和微波时间相互作用不显著。在液料比28∶1(mL/g),微波功率680 W时有最大的多糖得率,但二者的等高线图呈圆形,说明料液比和微波功率相互作用不显著。
2.2.3 响应面试验模型的验证
模型中最优工艺条件为微波时间4.517 min、微波功率 680.73 W、液料比 28.48∶1(mL/g),在此条件下多糖得率为4.81%。考虑实际操作情况,将此工艺条件修正为微波时间4.5 min、微波功率680 W、液料比28∶1(mL/g),修正后的多糖得率为(4.84±0.11)%,与预测值4.81%的相对误差为0.62%,验证结果表明模型建立成功,并且此提取工艺合理可靠。
2.3 大孔树脂脱色试验
2.3.1 大孔树脂添加量对莲子心多糖脱色率和保留率的影响
大孔树脂添加量对莲子心多糖脱色率和保留率的影响见图5。
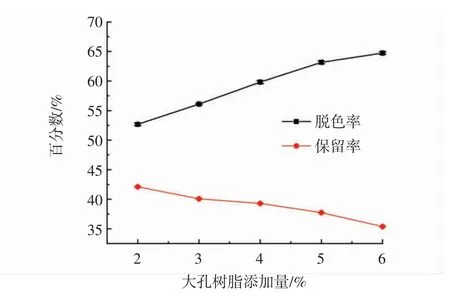
图5 大孔树脂添加量对莲子心多糖脱色率和保留率的影响Fig.5 The effect of macroporous resin addition on the decolorization rate and retention rate of Plumula nelumbinis polysaccharide yield
如图5所示,随着大孔树脂添加量的增加,吸附色素能力增强,莲子心多糖的脱色率逐渐增加,但同时多糖的保留率逐渐降低。因此,综合考虑多糖脱色率和保留率,选取大孔树脂添加量为4 g。
2.3.2 脱色时间对莲子心多糖脱色率和保留率的影响
设定脱色温度为40℃、大孔树脂添加量为4 g,在脱色时间20 min~100 min内,考察脱色时间对脱色率和多糖保留率的影响,结果见图6。

图6 脱色时间对莲子心多糖脱色率和保留率的影响Fig.6 The effect of decolorization time on the decolorization rate and retention rate of Plumula nelumbinis polysaccharide yield
如图6所示,莲子心多糖的脱色率随着脱色时间的延长逐渐增加,同时多糖保留率也随着脱色时间的延长而降低,因此,为保证莲子心多糖一定的脱色率和保留率,选定脱色时间为60 min。
2.3.3 脱色温度对莲子心多糖脱色率和保留率的影响
设定脱色时间为60 min、大孔树脂添加量为4 g,在脱色温度30℃~70℃内,考察脱色温度对莲子心多糖脱色率和保留率的影响,结果见图7。

图7 脱色温度对莲子心多糖脱色率和保留率的影响Fig.7 The effect of decolorization temperature on the decolorization rate and retention rate of Plumula nelumbinis polysaccharide yield
如图7所示,随着脱色温度的升高,莲子心多糖的脱色率平缓上升,同时多糖保留率也随着温度的升高逐渐降低。因此,为保证莲子心多糖一定的脱色率和保留率,脱色温度选取50℃。
经过单因素试验后,确定适宜的莲子心多糖大孔树脂AB-8脱色工艺条件为20 mL,1 mg/mL的莲子心多糖大孔树脂添加量4 g、脱色时间60 min和脱色温度50℃。脱色率达到(65.12±0.88)%,多糖损失率为(30.33±0.58)%。
2.4 莲子心多糖的抗氧化活性测定结果
2.4.1 DPPH自由基清除能力
莲子心多糖的DPPH自由基清除能力结果见图8。
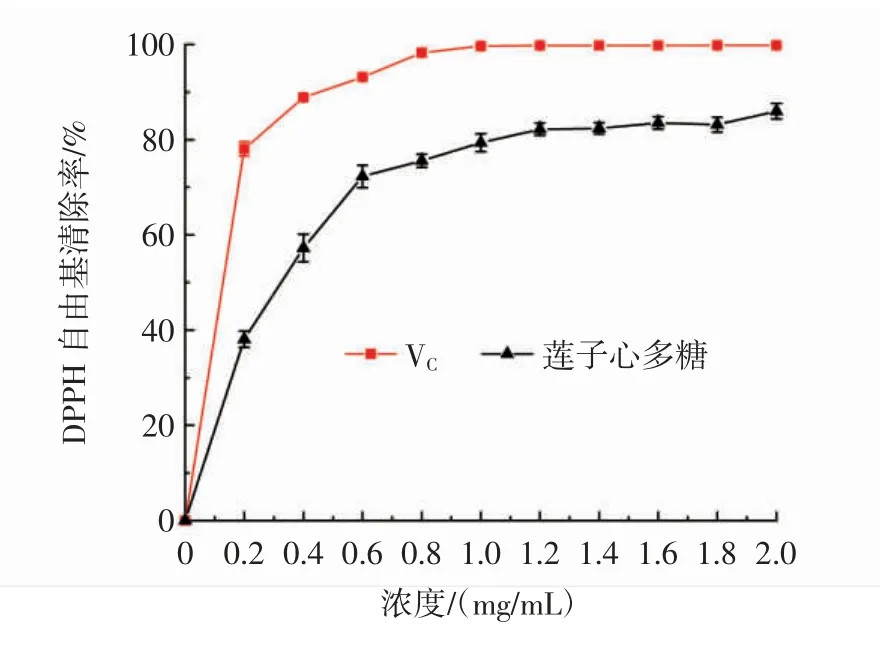
图8 莲子心多糖的DPPH自由基清除率Fig.8 DPPH radical scavenging ability of Plumula nelumbinis polysaccharide
如图8所示,在0.2 mg/mL~2.0 mg/mL内,随着浓度的增加,莲子心多糖清除DPPH自由基的能力不断增大。在浓度为2.0 mg/mL时,莲子心多糖的DPPH自由基清除率达到最大值(86.01±1.63)%,可见,莲子心多糖具有良好的DPPH自由基清除能力。此结果高于Khan等[18]从Porphyra haitanensis提取的多糖浓度为2 mg/mL时对DPPH自由基的清除率(34.63%)。
2.4.2 ABTS+自由基清除能力
莲子心多糖的ABTS+自由基清除能力见图9。
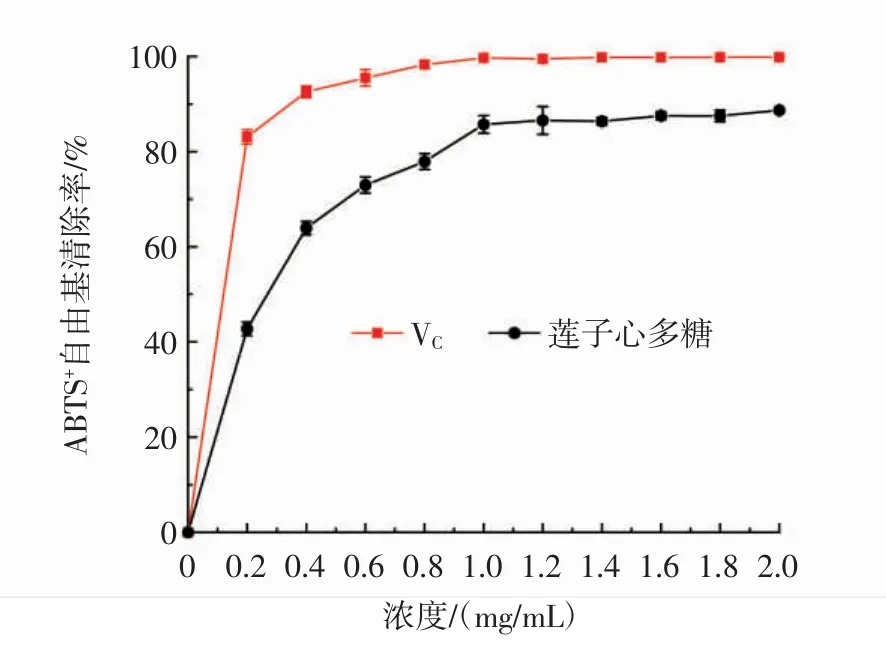
图9 莲子心多糖的ABTS+自由基清除率Fig.9 ABTS+radical scavenging ability of Plumula nelumbinis polysaccharide
如图9所示,在0.2 mg/mL~2.0 mg/mL内,莲子心多糖表现出良好的ABTS+自由基清除能力,并随着样品浓度的增加呈上升趋势。莲子心多糖的IC50值为0.23 mg/mL,在样品浓度为2.0 mg/mL时,莲子心多糖的 ABTS+清除率达到(88.67±0.47)%,高于部分其他来源的多糖,如Gu等[19]从Sagittaria sagittifolia L.中提取的多糖(浓度为5.0 mg/mL时,对ABTS+自由基清除率为91.19%)。
2.4.3 超氧阴离子自由基清除能力
莲子心多糖的超氧阴离子自由基清除能力见图10。
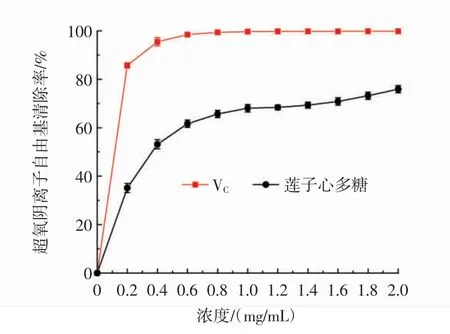
图10 莲子心多糖的超氧阴离子自由基清除能力Fig.10 Superoxide radical scavenging ability of Plumula nelumbinis polysaccharide
如图10所示,在0.2 mg/mL~2.0 mg/mL内,随着浓度的增大莲子心多糖的超氧阴离子自由基清除率升高,其IC50值为0.28 mg/mL。在样品浓度为2.0 mg/mL时,莲子心多糖的超氧阴离子自由基清除率达到最高值为(75.92±1.51)%。以上结果说明莲子心多糖的具有较好的超氧阴离子自由基清除能力,并且清除能力高于Chen等[20]从Bletilla striata须根中提取得到的多糖(浓度为5.0 mg/mL时,对超氧阴离子自由基清除率为72.27%)。
3 结论
经过响应面优化后,微波辅助提取莲子心多糖的最佳工艺为微波时间4.5 min、微波功率680 W、液料比28∶1(mL/g),此时的多糖得率为(4.84±0.11)%。单因素优化后的大孔树脂脱色工艺为大孔树脂添加量4 g、脱色时间60 min、脱色温度50℃。所得莲子心多糖对DPPH自由基、ABTS+自由基和超氧阴离子自由基清除率的IC50值分别为0.28、0.23 mg/mL和0.28 mg/mL。在样品浓度为2.0 mg/mL时,莲子心多糖的DPPH自由基清除率达(86.01±1.63)%,ABTS+自由基清除率达(88.67±0.47)%,超氧阴离子自由基清除率达(75.92±1.51)%,说明莲子心多糖具有良好的DPPH自由基、ABTS+自由基和超氧阴离子自由基清除能力。本研究结果提供了一种高效提取莲子心多糖的方法并为莲子心多糖作为功能性原料用于食品提供了理论数据和技术支持。
