复方半边莲凝胶制备工艺优化
2015-07-07陈琼王海燕余红霞李青青杨俊杰
陈琼,王海燕,余红霞,李青青,杨俊杰
(信阳农林学院 信阳市中药资源开发工程技术研究中心 信阳市中药质量分析检测重点实验室,河南 信阳 464000)
复方半边莲凝胶制备工艺优化
陈琼,王海燕,余红霞,李青青,杨俊杰Δ
(信阳农林学院 信阳市中药资源开发工程技术研究中心 信阳市中药质量分析检测重点实验室,河南 信阳 464000)
目的 考察影响复方半边莲凝胶制备工艺的各因素,确定复方半边莲凝胶最佳制备工艺条件。方法 在单因素实验基础上,以成型性、涂展性、稳定性的综合作用为指标,采用正交试验设计对卡波姆-940用量、载药量、5%羟苯乙酯乙醇溶液和三乙醇胺用量进行考察,并用高效液相色谱法测定所制凝胶中野黄芩苷的含量。结果 确定复方半边莲凝胶最佳处方工艺为:以0.25 g卡波姆-940为凝胶基质,2 g 10%月桂氮卓酮无水乙醇溶液为促渗剂,1.0 g三乙醇胺为pH调整剂、0.4 g甘油为保湿剂、0.3 g 5%羟苯乙酯乙醇溶液为防腐剂;载药量为每1 g凝胶含1 g饮片。结论 复方半边莲凝胶制备工艺简便,质地均匀细腻,稳定性良好。
复方半边莲;凝胶;工艺;正交试验
复方半边莲凝胶由半边莲、半枝莲、白花蛇舌草组成。现代药理研究证实半边莲[1]、半枝莲[2]、白花蛇舌草[3-5]对金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌均有明显的抑制或杀灭作用。复方半边莲具有较好的α-葡萄糖苷酶抑制、抗氧化和抗菌活性[6]。复方半边莲注射液抗菌消炎作用明确[7]。文献[8-10]报道含有半边莲、白花蛇舌草的制剂可以治疗隐翅虫皮炎。目前尚未见复方半边莲用于皮肤外科的报道,本实验利用其抗菌活性对其剂型进行改革,采用超声提取[11],通过正交试验将其制备成外用给药的凝胶剂,不但克服了复方半边莲注射液的不良反应[12-16],而且填补了国内复方半边莲凝胶剂型的空白,扩大了复方半边莲临床应用范围。
1 材料与方法
1.1 药品与试剂 半边莲(LobeliachinensisLour.),半枝莲(PortulacagrandifloraHook.),白花蛇舌草(HedyotisdiffusaWilld.)购于信阳市药材站(鉴定人余运平,高级工程师,河南同源制药有限公司),野黄芩苷标准品(含量测定用,含量>98%,中国食品药品检定研究所,批号110842-201106)。卡波姆940(廊坊聚通化工有限公司,批号20120116),甲醇为色谱纯,乙醇、三乙醇胺、羟丙乙酯、甘油、月桂氮卓酮等均为分析纯,纯化水自制。
1.2 仪器 Agilent1100高效液相色谱仪,VWD紫外检测器,Agilent化学工作站(安捷伦科技有限公司);ZSBB-712 恒温水浴(上海智城分析仪器制造有限公司),AB-135-S型电子天平(梅特勒.托利多仪器(上海)有限公司);PB602-S电子天平(梅特勒.托利多仪器(上海)有限公司);101AS-2电热恒温干燥箱(上海实验仪器有限公司),UPT-I-100L优普超纯水机。
1.3 复方半边莲浸膏的制备 将半边莲、半枝莲、白花蛇舌草挑拣淘洗后105 ℃烘干,备用。以上3味,各取50 g,加饮用水浸泡30 min,于超声提取仪中超声提取两次,设定提取条件为:超声功率400 W,料液比1:15(第1次加水10倍饮片量,第2次加水5倍饮片量),超声时间30 min(第1次20 min,第2次10 min)[11],合并提取液,滤过,滤液浓缩至1︰1,加等量95%乙醇,静置12 h,滤过,滤液回收乙醇并浓缩至稠膏状(约50 g),即得。
1.4 复方半边莲凝胶的制备 20 g复方半边莲凝胶剂中,促透剂10%月桂氮卓酮无水乙醇溶液按常用量2 g、保湿剂甘油按常用量0.4 g投料。本实验对凝胶质量较大影响因素的凝胶基质用量、pH调整剂用量、防腐剂用量及载药量进行优选。
取卡波姆-940适量,加入甘油0.4 g搅拌均匀使其全部润湿,加入纯化水适量使完全溶胀,得空白凝胶,备用。另取适量提取物,加入含0.3 g 5%羟苯乙酯乙醇溶液和2 g 10%月桂氮卓酮无水乙醇溶液,混匀。将提取物溶液加入到空白凝胶中,搅拌使其分布均匀后,加入三乙醇胺调节pH至6.5~7.0,搅拌均匀,即得含药凝胶。
1.4.1 复方半边莲凝胶基质的选择:按凝胶制备总量为20 g,分别称取凝胶基质卡波姆-940 0.10、0.20、0.25、0.30、0.35 g于小烧杯中,加入甘油0.4 g搅拌均匀使其全部润湿,加入纯化水适量使完全溶胀,得空白凝胶,备用。另称取适量提取物(按每1 g凝胶含饮片1 g计),加入适量5%羟苯乙酯乙醇溶液和2 g 10%月桂氮卓酮无水乙醇溶液,混匀。将提取物溶液加入到空白凝胶中,搅拌使其分布均匀后,加入三乙醇胺调节pH至6.5~7.0,搅拌均匀,即得含药凝胶。
以含药凝胶的成型性、涂展性、稳定性为指标,将制得的凝胶置洁净白色透明玻璃容器中并密封,于室温下放置0、15、30 d后进行考察。
1.4.2 复方半边莲凝胶载药量的选择:固定卡波姆0.25 g、三乙醇胺1.0 g、甘油0.4 g、10%月桂氮卓酮无水乙醇溶液2 g、5%羟苯乙酯乙醇溶液0.3 g,按照上述凝胶制备方法制成20 g。同法制成5份,分别使载药量为0.5、1.0、1.5、2.0、2.5 g/g,搅匀。以成型性、涂展性、稳定性为指标,将制备得到的凝胶置白色透明玻璃容器中并密封,于室温下放置0、15、30 d后进行考察。
1.4.3 复方半边莲凝胶防腐剂的选择:固定载药量为1 g/g(每g含药凝胶中含饮片1 g),卡波姆0.25 g、三乙醇胺1.0 g、甘油0.4 g、10%月桂氮卓酮无水乙醇溶液2 g,按照上述凝胶制备方法制成凝胶20 g,同法制成5份,分别加5%羟苯乙酯乙醇溶液0、0.2、0.3、0.4、0.5 g,搅匀。
以细菌数、霉菌数和酵母菌作为考察指标,将制得的凝胶置无菌白色透明玻璃容器中并密封,于室温下放置0、30 d后,按薄膜过滤法[17]检查。
1.4.4 复方半边莲凝胶pH调整剂的选择:按照上述凝胶制备方法,分别加入0.6、0.7、0.8、1.0、1.2 g的三乙醇胺,搅拌均匀,得不同三乙醇胺用量的复方半边莲凝胶。分别取各凝胶约1.0 g置小烧杯中,加纯化水适量,搅匀,转移至10 mL量瓶中,超声20 min,放凉后,用纯化水定容。离心,滤过,取续滤液测定pH值。
1.4.5 复方半边莲凝胶正交试验设计:在上述单因素试验基础上,选取卡波姆940用量(A)、载药量(B)、5%羟丙乙酯乙醇溶液用量(C)和三乙醇胺用量(D)为考察因素,按L9(34)正交表进行试验,综合评分标准[18]见表1,正交因素水平表见表2。采用综合评分法对正交试验数据进行分析。

表1 凝胶综合评分标准Tab.1 The comprehensive scoring criteria of gel

表2 正交试验因素-水平表Tab.2 Factor-level table of orthogonal experiment
1.5 复方半边莲凝胶验证试验 按优选的制备工艺条件制备总量为20 g凝胶3批:称取凝胶基质卡波姆-940 0.25 g置小烧杯中,加入甘油0.4 g,搅拌均匀使其全部润湿,加入纯化水适量使完全溶胀,得空白凝胶,备用。另称取适量提取物(按每1 g凝胶含饮片1 g计),加入5%羟苯乙酯乙醇溶液0.3 g和10%月桂氮卓酮无水乙醇溶液2 g,混匀。将提取物溶液加入到空白凝胶中,搅拌使其分布均匀,加入1.0 g三乙醇胺,搅拌均匀,即得。
1.6 复方半边莲凝胶的质量控制
1.6.1 性状:按照1.5项下中方法制备复方半边莲凝胶。
1.6.2 鉴别:取本品3 g,加稀盐酸1 mL,用石油醚(60~90 ℃)振摇提取2次,每次10 mL,弃去石油醚液,水溶液用氨试液调节pH至9~10,用三氯甲烷振摇提取2次,每次10 mL,合并提取液,蒸干,残渣加三氯甲烷1 mL使溶解,作为供试品溶液。另取半边莲对照药材2 g,加饮用水100 mL,超声提取20 min,滤过,滤液浓缩至10 mL,用氨试液调节pH值至9~10,同法制成对照药材溶液。照薄层色谱法(中国药典2010年版一部附录VI B)试验,吸取上述2种溶液各10 μL,分别点于同一硅胶G薄层板上,以甲苯-丙酮-乙醇-氨水(4:2:0.6:0.4)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。
1.6.3 检查:按照凝胶剂项下的方法操作[17]。
1.6.4 含量测定:按复方半边莲注射液含量测定项下方法[19]测定:取本品3 g,精密称定,置小烧杯中,加20%甲醇超声使溶解,转移至25 mL容量瓶中,用20%甲醇反复冲洗小烧杯,将冲洗液转移至容量瓶中,并用20%甲醇定容,摇匀,以微孔滤膜(0.45 μm)滤过,取续滤液,测定野黄芩苷的含量。
2 结果
2.1 复方半边莲凝胶制备
2.1.1 复方半边莲凝胶基质的选择:于室温下放置15 d、30 d后与0 d比较,以0.25 g卡波姆为基质,所得的含药凝胶易涂展,黏稠度适中,成型性好。见表3。

表3 凝胶基质成型性考察结果Tab.3 The formability results of gel matrix at different content
2.1.2 复方半边莲凝胶载药量的选择:于室温下放置15 d、30 d后与0 d比较,以载药量1.0 g/g所得的含药凝胶易涂展,黏稠度适中,成型性好、质量稳定。见表4。

表4 载药量考察结果Tab.4 The experiment results of different drug-loading rate
2.1.3 复方半边莲凝胶防腐剂的选择:于室温下放置30 d后与0 d比较,以0.3 g、0.4 g和0.5 g的5%羟苯乙酯乙醇溶液为防腐剂,所得的含药凝胶稳定。见表5。
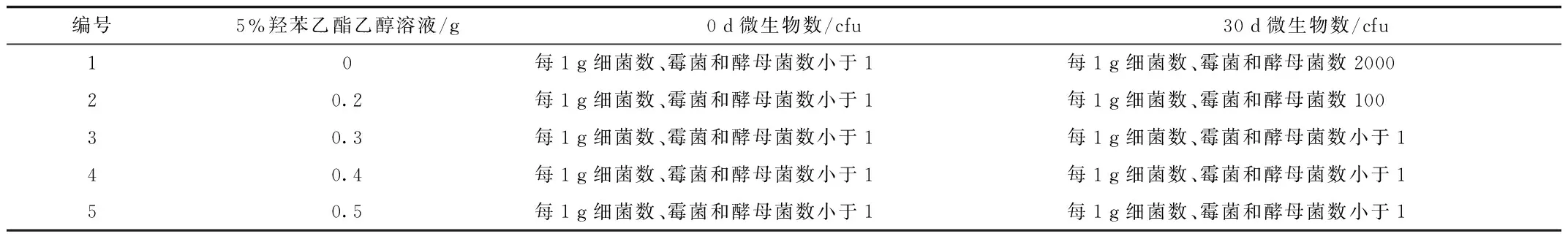
表5 防腐剂考察结果 Tab.5 The experiment results of preservatives at different content
2.1.4 复方半边莲凝胶pH调整剂的选择:复方半边莲凝胶pH调整剂的选择结果表明:1.0 g的三乙醇胺调节pH凝胶成型性良好,且易涂展。
2.1.5 复方半边莲凝胶正交试验设计:由表6、表7分析结果可知,复方半边莲凝胶中各因素对复方半边莲凝胶影响的主次顺序为:A> B>C>D,即卡波姆-940和载药量为主要影响因素,且具有显著性,三乙醇胺影响最小。确定的最佳工艺条件为A1B2C1D2,即以卡波姆-940 0.25 g、载药量1 g/g(即每1 g凝胶含饮片1 g)、5%羟苯乙酯乙醇溶液0.3 g、三乙醇胺1.0 g、制备的凝胶成型性能好、易涂展、质量稳定。

表6 正交设计试验结果Tab.6 The results of orthogonal experiment

表7 方差分析表Tab.7 Analysis of variance table
F0.05(2,2)=19.00 F0.01(2,2)=99.00
按优选的工艺制备的3批凝胶,放置30 d后,其外观均匀、细腻,易涂展,成型性良好,微生物限度检测均符合规定。
2.2 复方半边莲凝胶的质量控制
2.2.1 性状:本品为棕红色半固体凝胶。
2.2.2 鉴别:①供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。②在含量测定项下记录的色谱图中,供试品主峰的保留时间应与对照品峰的保留时间一致。
2.2.3 检查:结果符合凝胶剂项下的有关规定[17]。
2.2.4 含量测定:按优选的工艺制备的3批凝胶野黄芩苷含量分别为8.77 mg/g,9.12 mg/g,9.02 mg/g,平均含量8.97 mg/g,每g饮片相当于野黄芩苷8.97 mg,远远高于复方半边莲注射液标准规定中的每g饮片相当于野黄芩苷0.27 mg。
3 讨论
中药凝胶剂一般由中药提取物与基质构成制剂处方,影响凝胶剂成型的因素有载药量、基质的用量、保湿剂的用量,以及pH调整剂的用量等。本实验以3个指标的综合作用进行评价,采用单因素试验及正交试验设计系统考察了影响凝胶质量的工艺条件,制备出复方半边莲凝胶。复方半边莲凝胶具有制备简单,使用、携带方便的优点,提高了患者的依从性。
卡波姆(carbomer)为丙烯酸键合烯丙基蔗糖或季戊四醇烯丙醚的高分子聚合物[20]。最早由美国Goodrich公司生产,商品名为卡波普(Carbopol)[21],中国药典2000年版开始收载[22]。卡波姆是pH型凝胶基质[23],卡波姆水溶液的pH为2.5~3.5,而卡波姆只有在pH大于5,才有一定的黏性,通常采用pH调整剂为三乙醇胺和氢氧化钠,但氢氧化钠为强碱,对皮肤有刺激性,所以本试验选择弱碱性的三乙醇胺为pH调整剂[24],且pH控制在6.8~7.0较好。卡波姆940具有易于涂展、黏附性好、易清洗、无油腻感、能吸收组织渗出液、对皮肤无刺激性等特点,常作为凝胶剂骨架材料被广泛用于缓控释经皮制剂的制备,其用量会直接影响凝胶黏度和药物的释放,一般选用质量分数0.5%~2.0%[25]。处方中选用0.4 g甘油为保湿剂、2g10%月桂氮卓酮无水乙醇溶液为促透剂。
本研究中载药量对凝胶的成型性能影响较大,可能是药物的有效成分影响了卡波姆的成型性且改变了凝胶系统的pH,当载药量大于1.5 g/g时,卡波姆用量达0.35 g,三乙醇胺用量达1.2 g,成型性能仍不理想。
按优选工艺条件制备的复方半边莲凝胶外观、涂展性、稳定性等均符合规定,作为新剂型,还需对其刺激性、药物的透皮吸收、药物的体外抗菌作用进行相关考察。
[1] 姜艳艳,石任兵,刘斌,等.半边莲黄酮类化学成分研究[J].北京中医药大学学报,2009,32(1):59-61.
[2] 王桂玲,房建强,边书芹,等.半枝莲中总生物碱的提取及抑菌作用的初步研究[J].中成药,2013,35(6):1315-1319.
[3] 蒋丹,王关林.22种中草药抑菌活性的研究[J].辽宁高职学报,2003,5(4):140-141,146.
[4] 边才苗.白花蛇舌草提取物的抑菌作用研究[J].时珍国医国药,2005,16(10):991-992.
[5] 王宇翎,张艳,方明,等.白花蛇舌草总黄酮的抗炎及抗菌作用[J].中国药理学通报,2005,21(3):348-350.
[6] 石磊,王俊霞,李园园,等.复方半边莲生物活性研究[J].中国实验方剂学杂志,2010,16(16):57-61.
[7] 李枝端.复方半边莲注射液抗菌消炎作用明确[N].中国社区医师,2012-9-9(12).
[8] 芩桂芹.半边莲外用治疗隐翅虫皮炎[J].新医学,1987,24(2):41.
[9] 刘彦,梁瑜,曾桥,等.自制莲黄苏打液治疗隐翅虫皮炎394例[J].皮肤科与性病,2002,24(1):41-42.
[10] 彭国英.双花解毒汤合季德胜蛇药片治疗隐翅虫皮炎12例[J].实用中西医结合临床,2004,4(2):50.
[11] 陈琼,李丹,周纪磊.纤维素酶协同超声波法提取复方半边莲注射液的工艺优选[J].中国实验方剂学杂志,2014,20(7):13-15.
[12] 严远质.复方半边莲注射液静滴致严重过敏2例[J].药物不良反应杂志,2005,7(1):44.
[13] 于泳,曲广洪.复方半边莲注射液致过敏反应1例[J].基层医学论坛,2006,10(4):337.
[14] 谭晓黎,慈红丽.复方半边莲注射液致过敏反应4例分析[J].齐鲁药事,2005,24(7):442.
[15] 陈美明,周敏.肌注复方半边莲注射液致过敏性休克1例[J].中国麻风皮肤病杂志,2004,20(1):90.
[16] 李娜,于福文.复方半边莲注射液致过敏性休克1例[J].中国临床药学杂志,2004,13(6):377.
[17] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010,附录79,附录12.
[18] 李娜,买尔丹·马合木提.新疆紫草提取物凝胶剂的制备及质量考察[J].中国实验方剂学杂志,2011,17(1):14-17.
[19] 国家食品药品监督管理局.国家药品标准[S].北京:人民卫生出版社,2002:WS-10609(ZD-0609)-2002.
[20] 国家药典委员会.中华人民共和国药典(第一增补本)[M].北京:中国医药科技出版社,2013,519.
[21] 卢毅,张彤木,陶建生.卡波姆在药剂学中的应用[J].中国医药工业杂志,2007,38(6):457-460.
[22] 国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2000,133.
[23] Merclin N,Bramer T,Edsman K.Iontophoretic delivery of 5-aminolevulinic acid and its methyl ester using a carbopol gel as vehicle[J].J Control Release,2004,98(1):57-65.
[24] Rathapon A,Sirivat A,Vayumhasuwan P,Viscoelastic propertycs of carbopol 940 gels and their relationships to piroxicam diffusion coefficients in gel bases[J].Pharmaleutical Research,2005,22(12):2134-2140.
[25] 徐和,戴领,沈成英,等.苦参碱凝胶剂的制备及体外释药特性考察[J].中国实验方剂学杂志,2014,20(1):8-11.
(编校:王俨俨)
Optimization of compound lobelia gel in preparation process
CHEN Qiong,WANG Hai-yan,YU Hong-xia,LI Qing-qing,YANG Jun-jieΔ
(Xinyang Key Laboratory of Xinyang Engineering Research Center for the Exploitation of Chinese Medicine Resources, Detection and Analysis of Chinese Medicine, Xinyang College of Agriculture and Forestry, Xinyang 464000, China)
ObjectiveTo study the factors which affect the preparation of compound lobelia gel and establish the optimal preparation process.MethodsBased on single factor test, formability, spread performance, stability were used as comprehensive evaluation indicators to select the preparation process by orthogonal design, taking the dosage of carbopol-940, drug loading, 5% hydroxy ethyl benzene ethanol solution and triethanolamine as factors. The content of scutellarin in gel was determined by HPLC.ResultsThe best prescription of compound lobelia gel was as follows: substrat of carbopol-940 was 0.25 g, 10% Azone for promoting the permeability was 2 g, pH regulator of triethanolamine was 1.0 g, moisturizer of glycerol was 0.4 g; preservatives of 5% ethylparaben ethanol solution was 0.3 g; the drug loading was 1 g processed herbs per 1 g gel.ConclusionThe preparation process of compound lobelia gel is simple, the product is texture and delicate stable.
compound lobelia; gel; preparation process; orthogonal test
河南省科技攻关项目(132102310266)
陈琼,女,学士,副教授,研究方向:主要为中药制药新技术,E-mail:599299467@qq.com;杨俊杰,通迅作者,男,硕士,副教授,研究方向:主要为中药化学,E-mail:285385557@qq.com。
R283.6
A
1005-1678(2015)03-0162-04
