二甲双胍调节自噬改善大鼠局灶性脑缺血后焦虑样行为
2015-07-07王晓先李飞张硕徐月华
王晓先,李飞,张硕,徐月华
(1.解放军第456医院 药械科,山东 济南 250031;2.解放军第456医院 神经内科,山东 济南 250031)
二甲双胍调节自噬改善大鼠局灶性脑缺血后焦虑样行为
王晓先1,李飞2,张硕2,徐月华2
(1.解放军第456医院 药械科,山东 济南 250031;2.解放军第456医院 神经内科,山东 济南 250031)
目的 探讨二甲双胍对大鼠局灶性脑缺血后焦虑和自噬途径的影响。方法 将大鼠分为7组:假手术组、缺血组、二甲双胍组、化合物C组、化合物C+缺血组、二甲双胍+缺血组、二甲双胍+化合物C+缺血组。二甲双胍和化合物C分别在大鼠局灶性脑缺血手术前14 d、30 min给药。记录缺血再灌注72 h后大鼠模型的血糖、体质量、神经行为学评分及高架十字迷宫系统指标。Western blot检测大鼠海马部位自噬相关基因Atg-7、Atg-5、beclin-1蛋白的表达。结果 二甲双胍对大鼠的体质量和血糖无显著影响。预先给予二甲双胍可使缺血组大鼠神经行为学评分显著提高(P<0.01)。高架下十字迷宫实验结果显示,预先给予二甲双胍可使缺血组大鼠开臂滞留时间百分比显著提高(P<0.01),但对进入开臂次数无显著影响。Western blot结果显示,预先给予二甲双胍可使缺血组大鼠自噬相关蛋白Atg-7、Atg-5、beclin-1蛋白表达显著高于缺血组(P<0.001)。化合物C抵抗二甲双胍的上述作用(P<0.01)。结论 二甲双胍通过调节自噬能改善大鼠局灶性脑缺血引起的心理和运动障碍。
二甲双胍;局灶性脑缺血;焦虑;自噬
二甲双胍是2型糖尿病患者常用药物。其主要作用机制是激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK),属于细胞内能量传感器激酶[1]。AMPK在许多神经退行性疾病中的作用已经明确,比如:脑缺血、亨廷顿病和阿尔茨海默病[2-3]。二甲双胍通过磷酸化AMPK调节氧化应激和神经退行性疾病中神经元的下游信号通路[4]。
与人脑缺血类似,大鼠脑缺血后也会出现运动改变、焦虑样行为和神经功能缺如[5]。二甲双胍可在改善氧化应激反应后认知障碍和焦虑中发挥重要作用[6]。但是二甲双胍在脑缺血性损伤中的作用仍然不明确。自噬是通过自噬溶酶体系统对自身细胞质内异物、损伤和衰老细胞器进行吞噬降解的过程。而自噬相关基因包括:Atg5、Atg7、Atg12、beclin-1。研究证明[7],在正常和应激情况下,AMPK信号通路调节自噬发挥相应的作用。研究显示[8],自噬与脑缺血后行为学改善具有一定的联系。本研究旨在探讨二甲双胍是否通过调节自噬改善大鼠脑缺血引起的焦虑和神经功能缺失。
1 材料与方法
1.1 材料
1.1.1 实验动物:42只健康成年雄性Wistar大鼠(8周龄),体质量280~300g,购自济南市金丰实验动物繁殖有限公司,许可证号为SCXK(鲁)2014-0006。
1.1.2 药品和试剂:盐酸二甲双胍片购于白云山汤阴东泰药业有限责任公司(国药准字H41020541);化合物C(AMPK抑制剂)购于上海浩然生物科技有限公司;兔抗Atg7、Atg5、beclin-1多克隆抗体和鼠抗β-actin多克隆抗体(美国Sigma公司);山羊抗兔和山羊抗鼠的二抗(北京中杉金桥生物技术有限公司);BCA蛋白定量试剂盒(美国Pierce公司);ECL显色剂(美国Amersham Bioscience公司);戊巴比妥钠(上海哈灵生物试剂检测中心)。
1.1.3 仪器:大小鼠高架十字迷宫(YH-EPM/R,武汉一鸿科技有限公司);血糖检测仪(德国罗氏公司);凝胶成像仪扫描系统(美国伯乐公司生产,型号GEL Doc XR+);红外线测温仪(德国欧普士Optris微小型红外测温仪CS micro);SDS-PAGE电泳(北京君意东方电泳设备有限公司生产,型号SCZ2+)。
1.2 方法
1.2.1 分组:采用数字表法将大鼠分为7组,每组6只,分别为:假手术组、缺血组、二甲双胍组、化合物C组、化合物C+缺血组、二甲双胍+缺血组、二甲双胍+化合物C+缺血组。二甲双胍和化合物C分别在大鼠局灶性脑缺血手术前14 d、30 min给药。在处理前各组大鼠体质量差异无统计学意义。
1.2.2 大鼠局部脑缺血再灌模型制备:参照文献方法[9]制备大鼠局部脑缺血再灌模型,二甲双胍(生理盐水溶解为浓度20 mg/mL)在手术前14 d以200 mL/kg剂量腹腔注射;化合物C(PBS溶解为浓度4 mg/mL)均在手术前30 min以40 mL/kg剂量腹腔注射。手术方法如下:3%戊巴比妥钠腹腔麻醉大鼠(35 mg/kg),自颈部行1 cm长的正中切口,暴露胸锁乳突肌。手术显微镜下暴露左侧颈动脉鞘并游离出颈总动脉、颈外动脉及颈内动脉,然后用5/0缝合丝线双重结扎颈总动脉近心端和颈外动脉远心端;在颈总动脉上两线结间打一松结并轻轻提起以阻断血流,在颈外动脉远端的动脉壁上用针头扎一个小口,将制备好的线栓从小孔插入颈总动脉至颈内动脉并进而向上到达大脑中动脉,固定线栓,将下颌下腺归位,30 min后拔出线栓,缝合皮肤。假手术组只进行手术操作,不插入线栓。缺血再灌注后72 h进行行为学检测。。
1.2.3 行为学检测:缺血后再灌72 h,根据文献报道方法采用神经残疾状态表(neurological disability status scale,NDSS)[10]进行神经行为学评分。0分:无明显神经行为学改变;2分:低反应性、轻度的活动减少;4分:机体张力和肌肉强度降低,扁平姿势,侧的姿势,共济失调步态,中度活动减少;6分:转圈,颤撞,前肢屈曲,活动明显减少,轻度运动失调等;8分:重度运动失调,呼气窘迫,重度活动减少;10分:死亡;其他:将靠近以上标准的神经行为学症状分别定义为1、3、5、7、9分。分值越高,损伤程度越严重。
1.2.4 血糖和体质量检测:手术前及缺血再灌注后72 h,检测大鼠的体质量,尾静脉采血并用血糖检测仪检测血糖。
1.2.5 高架十字迷宫实验:高架十字迷宫实验参照文献方法[11],将缺血再灌72 h的大鼠放于迷宫中央,头朝开臂,观察者距离迷宫中心至少1 m。分别记录实验期内(30 min)大鼠进入开臂和闭臂的次数和在两臂滞留的时间(进出臂标准应该严格界定,以四肢全部入臂或两前肢为准)。计算大鼠进入开臂次数和在开臂滞留时间分别占总次数(进入开臂或闭臂次数之和)与总时间(在开臂与闭臂滞留时间之和)的百分比,以此作为评价焦虑的指标。通常两指标间呈高度正相关。如果某药物增加大鼠对开臂的偏爱,而不改变入臂总次数,则认为某药有抗焦虑作用。
1.2.6 Western blot分析:采用改良的 Pulsineli 4血管阻断(4-VO)法制作大鼠全脑缺血模型,大鼠缺血30 min后松口动脉夹,进行再灌注,同时采用红外线测温仪监测耳内鼓膜温度。行为学检测后,提取缺血大鼠海马区总蛋白,按10 mL/g比例加入全细胞裂解液,BCA法进行蛋白定量,然后进行SDS-PAGE电泳,然后转移到PVDF膜上。经5%牛奶孵育1 h后,并用磷酸盐缓冲液(PBS-T)洗膜3次,每次5 min。用兔抗Atg7、Atg5、beclin-1多克隆抗体(1:1000)和鼠抗β-actin多克隆抗体(1:5000)常温孵育3 h,PBS-T洗3次,每次5 min。用山羊抗兔和山羊抗鼠的二抗(1:5000),室温孵育1 h。PBS-T洗3次,每次5 min。洗膜后用凝胶成像仪扫描系统检测,以β-actin为内参,应用图像分析软件Quantity one®1-D进行吸光度分析。

2 结果
2.1 二甲双胍对脑缺血大鼠生理参数的影响 与假手术组相比,缺血组大鼠的体质量和血糖无明显变化。预先给予二甲双胍也未影响大鼠的体质量和血糖,且二甲双胍+缺血组大鼠的体质量和血糖也无显著改变。见表1。

表1 缺血再灌注72 h后各组体质量和血糖变化±s)Tab.1 Changes of body mass and blood glucose level at 72 h after ischemia ±s)
2.2 二甲双胍对脑缺血大鼠神经功能的影响 缺血组大鼠神经行为学评分显著低于假手术组(P<0.01)。预先给予二甲双胍可使缺血组大鼠神经行为学评分显著提高(P<0.01)。化合物C组神经行为学评分与假手术组比较差异无统计学意义。二甲双胍+化合物C+缺血组神经行为学评分与缺血组比较差异无统计学意义,而二甲双胍+缺血组神经行为学评分显著高于二甲双胍+化合物C+缺血组(P<0.01)。见表2。

表2 缺血再灌注72 h后各组神经行为学评分比较±s)Tab.2 Comparison of neurological scores of each group at 72 h after ischemia ±s)
***P<0.001,与假手术组比较,compared with sham group;##P<0.01,与缺血组比较,compared with I/R group;△△P<0.01,与二甲双胍+缺血组比较,compared with metformin+I/R group
2.3 二甲双胍影响脑缺血大鼠焦虑样行为 高架下十字迷宫实验结果显示,缺血组开臂滞留时间百分比显著高于假手术组(P<0.001),但缺血组进入开臂次数百比分无显著变化。二甲双胍+缺血组开臂滞留时间百分比显著高于缺血组(P<0.01),但二甲双胍+缺血组进入开臂次数无显著变化。二甲双胍或化合物C(AMPK抑制剂)组对开臂滞留时间无显著影响。化合物C预处理削弱二甲双胍在缺血组中的抗焦虑作用,使进入开臂次数百分比显著降低(P<0.01)。见图1。

图1 高架十字迷宫实验结果(n=6)**P<0.01;***P<0.001,与假手术组比较;##P<0.01,与缺血组比较;△△P<0.01,与二甲双胍+缺血组比较Fig.1 Result of elevated plus maze test(n=6)**P<0.01;***P<0.001,compared with sham group;##P<0.01,compared with I/R group;△△P<0.01,compared with metformin + I/R group
2.4 二甲双胍对脑缺血大鼠海马自噬蛋白的影响 Western blot检测缺血大鼠海马自噬蛋白Atg-7、Atg-5、beclin-1的表达结果显示,缺血组Atg-7、Atg-5、beclin-1蛋白表达显著低于假手术组(P<0.001),而二甲双胍+缺血组自噬相关蛋白的表达又显著高于缺血组(P<0.001)。二甲双胍组和化合物C组中自噬相关蛋白的表达与假手术组比较差异无统计学意义。二甲双胍+化合物C+缺血组自噬相关蛋白的表达显著低于二甲双胍+缺血组(P<0.01)。见图2。
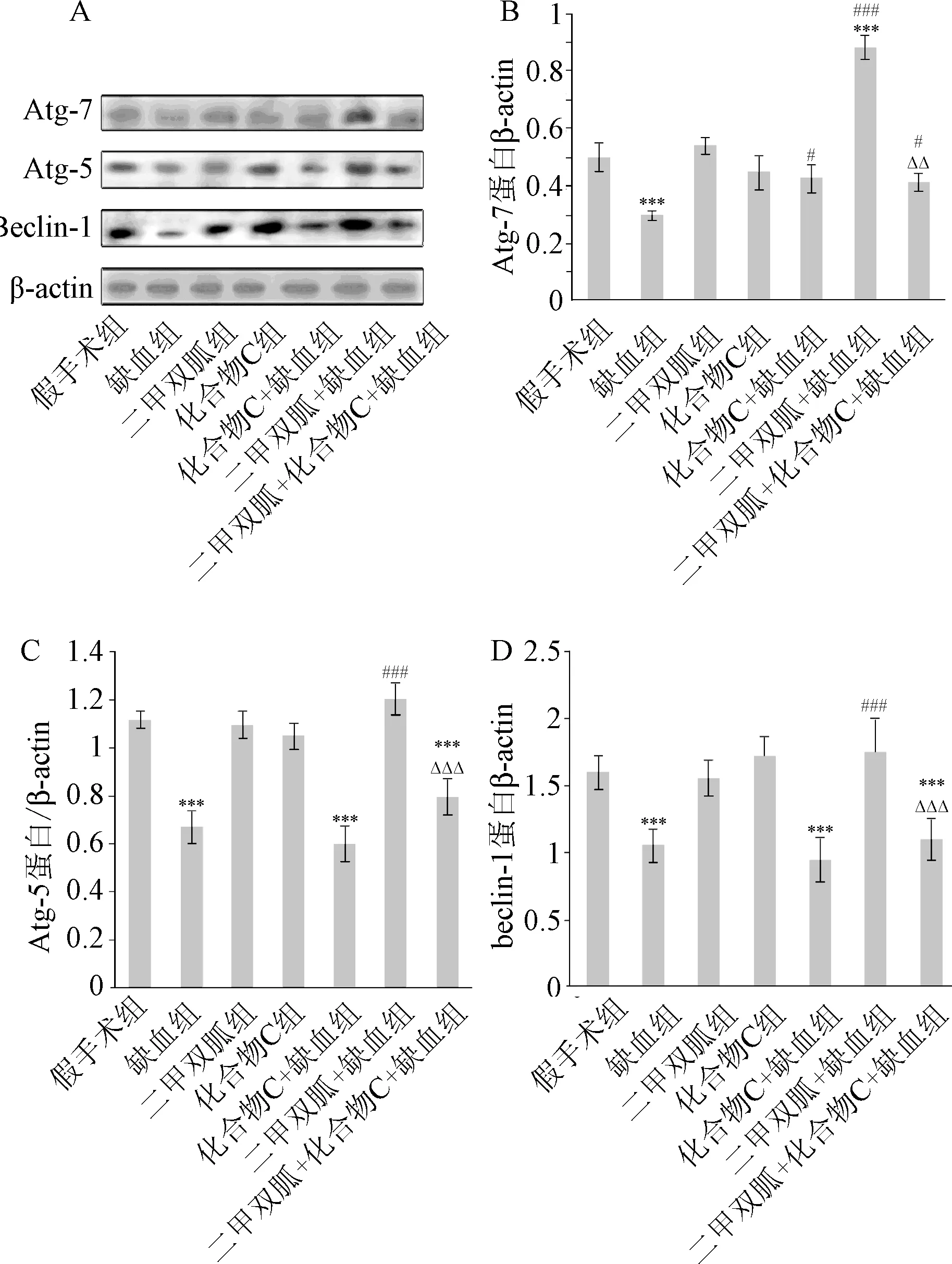
图2 Western blot分析各组自噬相关蛋白表达(n=6)***P<0.001,与假手术组比较;#P<0.05,###P<0.001,与缺血组比较;△△△P<0.001,与二甲双胍+缺血组比较Fig.2 Expression of autophagy-related protein analysed by Western blot of each group(n=6)***P<0.001,compared with sham group;#P<0.05,###P<0.001,compared with I/R group;△△△P<0.001,compared with metformin + I/R group
3 讨论
脑缺血可以导致海马CA1区严重凋亡和坏死,海马区是大脑最容易受到损伤的部位[2]。海马区是边缘系统的一部分,参与情绪、感觉和认知的调节。二甲双胍在神经退行性疾病中的保护作用已经明确。能够减轻糖尿病大鼠局灶性脑缺血焦虑样行为和感觉运动评分[12]。本研究显示,预先给予二甲双胍可使缺血组大鼠神经行为学评分显著提高(P<0.01),开臂滞留时间百分比显著提高(P<0.01),而化合物C减弱二甲双胍的神经保护作用。二甲双胍预处理可以缓解大鼠脑缺血引起的神经功能缺失和焦虑样行为。
为了阐明大鼠的生理状态,本课题组人员检测各组大鼠的体质量和血糖。各组间体质量和血糖无差异性变化。Girbovan等[13]研究表明脑缺血发作时对血糖无影响。因为缺血时最易受到损伤的是海马区,而不是下丘脑,下丘脑调节食欲和血糖。二甲双胍可以降低糖尿病患者的血糖[14],但是本研究中二甲双胍对假手术组和缺血组血糖均无影响。也有研究报道二甲双胍在14d治疗期间对非糖尿病局灶性脑缺血小鼠的血糖无影响[15]。因而,下一步需要评价不同剂量的二甲双胍对局灶性脑缺血小鼠长期血糖的影响。
多年来一直认为激活的自噬引起细胞死亡。然而,自噬也可在保护性途径中激活。研究证实,AMPK、丝裂原活化蛋白激酶和Akt调节保护作用的自噬[16-17]。Ashabi等[2]激活AMPK诱导缺血损伤后海马神经元的自噬。本研究结果显示,预先给予二甲双胍可使缺血组大鼠自噬相关蛋白Atg-7、Atg-5、beclin-1蛋白表达显著高于缺血组(P<0.001)。本研究假设二甲双胍通过调节AMPK发挥神经保护作用,发现二甲双胍增强缺血性大鼠的自噬功能,而AMPK抑制剂化合物C抵消二甲双胍的作用。此结果提示,二甲双胍通过激活AMPK发挥作用,而激活AMPK使自噬增强在缺血性脑损伤中发挥神经保护作用。
综上所述,二甲双胍对局灶性脑缺血大鼠具有抗焦虑和神经保护作用,并通过激活AMPK发挥作用。
[1] Viollet B,Guigas B,Sanz Garcia N,et al.Cellular and molecular mechanisms of metformin:an overview[J].Clin Sci (Lond),2012,122(5-6):253-270.
[2] Ashabi G,Khalaj L,Khodagholi F,et al.Pre-treatment with metformin activates Nrf2 antioxidant pathways and inhibits inflammatory responses through induction of AMPK after transient global cerebral ischemia[J].Metab Brain Dis,2015,30(3):747-754.
[3] Khang R,Park C,Shin J.The biguanide metformin alters phosphoproteomic profiling in mouse brain[J].Neurosci Lett,2014(579):145-150.
[4] Pintana H,Apaijai N,Pratchayasakul W,et al.Effects of metformin on learning and memory behaviors and brain mitochondrial functions in high fat diet induced insulin resistant rats[J].Life Sci,2012,91(11-12):409-414.
[5] 赵静,薛荣亮,魏欣,等.茶多酚对大鼠全脑缺血/再灌注损伤后神经元凋亡和神经行为学的影响[J].国际麻醉学与复苏杂志,2012,33(3):146-150.
[6] Lennox R,Porter DW,Flatt PR,et al.Comparison of the independent and combined effects of sub-chronic therapy with metformin and a stable GLP-1 receptor agonist on cognitive function,hippocampal synaptic plasticity and metabolic control in high-fat fed mice[J].Neuropharmacology,2014,(86):22-30.
[7] Jiang T,Yu JT,Zhu XC,et al.Acute metformin preconditioning confers neuroprotection against focal cerebral ischaemia by preactivation of AMPK-dependent autophagy[J].Br J Pharmacol,2014,171(13):3146-3157.
[8] Navarro JA,Rodriguez L,CasarejosMJ,et al.Trehalose ameliorates dopaminergic and tau pathology in parkin deleted/tau overexpressing mice through autophagy activation[J].Neurobiol Dis ,2010,39(3):423-438.
[9] Ma J,Zhao L,Nowak TS Jr,et al.Selective,reversible occlusion of the middle cerebral artery in rats by an intraluminal approach.Optimized filament design and methodology[J].J Neurosci Methods,2006,156(1-2):76-83.
[10] Rodriguez R,Santiago-Mejia J,Gomez C,et al.A simplified procedure for the quantitative measurement of neurological deficits after forebrain ischemia in mice[J].J Neurosci Methods,2005,147(1):22-28.
[11] 郝文杰.通过小鼠高架十字迷宫实验评价Sho-ju-sen的抗焦虑作用[J].国际中医中药杂志,2002,24(2):107-108.
[12] Prakash R,Li W,Qu Z,et al.Vascularization pattern after ischemic stroke is different in control versus diabetic rats:relevance to stroke recovery[J].Stroke,2013,44(10):2875-2882.
[13] Girbovan C,Morin L,Plamondon H.Repeated resveratrol administration confers lasting protection against neuronal damage but induces dose-related alterations of behavioral impairments after global ischemia[J].Behav Pharmacol,2012,23(1):1-13.
[14] Paiva MA,Rutter-Locher Z,Goncalves LM,et al.Enhancing AMPK activation during ischemia protects the diabetic heart against reperfusion injury[J].Am J Physiol Heart Circ Physiol,2011,300(6):H2123-H2134.
[15] Liu Y,Tang G,Li Y,et al.Metformin attenuates blood-brain barrier disruption in mice following middle cerebral artery occlusion[J].J Neuroinflammation,2014(11):177.
[16] Zhao Z,Han F,Yang S,et al.Oxamate-mediated inhibition of lactate dehydrogenase induces protective autophagy in gastric cancer cells:involvement of the Akt-mTOR signaling pathway[J].Cancer Lett,2015,358(1):17-26.
[17] Jiang T,Yu JT,Zhu XC,et al.Acute metformin preconditioning confers neuroprotection against focal cerebral ischaemia by preactivation of AMPK-dependent autophagy[J].Br J Pharmacol ,2014,171(13):3146-3157.
(编校:王俨俨)
Metformin improving anxiety-like behaviors through regulation of autophagy following focal cerebral ischemia in rats
WANG Xiao-xian1, LI Fei2, ZHANG Suo2, XU Yue-hua2
(1. Department of Medicine and Appliance, The 456th Hospital of PLA, Ji’nan 250031, China; 2. Department of Neurology, The 456th Hospital of PLA, Ji’nan 250031, China)
ObjectiveTo investigate probable effect of metformin on anxiety and autophagy pathway in rats with focal cerebral ischemia.MethodsThe rats were divided into seven groups: shame group, ischemia group, metformin group, compound C group, compound C +ischemia group, metformin+ischemia group, and metformin+compound C+ischemia group. The rats were administered with metformin 14 days and compound C 30 min pretreatment. The blood glucose level, body mass, neurological score and indicators of elevate plus maze test were recorded of two groups after 72h ischemia-perfusion. The autophagy-related protein of Atg-7, Atg-5, beclin-1 were analysed by Western blot.ResultsMetformin had no significant effect of body mass and blood glucose level. The prior administration of metformin significantly elevated neurological score in ischemia group (P<0.01). The elevate plus maze test results showed that prior administration of metformin significantly elevated percentage of open-arms detention time in ischemia group (P<0.01), but there was no significant difference in open-arms times. Western blot result showed that prior administration of metformin significantly elevated Atg-7, Atg-5, beclin-1 protein expression in ischemia group (P<0.001). Compound C resist the above effects of metformin (P<0.01).ConclusionThe metformin improves psychological disorders and movement disability through regulation of autophagy following focal cerebral ischemia in rats.
metformin; focal cerebral ischemia; anxiety; autophagy
王晓先,男,硕士,副主任药师,研究方向:临床药学,E-mail:wangxiaoxianjn@126.com。
R915
A
1005-1678(2015)08-0062-04
