黄芩苷对鱼藤酮致BV2细胞激活损伤的影响
2015-07-07马宝仓陈忻张楠
马宝仓,陈忻,张楠
(首都医科大学 中医药学院,北京 100069)
黄芩苷对鱼藤酮致BV2细胞激活损伤的影响
马宝仓,陈忻Δ,张楠
(首都医科大学 中医药学院,北京 100069)
目的 观察黄芩苷对鱼藤酮致BV2细胞激活损伤的影响。方法 采用MTT法测定鱼藤酮染毒BV2细胞存活率、ICC法测定细胞OX42表达变化、荧光分光光度法测定细胞内Ca2+含量、ICP-AES测定细胞内铁含量以及采用相关试剂盒测定胞外H2O2和胞内MDA、NO、NOS的含量。结果 鱼藤酮染毒BV2细胞存活率降低,细胞标记蛋白OX42、细胞内Ca2+含量、细胞内铁含量显著增加(P<0.05),造成细胞产生氧化损伤。黄芩苷可减少鱼藤酮染毒BV2细胞OX42表达,增加细胞存活率、减少细胞内铁含量、减少细胞H2O2释放,减少氧化损伤(P<0.05)。结论 黄芩苷抑制鱼藤酮染毒所致BV2的激活和损伤,具有神经保护作用;其保护作用机制与减少铁进入细胞有关。
帕金森病;鱼藤酮;黄芩苷;小胶质细胞;神经炎症
帕金森病(Parkinson’s disease,PD)是常见的神经退行性疾病。发病机制研究涉及线粒体功能障碍、氧化应激、神经兴奋性毒性、神经炎性反应和异常蛋白集聚等诸多学说[1-4],神经炎性反应与PD发生发展的关系已成为重要的关注热点之一[5-6]。小胶质细胞作为中枢神经系统的免疫细胞,其活化在神经炎性反应中扮演着重要角色,激活的小胶质细胞[7]通过释放一系列潜在的神经毒性物质和炎性因子如·OH、NO、O2-、IL-1β和TNF-α等发挥细胞毒性效应[8],导致继发性脑损害[9]。PD患者的病理尸检发现变性的神经元周围聚集着大量激活的小胶质细胞和星形胶质细胞[10];在原发性和家族性PD患者均出现大量反应性小胶质细胞[11]。而PD患者黑质(substantia nigra,SN)中铁含量显著增加也是一个公认的事实[12-13],主要病理脑区小胶质细胞的激活,特别是铁积聚的原因尚未认识清楚。本课题组前期的研究发现鱼藤酮PD大鼠不仅黑质致密部,在海马齿状回颗粒细胞层、纹状体苍白球、小脑齿状-间位核及面神经核区域都有铁的显著积聚[14],而常用中药黄芩中的有效成分黄芩苷在改善PD动物神经行为学症状的同时,可减少上述区域铁积聚。研究还见这些区域内小胶质细胞、星型胶质细胞均呈激活状态[15-16]。这些发现提示小胶质细胞激活与铁积聚可能存在着的某种关系,本研究旨在:①观察鱼藤酮染毒小胶质细胞所造成的激活和损伤及是否能引起铁摄入增加,探讨小胶质细胞激活和损伤与铁摄入的关系。②黄芩苷是否能减轻鱼藤酮染毒BV2细胞激活及所造成的损伤;能否减少损伤时铁的摄入,从而探讨黄芩苷保护神经细胞的作用机理。
1 材料与方法
1.1 材料
1.1.1 细胞:BV2小鼠小胶质细胞(国家实验细胞资源共享平台)。
1.1.2 药品与试剂:鱼藤酮(ROT,上海阿拉丁,批号:H1206031),柠檬酸铁胺(FAC,国药集团化学试剂有限公司,批号:F20091029),阿司匹林(AS,国家标准物质资源中心,批号:CDCT-C10024000)、黄芩苷(BI,中国药品生物制品检定所,批号:A0016),小鼠CD11b/c(OX42)单克隆抗体(Abcam®公司,批号:GR67204-1),钙荧光测定试剂盒(CFA,Immuno Way公司,批号:C38T121)。
1.1.3 仪器:AP250D型电子天平(美国奥豪斯);电热恒温水浴锅(北京市长风仪器仪表公司);CO2恒温培养箱(Heraeus Hear cell 150 Thermo);层流超净台(Taisite);倒置显微镜(Leica DMIL);680型酶标仪(Bio-Rad);Biofuge15R型低温生物离心机(Heraeus Instrument);MIR-162型恒温培养箱(日本三洋公司);RF-5301PC荧光分光光度计(Shimadiu, 日本);ICPS-7000型高频电感耦合等离子发射光谱仪(ICE-AES)(日本Shimadzu公司);ECLIPSE80i型显微镜(日本Nikon公司);OLYMPUS IX71荧光倒置显微镜(日本);低温高速离心机(德国EPPENDORF公司);pH计(英国JENWAY)。
1.2 方法
1.2.1 鱼藤酮对BV2细胞的损伤浓度和时间的确定:采用96孔板,1×104个/mL接种BV2细胞,每孔加入100 μL细胞悬液,培养约24 h,细胞生长至汇合度约在60%~70%时,加入不含血清的DMEM配制的ROT梯度(0.0001、0.0005、0.001、0.005、0.01、0.05、0.1、0.5 μmol/L),分别作用6、12、24 h,每板设正常对照组。时间结束时每孔加20 μL的MTT(浓度为0.5 mg/mL),4 h后吸弃上清液,每孔加入150 μL的DMSO,设空白对照组,测定细胞存活率。
1.2.2 BV2细胞损伤后的形态观察 用24孔板培养BV2细胞,分设正常对照组、黄芩苷组、模型组。待细胞长至汇合度约在60%~70%时,模型组加0.01 μmol/LROT孵育24 h,黄芩苷组先加0.01 μmol/LROT,后加入20 μg/mL的黄芩苷,共同孵育24 h。在相差显微镜下观察各组细胞形态,并拍片记录,其中模型组在6 h、12 h、24 h时分别观察记录。
1.2.3 黄芩苷对鱼藤酮染毒BV2细胞存活率的影响:正常传代培养的BV2细胞,分为正常对照组、ROT模型组、ROT+BI组(BI组)、ROT+AS组(AS组)。接种细胞汇合至60%~70%时,BI组(BI1、BI2、BI3)和AS组(AS1、AS2、AS3)分别用无血清的梯度BI(10、20、50 μg/mL)、AS(0.1、1、10 mmol/L)先孵育1h,正常对照组和ROT模型组则加无血清DMEM培养液。后各组除正常对照组均加ROT(终浓度为0.01 μmol/L)孵育24 h。MTT法测各组细胞存活率。
1.2.4 黄芩苷对鱼藤酮染毒BV2细胞激活的影响:将BV2细胞悬液(1×104个/mL)2 mL接种于放置涂有多聚赖氨酸的盖玻片的24孔板里培养24 h,分为4组。BI组和AS组分别用无血清的BI(20 μg/mL)、AS(1 mmol/L)先孵育1 h,正常对照组和ROT模型组则加无血清DMEM培养液,后除正常组外其余各组加ROT(终浓度为0.01 μmol/L)孵育24 h制成细胞涂片。行OX42染色:细胞涂片、4%多聚甲醛固定、3%H2O2清除内源性过氧化物酶、羊血清封闭液、滴加OX42(1:100)抗体、4 ℃过夜、按顺序滴加二抗、DAB显色、梯度乙醇脱水、二甲苯脱水、封片。每组6复孔。
1.2.5 黄芩苷对鱼藤酮染毒BV2细胞内钙离子的影响:细胞培养及分组同1.2.4。收集细胞,参照Grynkiewiez等[17]的方法测定各组细胞Ca2+浓度。
1.2.6 黄芩苷对鱼藤酮染毒BV2细胞自由基代谢的影响:细胞培养及分组同1.2.4。吸出上清液,4000 r/min,离心5 min,吸出上清于2 mL的离心管中,4 ℃放置,待测。按南京建成生物工程研究所试剂盒提供的方法进行检测。每组6复孔。
1.2.7 黄芩苷对鱼藤酮染毒BV2细胞胞内铁浓度的影响:将密度为1×104个/mL的BV2细胞2 mL/孔铺到6孔板中,分为5个组:正常对照组、柠檬酸铁胺组(FAC)、ROT模型组(FAC+ROT)、BI组(FAC+ROT+BI)、DFO组(FAC+ROT+DFO)。待细胞汇集度为60%~70%时,吸弃培养液,ROT组、BI组、DFO组均加用无血清的DMEM配置的含FAC的ROT,FAC、ROT的终浓度分别为10、0.01 μmol/L,FAC组只加用无血清的DMEM配制的终浓度为10 μg/mL的FAC,正常对照组加相应量的无血清的DMEM培养液;培养24 h后,BI组和DFO组分别加终浓度为20、50 μg/mL的BI和DFO,其余各组组加无血清DMEM培养液,2 mL/孔,共同孵育3 h。收集细胞、计数,每组复9孔。高频电感耦合等离子发射光谱仪检测细胞内铁含量[18]。
1.2.8 图像分析:每组取6张细胞爬片,40倍镜采集图像,用NIS-Elements病理图像分析系统(Ver.2.1)分析积分光密度(IOD)。

2 结果
2.1 黄芩苷对鱼藤酮染毒所致BV2细胞损伤的保护作用
2.1.1 鱼藤酮对BV2细胞的损伤呈现出剂量依赖性:结果显示:ROT分别染毒BV2细胞6、12、24 h,ROT分别在0.05~0.5、0.01~0.5、0.005~0.5 μmol/L浓度区间,显著地抑制细胞增殖。鱼藤酮染毒12 h与染毒6 h相比,染毒细胞形态发生明显变化,但细胞数量增加;染毒至24 h与染毒12 h相比,不但细胞形态发生了变化,细胞数目也明显减少。在染毒24 h的ROT浓度梯度中,0.01 μmol/L染毒组即可造成BV2细胞与正常对照组差异有统计学意义,因此本实验其他指标中染毒组即采用此浓度。见表1。

表1 鱼藤酮梯度浓度及不同作用时间对BV2细胞存活率的影响±s,n=6)Tab.1 Influence of Rotenone gradient concentration and different duration for BV2 cells survival ±s,n=6)
*P<0.05,**P<0.01,与正常组比较,compared with control group;#P<0.05,##P<0.01,与6 h比较,compared with 6 h
2.1.2 ROT染毒BV2细胞后其形态的变化:正常组细胞绝大部分为圆形或椭圆形;模型组作用BV2细胞,前6 h内无显著性变化,6~12 h内大部分细胞可产生树突,24 h时,树突大量减少,大部分细胞呈现不规则圆形,较正常组细胞胞体变大,细胞边缘透明化程度增高;黄芩苷组树突较少,细胞形态接近正常对照组。见图1。

图1 BV2细胞受到ROT影响时的细胞形态(×20)Fig.1 BV2 cell morphology by ROT influence(×20)
2.1.3 黄芩苷对鱼藤酮染毒的BV2细胞具有剂量依赖性的保护作用:黄芩苷在10~50 μg/mL浓度范围,可减少鱼藤酮(0.01 μmol/L,24 h)染毒BV2细胞的死亡率,对BV2细胞的保护呈现出剂量依赖性,而AS过低浓度保护作用不强,过高浓度则会引进新的损伤。见表2。

表2 黄芩苷对鱼藤酮染毒BV2细胞死亡率的影响±s,n=6)Tab.3 Effect of baicalin on rotenone exposure BV2 cells ±s,n=6)
**P<0.01,与正常组比较,compared with control group;#P<0.05,##P<0.01,与模型组比较,compared with model group
2.2 黄芩苷减少鱼藤酮染毒所致BV2细胞的激活 实验结果显示:鱼藤酮模型组较正常组BV2细胞OX42的表达显著增加,BI组与AS组较模型组OX42的表达减少,提示ROT激活BV2细胞,而BI和AS可以减少鱼藤酮导致的BV2激活,且BI优于AS。见表3、图2。
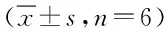
表3 鱼藤酮染毒BV2细胞OX42的表达Tab.
**P<0.01,与正常组比较,compared with control group;#P<0.05,##P<0.01,与模型组比较,compared with model group
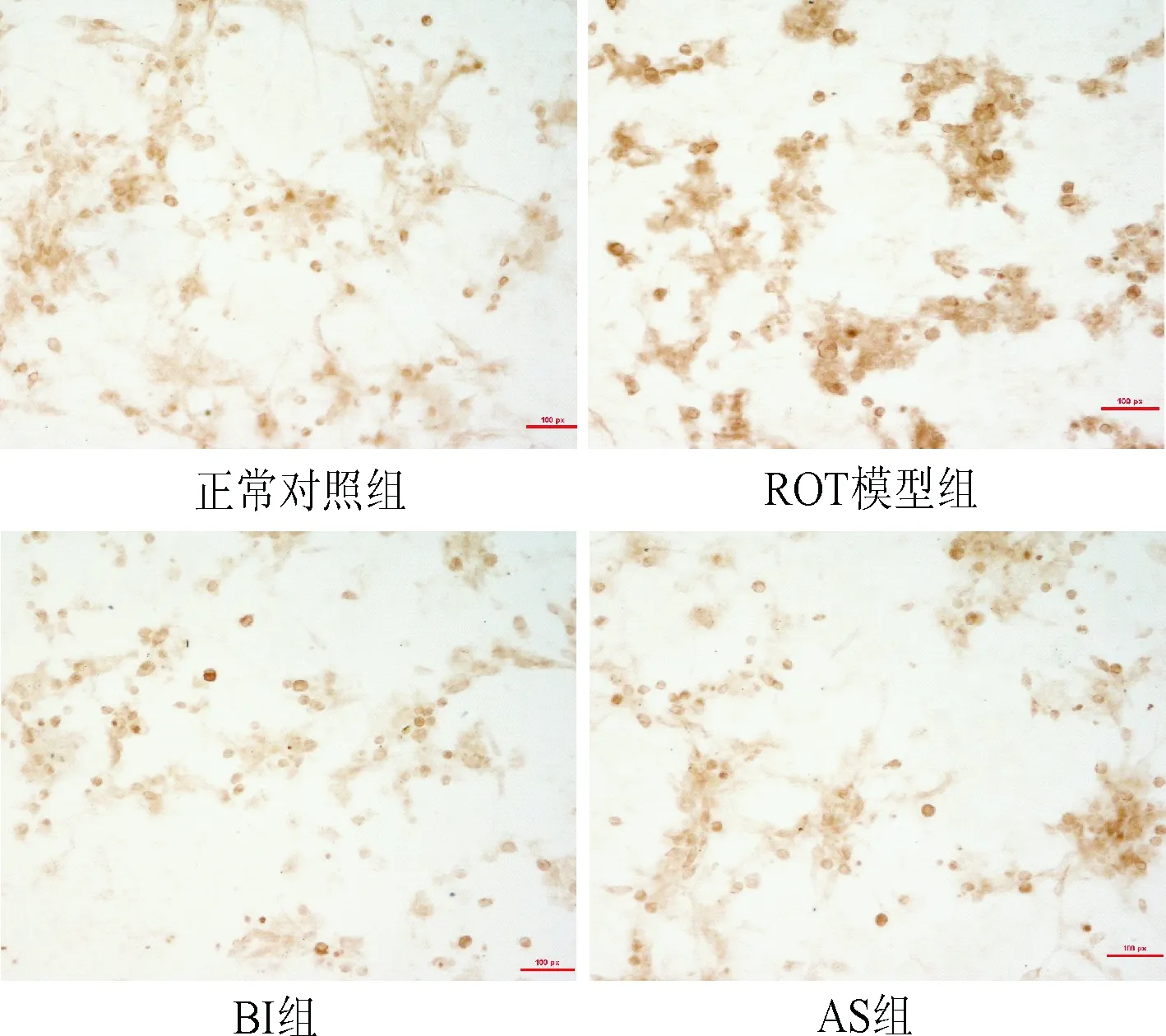
图2 鱼藤酮染毒BV2细胞OX42的表达(×100)Fig.2 Rotenone exposure BV2 cells express OX42(×100)
2.3 黄芩苷减少鱼藤酮染毒BV2细胞内钙离子浓度 结果显示,ROT模型组细胞内Ca2+含量显著增加(P<0.01)。而BI、AS能够明显抑制鱼藤酮染毒引起的细胞外液中Ca2+的进入。见表4。
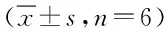
表4 鱼藤酮染毒BV2细胞Ca2+含量变化Tab.4 Ca2+ content changes of rotenone infected BV2 ±s,n=6)
*P<0.05,**P<0.01,与正常组比较,compared with control group;#P<0.05,与模型组比较,compared with model group
2.4 黄芩苷抑制鱼藤酮染毒BV2细胞氧自由基产生及氧化损伤 BV2细胞在0.01 μmol/L的ROT干预24 h后,ROT模型组细胞培养液中H2O2含量、BV2细胞MDA、NO、NOS含量均明显高于对照组(P<0.01),而BI组和AS组均能降低ROT染毒所造成的BV2细胞的氧化损伤,降低细胞培养液中H2O2的含量(P<0.01),降低细胞内MDA、NO、NOS的量(P<0.05)。见表5。
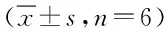
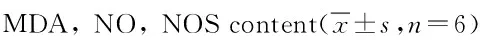
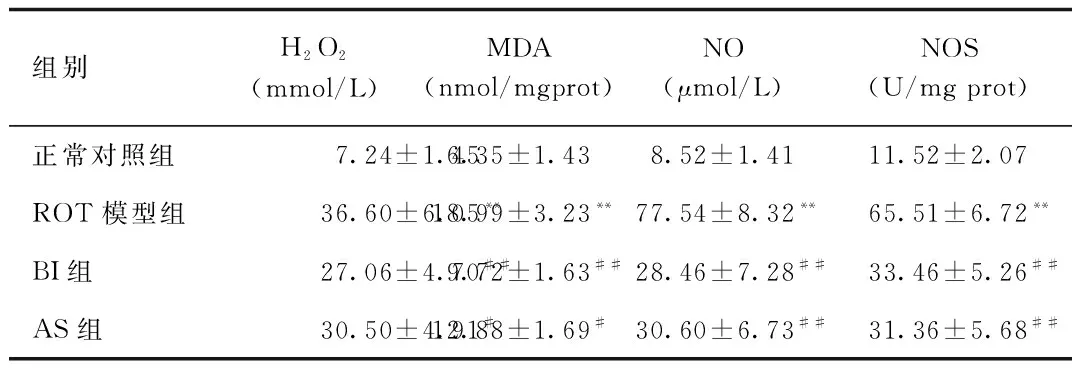
组别H2O2(mmol/L)MDA(nmol/mgprot)NO(μmol/L)NOS(U/mgprot)正常对照组7.24±1.456.35±1.438.52±1.4111.52±2.07ROT模型组36.60±6.05**18.99±3.23**77.54±8.32**65.51±6.72**BI组27.06±4.70##9.72±1.63##28.46±7.28##33.46±5.26##AS组30.50±4.91#12.88±1.69#30.60±6.73##31.36±5.68##
**P<0.01,与正常组比较,compared with control group;#P<0.05,##P<0.01,与模型组比较,compared with model group
2.5 黄芩苷减少鱼藤酮染毒BV2细胞内铁含量 结果显示,FAC组和ROT组细胞内铁含量较正常组有显著差异(P<0.01),提示铁的扩散受浓度梯度驱使,很容易进入细胞。黄芩苷组和去铁胺组细胞内的铁较模型组显著减少(P<0.05),表明黄芩苷、去铁胺都能减少铁进入BV2细胞内。而鱼藤酮染毒并没有使BV2细胞内铁含量增加。见表6。
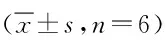
表6 电感耦合等离子发射光谱法测定鱼藤酮染毒BV2细胞内铁含量Tab.6 Inductively coupled plasma emission spectrometry determination of rotenone infected BV2 iron content in the ±s,n=6).
*P<0.05,**P<0.01,与正常组比较,compared with control group;#P<0.05,##P<0.01,与模型组比较,compared with model group
3 讨论
1988年,McGeer等[19]在PD患者中脑黑质致密带中发现了激活的Mi。激活的小胶质细胞膜表面分子也呈现上调改变[20],能够产生和分泌一系列炎症介质,这些炎症介质不仅调节免疫活性,而且作用于神经元,发挥细胞毒性作用,损伤多巴胺神经元[21-22]。本研究在小鼠小胶质细胞株BV2细胞上,以鱼藤酮诱导BV2细胞激活,建立了稳定的PD小胶质细胞模型。
PD神经病理学机制的氧化应激学说已获共识,氧化应激学说与炎性反应、线粒体功能障碍等其他学说之间密切关联[23],氧应激损伤处于各种学说关联的枢纽位置,而铁参与Fenton反应,是促进氧应激反应的重要金属离子。鱼藤酮是线粒体复合酶Ⅰ抑制剂,对神经细胞的损伤除了能量代谢障碍机制外也有氧应激的参与,复合物Ⅰ抑制诱导产生大量活性氧可引起复合物Ⅰ活性持续下降,形成恶性循环[24]。
本项研究显示,鱼藤酮0.005~0.5 μmoL/L范围内均可造成BV2细胞不同程度的损伤,且损伤呈现出剂量的依赖性;鱼藤酮染毒后的BV2细胞先会看到树突明显增加,而后细胞呈现出胞体变大、树突减少的阿米巴样的激活状态,同时标志蛋白OX42表达显著增加,呈现显著的激活状态;激活意味着炎性释放增加,意味着后继的炎性级联反应启动。本研究结果显示鱼藤酮显著抑制了BV2增殖、使细胞内Ca2+增加,释放H2O2增加、细胞氧化损伤加剧;还首次观察到黄芩苷具有抑制鱼藤酮染毒BV2细胞激活的作用;鱼藤酮能够减少染毒细胞的死亡率;抑制细胞内Ca2+增加;减少释放H2O2;抑制细胞氧化损伤,从而对神经细胞产生保护作用。这为阐释黄芩苷在PD动物模型上呈现的神经保护作用机制提供了更多的证据。
一直以来被临床研究[25]和实验研究[26-31]不断证明,PD患者或动物脑内存在铁积聚,铁积聚与PD发生发展的关系是亟待认识的问题,也正在引起临床研究的关注。Kirsch[32]在对轻度认知功能损害患者近2年随访研究中发现:认知功能下降与脑内铁含量的异常沉积增多密切相关。有研究将铁鳌合剂去铁胺维持治疗可减缓AD患者的痴呆发展速度[33]。从铁代谢紊乱入手,用铁螯合剂治疗AD、PD正在形成一种新思路。
本研究在BV2细胞上探索了鱼藤酮、小胶质细胞激活、细胞铁摄入增加之间的关系,发现在有少量铁负载情况下,鱼藤酮染毒并没有显著增加细胞内铁的含量;这提示鱼藤酮并不能直接导致铁更多地进入细胞,也即指出环境毒素可能不直接引起铁在脑区积聚;而铁负载对照组的结果指出:铁在细胞内外浓度梯度存在下能够进入细胞;这提示在整体情况下发生的可能是:环境因素造成神经细胞出现损伤的脑区,有某种因素驱动着铁的集聚,在集聚所形成的浓度梯度下铁更多地进入损伤后正在修复的细胞和幸存的细胞,通过加剧Fenton反应,造成进一步损伤,致使损伤的发展,可能存在着恶性循环。本课题组[15]前期研究发现铁的积聚是逐渐发展的,显著积聚是发生在小胶质细胞激活之后、造模成功后8周,将鱼藤酮PD大鼠造模成功后继续喂养2年,见其黑质铁积聚的程度已是造模成功时的数倍,这些研究支持上述推测。认识驱动铁集聚的因素可能是进一步需要深入工作的方向,多种神经退行性疾病都存在脑铁异常积聚,搞清铁积聚的驱动因素可能对认识疾病的发展、寻找新思路的药物意义重大。本项研究还观察到减少铁离子进入细胞内可能是黄芩苷产生神经保护作用的主要机制之一。药理研究早已证实黄芩苷有抗炎、抗氧化、抗癌、抗病原体、抗心律失常、调节血脂、调节免疫、解热、镇静、激活血管内皮生长因子表达等多种活性,黄芩苷分子具有黄酮类母核结构,它的结构决定了它有很好的金属离子螯合性[34-35],课题组前期在C6细胞证实了黄芩苷可通过螯合铁离子调节膜转铁蛋白DMT1、FP1的表达,减少铁离子的摄入,抑制了铁诱导的氧应激和脂质过氧化水平,抑制细胞凋亡,对神经细胞起到保护作用[36]。本研究的结果进一步提示黄芩苷作为金属离子螯合剂可能在治疗与铁积聚有关的神经退行性疾病中具有重要意义。
[1] Riley BE,Olzmann JA.A polyubiquitin chain reaction:parkin recruitment to damaged mitochondria[J].PLoS Genet, 2015,11(1):e1004952.
[2] Okazawa H,Ikawa M,Tsujikawa T,et al.Brain imaging for oxidative stress and mitochondrial dysfunction in neurodegenerative diseases[J].Q J Nucl Med Mol Imaging, 2014,58(4):387-397.
[3] Markopoulou K,Biernacka JM,Armasu SM,et al.Does α-synuclein have a dual and opposing effect in preclinical vs.clinical parkinson’s disease?[J].Parkinsonism Relat Disord, 2014,20(6):584-589.
[4] Nalls MA,Saad M,Noyce AJ,et al.Genetic comorbidities in parkinson’s disease[J].Hum Mol Genet, 2014,23(3):831-841.
[5] 焦方阳,吴平,左传涛.小胶质细胞显像原理及其在帕金森病和阿尔茨海默病的应用[J].中国临床神经科学,2014,22 (6):686-693.
[6] Deleidi M,Gasser T.The role of inflammation in sporadic and familial parkinson’s disease[J].Cell Mol Life Sci, 2013,70(22):4259-4273.
[7] Heales SJ,Lam AA,Duncan AJ,et al.Neurodegeneration or neuroprotection:the pivotal role of astrocytes[J].Neurochem Res, 2004,29(3):513-519.
[8] Davalos D,Grutzendler J,Yang G,et al.ATP mediates rapid microglial response to local brain injury in vivo[J].Nat Neurosci,2005,8(6):752-758.
[9] Garden GA,Moller T.Microglia biology in health and disease[J].J Neuroimmune Pharmacol,2006,1(2):127-137.
[10] McGeer PL,Itagaki S,Boyes BE,et al.Reactive microglia are positive for HLA-DR in the substantia nigra of parkinson’s and Alzheimer’s disease brains[J].Neurology,1988,38(8):1285-1291.
[11] Chen X,Zhang N,Li C,et al.parallel relationship between microglial activation and substantia nigra damage in a rotenone-induced parkinson’s disease rat model[J].Neural Regen Res,2010,5(4):245-250.
[12] 熊珮,陈忻.黄芩苷对帕金森病大鼠多脑区铁积聚及黑质DMT1、FP1的影响[D].北京:首都医科大学,2013.
[13] 王俊,宋宁,徐华敏.帕金森病中铁与α-突触核蛋白的相互作用[J].生理科学进展,2015,46(3):182-184.
[14] Xiong P,Chen X,Guo CY.Baicalin and deferoxamine alleviate iron accumulation in different brain regions of parkinson’s disease rats[J].Neural Regen Res,2012,7(27):2092-2098.
[15] Pisanu A,Lecca D,Mulas G,et al.Dynamic changes in pro-and anti-inflammatory cytokines in microglia after PPAR-γ agonist neuroprotective treatment in the MPTPp mouse model of progressive Parkinson’s disease[J].Neurobiol Dis, 2014,71:280-291.
[16] 马宝仓,陈忻,熊珮,等.鱼藤酮帕金森大鼠多脑区铁积聚与胶质细胞激活[J].中国实验动物学报,2013,21(6):41-45.
[17] Grynkiewicz G,poeine M,TsienRY.A new generation of Ca2+indicators with Greatly improved fluorescence properties[J].J Biol Chem,1985,260(6):3440-3450.
[18] Guo CY, Chen X.Baicalin interferes with iron accumulation in C6 glioma Cells[J].Neural Regen Res,2011,6(30):2352-2356.
[19] McGeer PL,Itagaki S,Boyes BE,et al.Reactive microglia are positive for HLA-DR in the substantia nigra of parkinson,s and Alzheimer,s disease brains[J].Neurology,1988 ,38(8):1285-1291.
[20] Cho BP,Song DY,Sugama S,et al.Pathological dynamics of activated microglia following medial forebrain bundle transection[J].Glia,2006,53(1):92-102.
[21] Floden AM,Li S.Combs CK.Beta-amyloid-stimulated microglia induce neuron death via synergistic stimulation of tumor necrosis factor alpha and NMDA receptors[J].J Neurosci,2005,25(10):2566-2575.
[22] Zheng HF,Yang YP,Hu LF,et al.Autophagic impairment contributes to systemic inflammation-induced dopaminergic neuron loss in the midbrain[J].PLoS One,2013,8(8):e70472.
[23] 陈忻,郭春彦,熊珮.中药治疗帕金森病的用药概况及其药理作用分析[J].中药新药与临床药理,2012,23(6):690-695.
[24] Tada Oikawa S,Hiraku Y,Kawanishi M,et al.Mechanism for generation of hydrogen peroxide and change of mitochondrial membrane potential during rotenone-induced apoptosis[J].Life Sciences,2003,73:277-3288.
[25] 汪昕.脑铁沉积、外周铁过载与认知功能障碍研究进展[J].生理学研究,2013(1):16-19.
[26] Glinka Y,Gassen M,Youdim MB.Mechanism of 6-hydroxydopamine neurotoxicity[J].J Neural Transm Suppl,1997,50:55-66.
[27] 杨海东,林碧莲.人参皂苷Rg1拮抗MPTP诱导小鼠黑质中铁增高的作用[J].山西医科大学学报,2011,(1):10-14.
[28] 霍洁,鲁强,徐群渊等.大鼠苍白球炎症反应后黑质铁代谢的改变[J].中国组织工程研究与临床康复,2007,11(8):1489-1496.
[29] 东春阳.鱼藤酮对大鼠黑质多巴胺能神经元的影响及其与铁的联合作用[D].上海:华东师范大学,2008.
[30] Song YW, Chen X, Li C,et al.Divalent metal transporter1 expression and iron deposition in the substantia nigra of a rat model of parkinson’s disease[J].Neural Regen Res,2010,5(22):1701-1705.
[31] 宋扬文,陈忻,张楠,等.黄芩苷抑制鱼藤酮帕金森病大鼠黑质铁积聚及作用机制[J].中国药理学通报,2011,27(12):1740-1744.
[32] Kirsc W.Serial susceptibility weighted MRI measures brian iron and microbleeds in dementia[J].Alzheimers Dis,2009,17(3):599-609.
[33].Crapper MD.Intramuscular desferrioxamine in patients with Alzheimer’s Disease[J].Lancer,1991,337(8753):1304-1308.
[34] Pu YM,Wang Q,Qian ZM.Effect of iron and lipid peroxidation on development of cerebellar granule cells in vitro[J].Neuroscience,1999,89(3):855-861.
[35] Shimizu I,Ma YR,Mizobuchi Y,et al.Effects of Sho-saiko-to a Japanese herbalmedicine on hepatic fibrosis in rats[J].Hepatology,1999,29(1):149.
[36] Guo CY, Chen X, Xiong P.Baicalin suppresses iron accumulation after substantia nigra injury:relaiongship between iron concentration and transferrin expression[J].Neural Regen Res,2014,9(9):630-636.
(编校:谭玲)
Effect of baicalin on BV2 cell activation damage caused by rotenone
MA Bao-cang, CHEN XinΔ, ZHANG Nan
(School of Traditional Chinese Medicine, Capital Medical University, Beijing 100069)
ObjectiveTo observe Effect of baicalin on BV2 cell activation damage caused by rotenone.MethodsRotenone infected BV2 cell viability were detected by MTT assay, and OX42expression by ICC method assay, the inner cell Ca2+content by fluorescence spectrophotometry, intracellular iron content by ICP-AES when low concentrations iron of load without damage in cells and extracellular H2O2and intracellular content of MDA, NO, NOS with related kits.ResultsRotenone exposure BV2 cell reduced cell viability, the expression of cell marker protein OX42and intracellular Ca2+content and intracellular iron content were all significantly increased(P<0.05), resulting in oxidative damage to cells. Baicalin reduced OX42expression of rotenone exposure BV2 cell, increased cells survival, reduced intracellular iron content and H2O2release and oxidative damage of BV2(P<0.05).ConclusionBaicalin inhibits BV2 activation and damage by rotenone-induced, and it has neuroprotective effects. The protection mechanism may relate to reduce iron into cells.
Parkinson’s disease; rotenone; baicalin; microglial cells; nerve inflammation
2011年北京市教委科技发展计划项目(KM201110025010)
马宝仓,男,硕士,助教,研究方向:中药防治帕金森病的基础研究,E-mail:mbcbeijing20081125@163.com;陈忻,通讯作者,女,本科,教授,研究方向:中药防治帕金森病的基础研究、中药药理的教学与科研, E-mail:chenxin4283@126.com。
R3
A
1005-1678(2015)08-0001-05
