索拉非尼联合斑蝥酸钠对肝癌HepG2细胞的抑制作用
2015-07-06陈志刚鲁号峰朱继业黄山邬国斌黎乐群赵荫农
陈志刚鲁号峰朱继业黄山邬国斌黎乐群赵荫农
作者单位:530021南宁1广西医科大学附属肿瘤医院肝胆外科;2广西医科大学研究生学院
基础研究
索拉非尼联合斑蝥酸钠对肝癌HepG2细胞的抑制作用
陈志刚1,2鲁号峰1,2朱继业1,2黄山1邬国斌1黎乐群1赵荫农1
作者单位:530021南宁1广西医科大学附属肿瘤医院肝胆外科;2广西医科大学研究生学院
目的探讨索拉非尼联合斑蝥酸钠对肝癌HepG2细胞的抑制作用及相关机制。方法将不同浓度的索拉非尼和斑蝥酸钠分为索拉非尼组、斑蝥酸钠组及索拉非尼+斑蝥酸钠联合用药组(联合用药组),并设空白对照组,分别作用于肝癌HepG2细胞。CCK-8法测定两个单药组及联合用药组对肝癌HepG2细胞的抑制作用,流式细胞术检测细胞周期,Western blot法检测ERK及pERK蛋白的表达水平。结果索拉非尼组、斑蝥酸钠组及联合用药组均可抑制肝癌HepG2细胞的增殖,并具有剂量-时间依赖效应,联合用药组细胞抑制率高于两个单药组(P均<0.05)。索拉非尼浓度为4μmol/L、斑蝥酸钠浓度为3.88μmol/L联合用药的48 h时段表现为协同作用,其余大多表现为相加作用。3组G1期细胞百分比均明显高于对照组(P均<0.001),联合用药组较两个单药组更高(P<0.05);两个单药组及联合用药组的ERK蛋白的表达较对照组无明显差异(P=0.1),索拉非尼组及联合用药组pERK蛋白的表达明显低于对照组的(P<0.05),斑蝥酸钠组明显高于对照组(P=0.023)。结论索拉非尼和斑蝥酸钠对肝癌HepG2细胞均有抑制增殖的作用,联合用药表现为协同或相加作用,其机制可能与阻滞细胞周期及抑制RAF/MEK/ERK信号传导通路有关。
肝肿瘤;索拉非尼;斑蝥酸钠;抑制作用;信号传导通路
1 材料与方法
1.1 材料
人肝癌细胞株HepG2购自中国科学院上海细胞库。斑蝥酸钠(批号:130906)购于贵州神奇制药有限公司,CCK-8购于日本同仁化学研究所,多聚甲醛及吉姆萨染色剂购于武汉博士德生物工程有限公司。周期试剂盒购自南京凯基生物科技有限公司,索拉非尼(批号:08705s000109252013)、ERK1/2及pERK1/2蛋白抗体购自美国Cell Signaling Technology生物公司。
1.2 细胞培养
将肝癌细胞株HepG2置于含12%胎牛血清及100 U/ml青链霉素的1640培养液中于37℃、5%CO2恒温箱中培养。每2 d用0.05%胰蛋白酶进行消化传代一次。
1.3 CCK-8法检测肝癌HepG2细胞的增殖抑制情况
将处于对数生长期的细胞消化、离心制成单细胞悬液并接种于96孔板,按每孔10 000个细胞将HepG2细胞接种于96孔板,取索拉非尼浓度为1μmol/L、2μmol/L、4μmol/L、8μmol/L、16μmol/L、32μmol/L;斑蝥酸钠浓度为0.97μmol/L、1.94μmol/L、3.88μmol/L、7.76μmol/L、15.52μmol/L、31.04μmol/L分别作用于HepG2细胞48 h,然后加入CCK-8试剂,每孔10μl,37℃避光孵育1 h后用酶标仪在450 nm处测定各孔吸光度值(OD值)。根据测得的OD值计算抑制率。抑制率(%)=(对照组OD值-实验组OD值)/对照组OD值×100%,计算50%细胞生长抑制所需的各药物浓度(IC50),以确定后续药物浓度。根据索拉非尼及斑蝥酸钠单药IC50值设定联合用药的浓度。依据上述实验计算得IC50索拉非尼=5.703μmol/L,IC50斑蝥酸钠= 4.507μmol/L,以此确定本实验索拉非尼组浓度为2μmol/L、4μmol/L、6μmol/L、8μmol/L;斑蝥酸钠组浓度为1.94μmol/L、3.88μmol/L、5.82μmol/L、7.76μmol/L,联合用药组药物浓度分别为以上索拉非尼组和斑蝥酸钠组各个浓度之和,每组设6个复孔,设不含药物对照组。分别培养24 h、48 h及72 h。采用协同作用q值判断索拉非尼和斑蝥酸钠联合作用的性质。q=Eab/(Ea+Eb-Ea×Eb),式中Ea和Eb为各单药组抑制率,Eab为联合用药组抑制率。当q>1.15时,认为两药有协同作用;0.85≤q≤1.15则为相加作用;q<0.85为两药联合表现为拮抗作用。以获得最佳协同作用q值的联合药物浓度进行细胞周期检测及Western blot实验。
1.4 流式细胞术检测肝癌HepG2细胞的细胞周期
取对数生长期细胞悬液接种于6孔板,每孔细胞数为5×104个,24 h后加入药物。培养24 h后分别消化、离心,70%酒精固定过夜后,P月S洗涤3次,加入RNAse A及PI,常温避光染色30 min后以流式细胞术仪检测细胞周期。
在借鉴Jackson E L、Crawford D W和Godbey G等休闲制约理论模型基础上,学者Walker GJ和Virden R J针对户外游憩活动提出了户外游憩制约因素模型 (图5)。整个模型是一个循环反馈的过程。尤其是该模型新增加了先行宏观因素 (包括种族、性别、文化等)和先行微观因素 (包括个性、需求、态度和信仰等)[2]240-243和环境条件3个变量。模型中有利于休闲行为实现的环境条件受到微观因素和宏观因素的共同影响。休闲制约协商则受到微观因素和环境条件的共同影响。而环境条件影响休闲偏好、休闲参与决策和实际参与行为。
1.5 Western blot法检测肝癌HepG2细胞ERK、pERK蛋白的表达
加药24 h后提取蛋白,测定蛋白浓度,加入上样缓冲液,100℃煮沸5min后于-80℃冰箱保存备用。配置SDS-PAGE凝胶,每孔加入蛋白20μg,接通电源常规电泳、切胶、转膜、月SA封闭。T月ST洗膜3次,孵育一抗(1∶1 000)、4℃过夜,洗膜、孵育二抗1 h后滴加发光液上机扫膜并分析结果。
1.6 统计学方法
采用SPSS 16.0统计学软件进行数据分析。实验结果以均数±标准差(±s)表示,组间及不同时间点间的比较采用方差分析,多重比较时则采用LSD检验。以P<0.05为差异有统计学意义。
2 结果
2.1 索拉非尼组、斑蝥酸钠组及联合用药组对肝癌HepG2细胞生长抑制的影响
CCK-8法检测结果显示,索拉非尼组和斑蝥酸钠组及联合用药组对肝癌HepG2细胞的抑制率均随浓度的增加及时间延长而增加,呈剂量-时间依赖效应,而联合用药组抑制作用则较两个单药组更明显,差异均有统计学意义(P均<0.05)。见表1。当索拉非尼浓度为4μmol/L、斑蝥酸钠浓度为3.88μmol/L时q值在各时段内均为最大,其中48 h段的q值为1.179(q>1.15),表现为协同作用,而其余大多表现为相加作用。见表2。
2.2 索拉非尼组、斑蝥酸钠组及联合用药组对肝癌HepG2细胞细胞周期的影响
在G0/G1期,索拉非尼组、斑蝥酸钠组及联合用药组的细胞百分比均明显高于空白对照组(P均<0.001),联合用药组明显高于两个单药组(P均<0.05)。S期、G2期各用药组则均较空白对照组低。提示两药单用及联合用药均可使细胞阻滞于G1期。见表3。
2.3 索拉非尼组、斑蝥酸钠组及联合用药组对肝癌HepG2细胞ERK、pERK蛋白表达的影响
Western blot法检测结果显示,两个单药组及联合用药组ERK蛋白的表达与空白对照组比较差异无统计学意义(F=2.928,P=0.100)。而索拉非尼组及联合用药组pERK蛋白的表达较空白对照组低(P<0.05),而斑蝥酸钠组则高于空白对照组(P=0.023)。见图1。
表1 不同浓度及不同时段索拉非尼组、斑蝥酸钠组和联合用药组对肝癌HepG2细胞的抑制率[(±s)%]
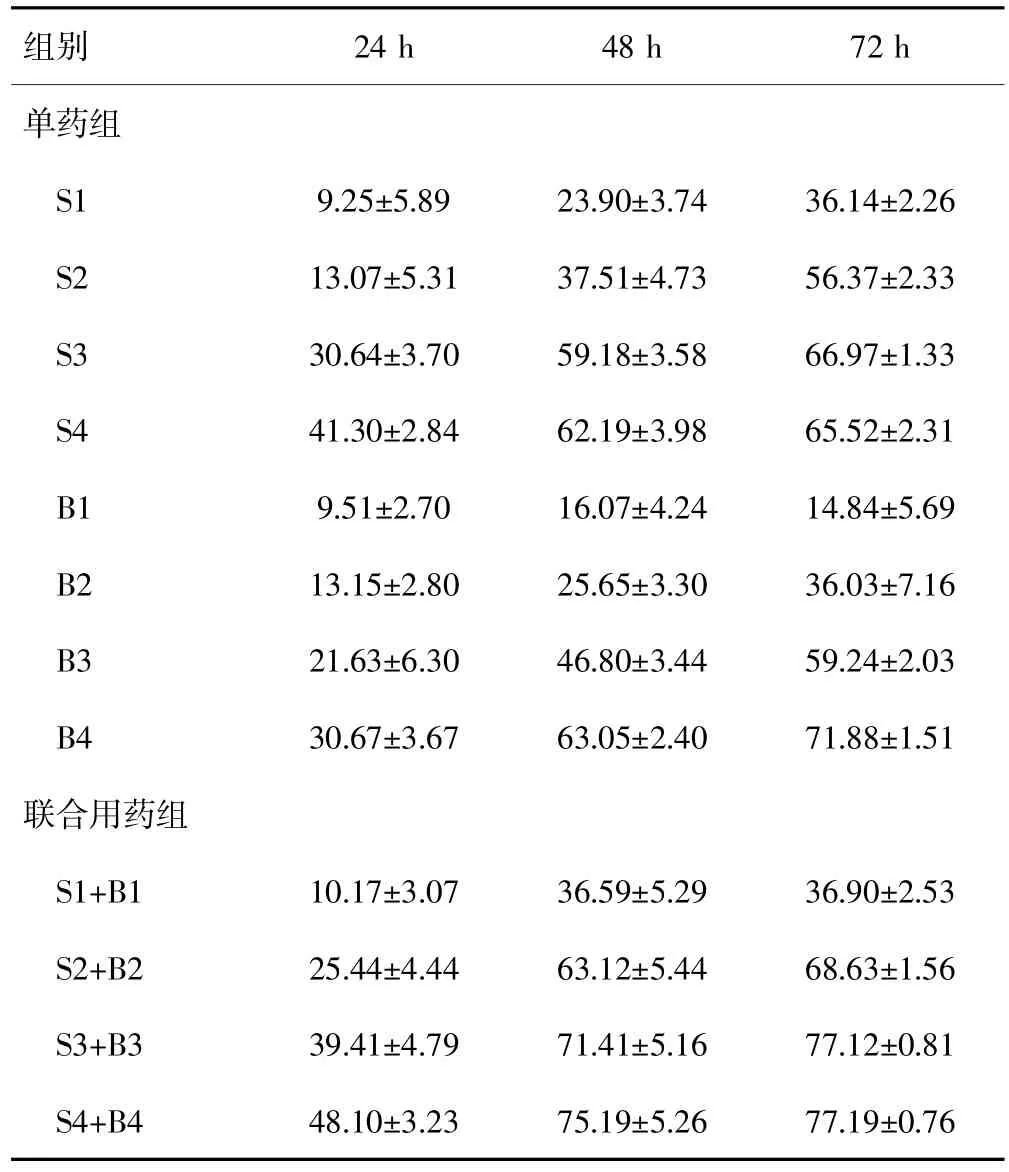
表1 不同浓度及不同时段索拉非尼组、斑蝥酸钠组和联合用药组对肝癌HepG2细胞的抑制率[(±s)%]
S1、S2、S3、S4分别为索拉非尼2μmol/L、4μmol/L、6μmol/L、8μmol/L;月1、月2、月3、月4分别为斑蝥酸钠1.94μmol/L、3.88μmol/L、5.82μmol/L、7.76μmol/L。
组别24 h 48 h 72 h单药组S1 9.25±5.89 23.90±3.74 36.14±2.26 S2 13.07±5.31 37.51±4.73 56.37±2.33 S3 30.64±3.70 59.18±3.58 66.97±1.33 S4 41.30±2.84 62.19±3.98 65.52±2.31月1 9.51±2.70 16.07±4.24 14.84±5.69月2 13.15±2.80 25.65±3.30 36.03±7.16月3 21.63±6.30 46.80±3.44 59.24±2.03月4联合用药组30.67±3.67 63.05±2.40 71.88±1.51 S1+月1 10.17±3.07 36.59±5.29 36.90±2.53 S2+月2 25.44±4.44 63.12±5.44 68.63±1.56 S3+月3 39.41±4.79 71.41±5.16 77.12±0.81 S4+月4 48.10±3.23 75.19±5.26 77.19±0.76

表2 联合用药组对肝癌HepG2细胞协同抑制作用的q值
表3 索拉非尼组、斑蝥酸钠组及联合用药组对肝癌HepG2细胞细胞周期的影响[(±s)%]

表3 索拉非尼组、斑蝥酸钠组及联合用药组对肝癌HepG2细胞细胞周期的影响[(±s)%]
索拉非尼组为4μmol/L,斑蝥酸钠组为3.88μmol/L,联合用药组为索拉非尼4μmol/L+斑蝥酸钠3.88μmol/L。
组别G0/G1期S期G2期空白对照组49.89±3.30 34.57±3.02 16.98±2.28索拉非尼组64.86±1.44 21.51±0.57 13.62±2.00斑蝥酸钠组60.68±1.48 27.57±0.44 11.76±1.21联合用药组69.13±1.85 23.79±0.22 7.23±1.46
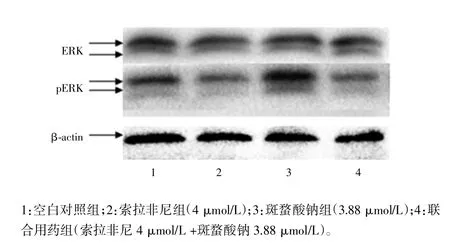
图1 索拉非尼组、斑蝥酸钠组及联合用药组对肝癌HepG2细胞ERK、pERK蛋白表达的影响
3 讨论
肝癌是我国常见、高发的恶性肿瘤之一,因其发病隐匿,大多患者就诊时已属晚期,而全身化疗效果较差,故寻找一种新的治疗方案在临床上具有重要意义。索拉非尼作为一种有效的肝癌化疗药物,现已大量应用于临床,其对晚期肝癌患者已显示出较好的临床效果[3,4,6]。然而,在使用全剂量索拉非尼治疗时也带来一系列毒副反应,如腹泻、手足综合征等[7]。此外由于索拉非尼价格昂贵,因而促使研究者们探索用较小剂量联合其他常规化疗药物或治疗手段,以取得相同或更好治疗效果的同时减少其使用量以减轻毒副反应。如索拉非尼联合5-氟尿嘧啶、丝裂霉素、顺铂[7,8]等常规化疗药物,以及塞来昔布[9]、雷公藤[10]等其他药物,以上研究结果均发现联合用药均能增强索拉非尼的抗癌效能,甚至成倍提升抗癌作用。然而,上述与索拉非尼联合的药物较少单用于肝癌的治疗,或仅作为局部用药。目前用于治疗肝癌较为理想的联合方案仍在探索中。本研究中与索拉非尼联合作用的斑蝥酸钠是斑蟊素的衍生物,其保留了斑蟊素的抗癌能力,而毒副反应则较斑蝥素小。斑蟊素是一种蛋白磷酸酶2A(PP2A)抑制剂,可诱导多种肿瘤细胞凋亡,包括肺、胃、肝等恶性肿瘤[11]。而PP2A可通过抑制Raf/MEK/ERK信号传导通路最终下调pERK1/2的水平[12],同时去甲斑蟊素可通过抑制PP2A上调pERK1/2的水平[13]。因而,我们推测斑蝥酸钠或许可使pERK1/2的表达上调,影响其抑制作用,而索拉非尼可靶向性抑制pERK1/2的表达。因此,根据此契合点,本文试图探讨、观察索拉非尼联合斑蝥酸钠对肝癌HepG2细胞的抑制作用。
通过实验发现,索拉非尼、斑蝥酸钠及二者联合用药时均对肝癌HepG2细胞产生明显的抑制增殖作用,且呈剂量-时间依赖效应,在索拉非尼浓度为4μmol/L、斑蝥酸钠浓度为3.88μmol/L的24 h和72 h两个时间段,两药表现为相加作用,在48 h表现为协同作用;当浓度分别为6μmol/L和5.82μmol/L时,则皆为相加作用。由此认为,索拉非尼联合斑蝥酸钠是值得探索的联合方案之一。
有研究发现索拉非尼通过抑制周期特异性蛋白cyclin-D1、cyclin-D3及周期蛋白依赖性激酶4(cdk4)和cdk6,使细胞无法通过G1-S期,因此被阻滞在G1期[14]。而对于斑蝥酸钠,有研究发现其类似物去甲斑蝥素可通过下调cdk6和微小染色体维持蛋白2(Mcm2),阻止肝癌HepG2细胞进入S期,阻滞在G1期[15]。本研究结果亦发现索拉非尼及斑蝥酸钠单药均可使肝癌HepG2细胞被阻滞在G1期,而联合用药时,通过上述两种机制的影响,双重阻滞,使更多的细胞阻滞在G1期,进一步印证了上述观点。
Raf/MEK/ERK促分裂原活化蛋白(MAP)激酶信号传导通路的激活是肝癌发生过程中的一个重要变化。当此通路被激活后,细胞的生存及增殖能力得以增强,同时还能通过促进血管内皮生长因子(VEGF)和血小板源性生长因子(PDGF)的表达刺激血管生成,进而促进肿瘤的生长[7]。因此,Raf/MEK/ERK信号传导通路成为肝癌的治疗靶点之一。Western blot法检测显示,索拉非尼及斑蝥酸钠单药及联合用药的ERK蛋白表达与空白对照组相比无明显差异,但索拉非尼组及联合用药组pERK蛋白的表达则明显较空白对照组低,而斑蝥酸钠组高于空白对照组。这一实验结果进一步证实了本研究前期推论,即斑蝥酸钠可促进pERK蛋白的表达,而与索拉非尼联合用药时,可减少斑蝥酸钠所引发的pERK蛋白的表达上调,最终使pERK蛋白的表达下降。因此,抑制Raf/ MEK/ERK信号传导通路可能是两药联合抑制肝癌HepG2细胞增殖的机制之一。
随着分子靶向治疗研究的不断深入,探索有效的治疗肝癌联合方案成为热点之一,索拉非尼在单药治疗肝癌取得肯定疗效后,本研究通过索拉非尼联合中药斑蝥酸钠的体外实验,证明了其具有协同或相加抑制肝癌HepG2细胞增殖的作用,可为肝癌的临床治疗提供一定参考。然而,其机制及联合用药方案和临床疗效还需进一步临床试验加以探索。
[1]陈志刚,黄超源,连芳,等.抗病毒治疗与病毒相关性肝细胞癌[J].中国癌症防治杂志,2014,6(2):201-204.
[2]Roxburgh P,Evans TR.Systemic therapy of hepatocellular carcinoma:arewemaking progress?[J].Adv Ther,2008,25(11):1089-1104.
[3]Crissien AM,Frenette C.Current management of hepatocellular carcinoma[J].Gastroenterol Hepatol(NY),2014,10(3):153-161.
[4]Llovet JM,Ricci S,Mazzaferro V,et al.Sorafenib in advanced hepatocellular carcinoma[J].N Engl JMed,2008,359(4):378-390.
[5]房德芳,王明艳.斑蝥酸钠抑制肝癌细胞生长的实验研究[J].辽宁中医杂志,2007,34(6):845-847.
[6]Cheng AL,Kang YK,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phase III randomised,double-blind,placebo-controlled trial[J].LancetOncol,2009,10(1):25-34.
[7]Xie B,Wang DH,Spechler SJ.Sorafenib for treatment of hepatocellular carcinoma:a systematic review[J].Dig Dis Sci,2012,57(5):1122-1129.
[8]陈逢生,崔彦芝,罗荣城,等.索拉非尼联合顺铂对肝癌HepG2细胞的抑制作用[J].南方医科大学学报,2008,28(9):1684-1687.
[9]Morisaki T,UmebayashiM,Kiyota A,et al.Combining celecoxib with sorafenib synergistically inhibits hepatocellular carcinoma cells in vitro[J].Anticancer Res,2013,33(4):1387-1395.
[10]Alsaied OA,Sangwan V,Banerjee S,et al.Sorafenib and triptolide as combination therapy for hepatocellular carcinoma[J].Surgery,2014,156(2):270-279.
[11]张卫东,赵惠儒,阎影,等.斑蝥素诱导人肺癌A549细胞凋亡及其分子机制的研究[J].中华肿瘤杂志,2005,27(6):330-334.
[12]McCubrey JA,Steelman LS,Chappell WH,et al.Roles of the Raf/ MEK/ERK pathway in cell growth,malignant transformation and drug resistance[J].Biochim Biophys Acta,2007,1773(8):1263-1284.
[13]AnWW,Gong XF,Wang MW,etal.Norcantharidin induces apoptosis in HeLa cells through caspase,MAPK,and mitochondrial pathways[J]. Acta Pharmacol Sin,2004,25(11):1502-1508.
[14]Jane EP,Premkumar DR,Pollack IF.Coadministration of sorafenib with rottlerin potently inhibits cell proliferation and migration in humanmalignantglioma cells[J].JPharmacol Exp Ther,2006,319(3):1070-1080.
[15]Chen S,Qu X,Wan P,et al.Norcantharidin inhibits pre-replicative complexes assembly of HepG2 cells[J].Am JChin Med,2013,41(3):665-682.
[2014-12-29收稿][2015-03-02修回][编辑罗惠予]
Anti-proliferative effects of combining Sorafenib and sodium cantharidinate in HepG2 liver cancer cells
CHEN Zhigang1,2,LU Haofeng1,2,ZHU Jiye1,2,HUANG Shan1,WU Guobin1,LI Lequn1,ZHAO Yinnong1(1Department of Hepatobiliary Surgery,Affiliated Tumor Hospital of Guangxi Medical University;2Graduate School of Guangxi Medical University,Nanning 530021,P.R.China)
ZHAO Yinnong.E-mail:Yinongzhao@263.com
ObjectiveTo investigate the anti-proliferative effects of combining Sorafenib and sodium cantharidinate on HepG2 liver cancer cells.M ethodsHepG2 cells were treated with sorafenib alone,sodium cantharidinate alone or both together;control cells were left untreated.The CCK-8 assay was used to measure antiproliferative effects of different drug concentrations;flow cytometry,to measure cell cycle distribution;and Western blotting,to measure expression of ERK and pERK.Results月oth sorafenib and sodium cantharidinate on their own or together inhibited HepG2 proliferation in a dose-dependentway,with the combination proving significantly more potent than either drug on its own(P<0.05).Combining the two drugs led to an additive antiproliferative effect,except at a concentration of 4μmol/L of sorafenib and 3.88μmol/L of sodium cantharidinate at 48 h,when a synergistic effectwas observed.The proportion of cells arrested in G1phase was significantly greater with either drug alone or both together than in the absence of drug(P<0.001),and itwas significantly higher for the two drugs together than for either drug alone(P<0.05).ERK was not significantlyaffected by either drug on its own or by the combination(P=0.1),while pERK levels were significantly lower with sorafenib alone or both drugs together than in the absence of drug(P<0.05).Conversely,the pERK levelwas significantly higherwith sodium cantharidinate alone than in the absence of drug(P=0.023).ConclusionThe combination of sorafenib and sodium cantharidinate can exerta synergistic antiproliferative effect on HepG2 cells,and this effectmay be due to cell cycle arrest and inhibition of the RAF/MEK/ERK signaling pathway.
Liver neoplasm;Sorafenib,Sodium cantharidinate;Anti-proliferative effects;Signaling pathway
R735.7
A
1674-5671(2015)02-05
10.3969/j.issn.1674-5671.2015.02.04
国家自然科学基金资助项目(81360315);广西卫生厅科研基金资助项目(重2012087);广西卫生厅自筹经费科研课题(Z2011228)
赵荫农。E-mail:Yinongzhao@263.com
