干旱胁迫对蒙古黄芪生物量及其根际微生物种群数量的影响
2015-07-05李国斌李光跃孙窗舒陈贵林
李国斌,李光跃,孙窗舒,贾 鑫,陈贵林
(内蒙古大学 生命科学学院,内蒙古自治区中蒙药材规范化生产工程技术研究中心,呼和浩特010021)
微生物群落是土壤生态系统的重要组成部分,参与土壤中有机质的分解、腐殖质的形成及养分转化和循环等生化过程,并对土壤肥力的形成发挥着积极作用[1-2]。根际是指与植物根系紧密作用的土壤微域[3],属于土壤微生物特殊的生境之一。根际微生物的生命活动与根系分泌物、脱落物及根系释放在土壤中的各种物质密切相关,且多数根际微生物对于植物无害,或有一定的促进作用[4]。温度、pH、盐分、土壤性质等环境因素都会对根际土壤微生物造成影响[5-6]。有学者对杉木(Cunninghamia lanceolata)、梭梭(Haloxylon ammodendron)及生长在极端干旱环境中的胡杨(Populus euphratica)等植物的根际微生物数量进行了研究[7-9],发现不同植物及不同逆境下根际微生物数量存在很大差异。水分亏缺加重盐胁迫对棉田土壤微生物数量的影响表现在随着盐浓度的增加,土壤细菌、放线菌、真菌的数量呈逐渐下降趋势[10]。接种一些土壤微生物能够提高植物的抗旱性,同时促进植物的生长[11]。干旱胁迫作为田间普遍存在的一种作物生长逆境,对土壤微生物和植物生物量的积累有较大的影响。
蒙古黄芪(Astragalus mongholicus)主产于内蒙古、甘肃、山西等地,以干燥根入药,是一味药用价值广泛、药理作用明显的大宗药材。近年来有关黄芪的研究较为广泛[12-15],但关于干旱胁迫下黄芪根际微生物群落特征与生物量积累之间相关性的研究却鲜有报道。为此,本试验以“武川”和“浑源”2 个黄芪品种为研究对象,采用平板法研究根际微生物的群落特征,并利用相关分析方法探讨了持续干旱条件下黄芪根际微生物群落特征和生物量间的关系,为黄芪的水肥管理和优质栽培提供理论依据。
1 材料和方法
1.1 试验材料
供试材料为二年生黄芪盆栽实生苗,品种是武川黄芪(简称‘武川’)和浑源黄芪(简称‘浑源’),经内蒙古大学陈贵林教授鉴定为蒙古黄芪。供试土壤为粟钙土,理化性质为:pH 8.1,有机质20.7g/kg,水解性氮114.7mg/kg,有效磷22.8 mg/kg,速效钾207mg/kg。
1.2 试验处理
试验于2013年3月~2014年6月于内蒙古大学花房进行。2013年3月26日选取充实饱满的黄芪种子与经NaClO 溶液消毒后的蛭石拌好,25 ℃下催芽,待种子露白后,挑取发芽一致的种子播于相同规格的花盆(上口直径17cm,底面直径12cm,高25cm),内装5kg粟钙土,每盆定植5株,置温室中正常管理。翌年5月25日选长势一致、正常健壮的盆栽苗移入塑料防雨棚,两个品种的处理组和对照组 均 设40 盆。6 月12 日 开 始 干 旱 胁 迫 试 验,6 月27日胁迫结束。实验前对2个品种进行饱和浇水,此后处理组不再浇水,对照组正常浇水,并与处理组同期取样测定生物量、土壤含水量、茎叶组织相对含水量及根际微生物数量,每隔2d取样1次,每次3个生物学重复。
试验期间,防雨棚内白天气温为22 ℃~30 ℃,夜间12℃~18℃,自然光照;白天相对湿度为46%~60%,夜间为80%~90%。花盆随机摆放,定期调换位置,所有处理除了水分管理不同外,其他管理均相同。
1.3 测定指标和方法
1.3.1 土壤含水量 采用烘干法测定[16]。先将取样用的空铝盒烘干称重W0,然后取各处理黄芪的新鲜土样置铝盒中一起称重W1,随后立即将带土铝盒放入(105±2)℃烘箱中烘8h至恒重,移到真空干燥器中,冷却至室温,称重W2,土壤含水量(%)=[(W1-W2)/(W2-W0)]×100%
1.3.2 根叶组织相对含水量 采用饱和称重法测定[17]。分别剪取不同胁迫处理阶段的根叶组织,用普通吸水纸包裹好,放入盛满水的50 mL 离心管中,静置24h后,称量饱和鲜重,取出根叶,干水分,然后置鼓风烘箱中105 ℃杀青45min,于75 ℃下烘干到恒重,称其干重。计算公式:根叶组织相对含水量(%)=(鲜重-干重)/(饱和鲜重-干重)×100%。
1.3.3 根际土壤采集及其微生物数量测定 采用剥落分离法取样[6]。将完整带土植株取出,轻轻抖落不含根系的大块土(即非根际土),然后用力将紧紧贴附根系表面的土(根际土)全部抖落下来,迅速装在无菌袋中。采集后的土壤样品过60目筛,4 ℃保存,用于测定细菌、真菌、放线菌种群的数量。
根际土壤微生物数量的测定采用稀释平板法[18]。细菌用牛肉膏蛋白胨琼脂培养基,放线菌用改良高氏Ⅰ号培养基+重铬酸钾,真菌用孟加拉红培养基+硫酸链霉素。用0.1mL移液器每次吸取0.1mL根际土菌悬液,无菌操作,接种于培养基上,每种菌均以不加菌悬液的无菌水作空白对照,计数结果以CFU/g表示。
1.3.4 植株生物量 将2个品种抖下根际土壤的植株迅速装入无菌自封袋置于冰盒中,带回实验室,清洗,吸干水分,置烘箱中105 ℃下杀青10min,65℃下烘干至恒重,将整株取出,分为地上和地下两部分测量单株干重(g/株)[19]。
以上测定指标均设置3次重复。
1.4 数据分析
采用Excel和SPSS 17.0软件对实验数据进行统计分析,并用Duncan法进行处理间差异显著性检验(LSD)。
2 结果与分析
2.1 干旱胁迫下盆栽土壤含水量的变化
土壤含水量是表征干旱程度的一个重要指标。图1可以看出2个黄芪品种盆栽土壤含水量与各自对照相比,均随着干旱胁迫处理时间的延长而呈现逐渐下降的趋势(图1)。按照Hsiao[20]对于干旱程度的划分标准,本试验在持续自然胁迫后4~6d达到轻度胁迫,8~10d为中度胁迫,12~14d为重度胁迫。
2.2 干旱胁迫下黄芪根、叶组织相对含水量的变化
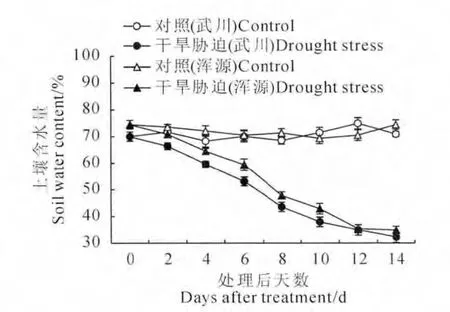
图1 干旱胁迫下盆栽土壤含水量的变化Fig.1 Changes of soil water content in pot under drought stress
干旱胁迫初期,‘武川’和‘浑源’2个黄芪品种根、叶组织中均保持较高的相对含水量;随着干旱胁迫时间的延长,2个品种黄芪根叶组织相对含水量与对照(CK)相比均表现明显的逐渐下降趋势,并一直持续到胁迫结束(图2,A、B)。但不同器官相对含水量下降的幅度略有差异,如干旱胁迫6和10d时,“武川”的叶片相对含水量与CK 相比分别降低9.09%、19.37%,其根系相对含水量则分别降低15.49%、28.81%(图2,A)。同期,‘浑源’叶片相对含水量与CK 相比分别降低9.99%、19.16%,而根系相对含水量则分别降低15.49%、28.40%(图2,B);表明黄芪叶片较根系具有更强的保水能力。
2.3 干旱胁迫对黄芪植株外部形态和生物量的影响
通常生物量变化能够直观反映植株受到干旱胁迫的程度。随着干旱胁迫时间的延长(干旱强度增加),2个黄芪品种的地上部和根系生物量总体均呈持续降低趋势,根冠比则逐渐增大(表1)。其中,轻度干旱胁迫下,‘武川’地上生物量、根系生物量及根冠比 较 对 照(CK)分 别 下 降5.61%、2.93% 和12.99%;‘浑源’根系生物量较对照减少14.95%,而地上生物量和根冠比较对照平均增加3.55%和1.92%。中度干旱胁迫下,2 个品种的生长状况都受到一定程度的抑制,地上部出现倒伏症状,茎顶端开始干枯(图3),部分侧根和主根趋于干枯死亡;此时‘武川’和‘浑源’地上生物量分别较对照(CK)平均减少26.17%、46.73%,根系生物量较对照平均下降20.32%和31.60%,根冠比均呈现持续下降趋势。重度胁迫下,萎蔫严重,大部分叶片干枯脱落(图3),大量侧根和主根先端干枯死亡;‘武川’和‘浑源’地上生物量分别较对照(CK)平均减少43.05%、63.09%,根系生物量平均下降40.72%、59.36%。以上结果说明干旱严重抑制了2品种黄芪的生长,且根系受到的影响比地上部大,‘浑源’受的影响比‘武川’严重。

图2 干旱胁迫下武川(A)和浑源(B)黄芪根叶组织相对含水量的变化Fig.2 Changes of relative water content in roots and leaves of A.mongholicus from Wuchuan(A)and Hunyuan(B)under drought stress
2.4 干旱胁迫对黄芪根际微生物区系组成的影响
由表2可知,不同干旱胁迫强度下,2品种黄芪根际土壤微生物均以细菌为主,在‘武川’和‘浑源’根际土壤微生物数量中分别占82.21%~85.57%和81.85%~84.57%;放线菌所占比例次之,在‘武川’和‘浑源’根际土壤微生物中分别占14.33%~17.73%和15.29%~18.13%;真菌所占比例最少,‘武川’和‘浑源’中分别占0.05%~0.23%和0.023%~0.135%。
黄芪根际土壤中微生物种群的数量受干旱胁迫的影响比较显著,随着干旱程度的增强,根际细菌和放线菌数量变化趋势基本一致,都是先增加后减少。‘武川’根际细菌和放线菌种群数量均在中度干旱胁迫时达到最大值,并显著高于对照,而‘浑源’根际细菌、放线菌数量分别于轻度和中度胁迫时达到最高。2个品种根际土壤中真菌数量的变化趋势与放线菌、细菌完全不同,均随着干旱程度的升高表现出持续下降的趋势。以上结果说明,适度干旱能够促进黄芪根际细菌和放线菌的生长和繁殖,从而表现出对干旱较强的抗逆性。

表1 干旱胁迫对黄芪生物量的影响Table 1 Effects of drought stress on the biomass of A.mongholicus

图3 干旱胁迫对黄芪(浑源)外部形态和生长的影响Fig.3 Effects of drought stress on external morphology and growth in A.mongholicus

表2 干旱胁迫下黄芪根际微生物数量的变化Table 2 Changes of drought stress on the quantities of rhizospheric microorganisms of A.mongholicus

表3 干旱胁迫下黄芪根际微生物组成与相关因子的Pearson相关系数Table 3 Pearson correlation coefficient between composition of rhizosphere microorganism of A.mongholicus and correlation factors under drought stress
2.5 干旱胁迫下黄芪根际微生物数量与生物量、土壤含水量及根叶相对含水量的关系
表3显示,受持续干旱胁迫的影响,黄芪根际土壤细菌、放线菌、真菌种群数量与地上生物量均具有显著正相关关系(P<0.05),而与根系生物量无显著相关关系(P>0.05)。根际细菌种群数量与叶片及根系相对含水量均具有显著正相关关系(P<0.05),根际真菌与土壤含水量存在显著负相关关系(P<0.05)。但根际细菌和放线菌种群数量与土壤含水量无显著相关关系(P>0.05),根际放线菌、真菌与叶片和根系相对含水量均无显著相关关系(P>0.05)。说明,干旱胁迫下黄芪根际微生物对地上部的影响较根系明显。
3 讨 论
干旱是限制植物生长的重要因素,它会导致植物体内水分亏缺,严重影响植物的生理生化过程和生长发育。而植株生物量的变化是对逆境胁迫的综合体现,在一定程度上能够评估植物的抗旱能力。研究结果表明,干旱胁迫下酸枣幼苗的生长受到抑制,且随着干旱程度的加深,抑制现象越明显[21]。
在本研究的中度和重度胁迫下,2 个黄芪品种的地上部和根系生物量积累量均受到明显抑制,根冠比虽低于对照,但在重度胁迫下无显著差异,表明在干旱胁迫处理下,黄芪通过调整自身地上部/根系生物量的分配比例来抵御和适应外部干旱环境,尽可能地降低逆境对自身的伤害,保证植株正常生长。同时,黄芪根叶组织相对含水量随干旱时间的延长呈现持续下降的趋势,但叶片较根系表现出更强的保水能力。
土壤微生物种群数量和组成受到土壤营养、植被覆盖度、土壤类型等多种因素影响,同时根际细菌、放线菌及真菌作为土壤中的活体生物,对环境变化比较敏感,因此可以通过土壤微生物3大类群的数量及其组成的变化来反映土壤质量的变化[22-24]。本研究结果显示,根际细菌数量在微生物区系组成中占绝对优势,这与前人研究的结论相似[25]。受持续干旱胁迫的影响,黄芪根际细菌、放线菌的数量表现出先增后降的趋势,真菌数量持续下降,这可能与不同微生物在土壤中所占比例有关,细菌数量庞大,所需的营养物质相对较多,但随着干旱程度的加重,土壤中养分含量发生显著变化,细菌数量变化呈现规律性变化,但真菌数量受其影响相对较小。真菌是根腐病主要病原菌[26],因此持续干旱可能对土传病害产生一定的抑制作用。有研究报道,土壤放线菌和真菌比细菌更适合干旱环境[27],但本研究发现,在轻度和中度干旱胁迫条件下,细菌和放线菌种群数量持续上升,表现出较强的抗逆性,这可能是由胁迫强度、土壤类型及微生物生长条件的差异造成的。
植物根系为土壤微生物提供生长所需养分,土壤微生物也能促进植物根系的发育,进而促进植物的生长,即土壤微生物种群组成及数量和植物根茎的生长有密切联系。王静[28]等对秦艽研究发现,根际土壤细菌、氨化细菌和固氮菌数量与秦艽生物量呈正相关;而仇有文[29]对山地白术研究表明,土壤中细菌、放线菌和真菌等微生物群落与白术生物学产量呈正相关。本研究结果与其相似,黄芪各菌类数量与地上生物量呈显著正相关。
综上所述,黄芪根际土壤微生物数量与生物量对干旱胁迫比较敏感,在黄芪的栽培管理中,通过调节田间持水量至适度干旱可改变土壤微生物的群落结构,同时也可通过接种适宜的生物菌肥促进黄芪苗的生长并保证优质高产。
[1] RAJKUMAR M,AE N,PRASAD M N,et al.Potential of siderophore-producing bacteria for improving heavy metal phytoextraction[J].Trends in Biotechnology,2010,28(3):142-149.
[2] WANG J(王 静),HU L P(呼丽萍),LIU L(刘 璐),et al.Rhizosphere microbial quantity dynamic of colt cherry[J].Chinese Agricultural Science Bulletin(中国农学通报),2014,30(16):113-116(in Chinese).
[3] XIAO Y H (肖艳红),LI J(李 菁),LIU ZH X(刘祝祥),et al.Advances in studies on rhizopheric microorgansim of medicinal plants[J].Chinese Traditional and Herbal Drugs(中草药),2013,44(4):497-504(in Chinese).
[4] ZHU L X(朱丽霞),ZHANG J E(章家恩),LIU W G(刘文高).Review of studies on interactions between root exudates and rhizopheeric microorganisms[J].Ecology and Environment(生态环境),2003,12(1):102-105(in Chinese).
[5] AHMAD F,AHMAD I,KHAN M S.Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities[J].Microbiological Research,2008,163(2):173-181.
[6] LIU F CH(刘方春),XING SH J(邢尚军),MA H L(马海林),et al.Effects of continuous drought on soil bacteria populations and community diversity in sweet cherry rhizosphere[J].Acta Ecologica Sinica(生态学报),2014,34(3):642-649(in Chinese).
[7] LUO M(罗 明),SHAN N N(单娜 娜),WEN Q K(文启凯),et al.Microbial characteristics of rhizospheric soil of some sand-fixing plants[J].Chinese Journal Applied Environmental Biology(应用与环境生物学报),2002,8(6):618-622(in Chinese).
[8] JIAO R ZH(焦如珍),YANG CH D(杨承栋).The changes of the soil microorganism in rhizosphere and outside in different developing stages of the Chinese fir plantation[J].Scientia Silvae Sinicae(林业科学),1999,35(1):53-59(in Chinese).
[9] YANG Y H(杨玉海),CHEN Y N(陈亚宁),LI W H(李卫红),et al.Study on populations of microorganisms in Populus euphratica rhizosphere and their affecting factors in arid area[J].Arid Zone Research(干旱区研究),2010,27(5):719-720(in Chinese).
[10] ZHOU L L(周玲玲),MENG Y L(孟亚利),WANG Y H(王友华),et al.Effects of salinity stress on cotton field soil microbe quantity and soil enzyme activity[J].Journal of Soil and Water Conservation(水土保持学报),2010,24(2):242(in Chinese).
[11] ARKHIPOVA T N,PRINSEN E,VESELOV S U.Cytokinin producing bacteria enhance plant growth in drying soil[J].Plant Soil,2007,292:305-315.
[12] CHEN G H陈国辉HUANG W F黄文凤.Progress in pharmacological effects of compositions of Astragalus membranaceusJ.Chinese Journal of New Drugs(中国新药杂志),2008,17(17):1 482-1 483(in Chinese).
[13] HAN K(韩 凯),LIANG Z S(梁宗锁),DUAN Q M(段琦梅).Physiological characteristics of Astragalus embranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao under water stress[J].Acta Agriculturae Boreali-Occidentalis Sinica(西北农业学报),2010,19(5):100-104(in Chinese).
[14] YANG Y CH(杨祎辰),NIU H J(牛惠杰),ZHANG Y J(张跃进).et al.Effects of drought stress on germination and growth physiology of Mongolian Astragalus[J].Seed(种子),2015,34(3):30-35(in Chinese).
[15] HAN D H(韩多红),JIN L(晋 玲),ZHANG Y(张 勇*).Effects of NaCl stress on seed germination and seedling physiological characteristics of Astraglus membranaceus[J].Chinese Traditional and Herbal Drugs(中草药),2012,43(10):2 045-2 049(in Chinese).
[16] LIU Y(刘 艳),CHEN G L(陈贵林),CAI G F(蔡贵芳),et al.Growth and osmoregulation substances accumulation of Glycyrrhiza uralensis seedlings under drought stress[J].Acta Botanica Boreali-Occidentalia Sinica(西北植物学报),2011,31(11):2 259-2 264(in Chinese)
[17] 山东农学院,西北农学院,等.植物生理学实验指导[M].济南:山东科学技术出版社,1980:182-187.
[18] 许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986:103-119.
[19] LIU Y(刘 艳),YUE X(岳 鑫),CHEN G L(陈贵林).Effect of water stress on ultrastructure and membrane lipid peroxidation of leaf and root cell of Glycyrrhiza uralensis[J].Acta Pratacurae Sinica(草业学报),2010,19(6):80-81(in Chinese).
[20] HSIAO T C.Plant responses to water stress[J].Annual Review of Plant Physiology,1973,24:519-570.
[21] HE SH X(贺少轩),LIANG Z S(梁宗锁),WEI L ZH(蔚丽珍),et al,Growth and physiologial characteristic of wild sour Jujube scedlings from two provenances under soil water stress[J].Acta Botanica Boreal.-Occident.Sin(西北植物学报),2009,29(7):1 387-1 393(in Chinese).
[22] DING L L(丁玲玲),QI B(祁 彪),SHANG ZH H(尚占环),et al.The characteristics of soil microorganism quantity under different alpine grasslands in Eastern Qilian Mountain[J].Journal of Agro-Environment Science(农业环境科学学报),2007,26(6):2 104-2 111(in Chinese).
[23] WANG Y X(王义祥),REN L H(任丽华),WENG B Q(翁伯琦),et al.Ecological effect of drought stress on microbial group in the soil with Chamaecrista rotundifolia[J].Journal of Xiamen University(厦门大学学报),2005,44:67-68(in Chinese).
[24] ZHENG SH W(郑施雯),ZHU J L(朱建林),JIANG Z P(江泽平),et al.Microorganism quantity and enzyme activity of Cr contaminated soil[J].Journal of Northeast Forest University(东北林业大学学报),2009,39(9):90-93(in Chinese).
[25] YANG S,XING S,LIU C,et al.Effects of root pruning on the vegetative growth and fruit quality of Zhanhuadongzao trees.[J].Hort.Sci,2010,37(1):14-21.
[26] LIU F CH(刘方春),XING SH J(邢尚君),MA H L(马海林),et al.Effect of PGPR fertilizer on biological characteristics in Cerasus pseudocerasus rhizosphere[J].Chin.J.Appl.Environ.Biol.(应用与环境生物学报),2012,18(5):722-727(in Chinese).
[27] ARKHIPOVA T N,PRINSEN E,VESELOV S U.Cytokin in producing bacteria enhance plant growth in drying soil[J].Plant Soil,2007,292:305-315.
[28] WANG J(王 静),LIANG J(梁 健),AN Y(安 毅).et al.Relationship between biomass in ground and underground parts of Gentiana macrophylla and its rhizosphere microbial community structure[J].Chinese Traditional and Herbal Drugs(中草药),2011,42(12):2 535-2 540(in Chinese)
[29] 仇有文.土壤微生物对药材白术生物学产量和品质影响的研究[D].成都:西南交通大学,2007.
