香蕉类甜蛋白基因MaTLP1的克隆与表达分析
2015-07-05李健平徐碧玉金志强
李健平,王 卓,徐碧玉,金志强,3*
(1 海南大学,海口571101;2 中国热带农业科学院热带生物技术研究所,海口571101;3 中国热带农业科学院海口实验站,海口570102)
香蕉在很多发展中国家中是主食,同时也是重要的经济来源。在许多农业发达的拉丁美洲、非洲和亚洲的国家,香蕉是一种重要出口产品。在世界贸易中,香蕉在重要农作物中排第五位[1]。但全球l-u香蕉产量却受到病害制约,其中严重的就有香蕉枯萎病,它是由尖孢镰刀菌古巴专化型(Fusarium oxysporumf.sp.cubense,Foc)引起的[2]。
当植物遭受病原菌侵染时,会激活很多基因,其中就包括病程相关(pathogenesis-related,PR)基因。PR 基因编码蛋白根据氨基酸序列的相似度,血清学交叉关系和生物学功能分为17个家族[3,4]。其中PR5蛋白,又称类甜蛋白(TLPs),包含一段类似甜蛋白的保守结构域。TLPs具有抵抗病原菌的作用,通过使真菌细胞膜透化,进行一系列酶反应破坏病原菌细胞壁来达到抵抗病原菌的效果[5,6]。有许多报道称TLPs能抵抗生物胁迫。在许多转基因的农作物中表达的TLPs对不同的真菌都具有抗性[7,8]。智 利 草 莓 中2 个TLP 在 对 抗 葡 萄 孢 菌Botrytis cinerea 的侵染中可能起到了作用,而且它们是组织特异性[9]。棉花GbTLP1 转到烟草后对黄萎病菌(V.dahliae)和 尖孢镰刀菌(F.oxysporum)有着显著的抗性[10]。在引起稻瘟病的水稻中,植物 特 异 的 整 体 抗 性(whole plant-specific resistance,WPSR)对稻瘟病菌(Magnaporthe oryzae)起到了抵抗的作用,TLPs可能参与其中,它可能与WPSR 表达有关[11]。除了抵抗生物胁迫外,TLPs还能抵抗非生物胁迫[12]。
本研究以巴西蕉(Musa acuminata subsp.malaccensis)为材料,通过RACE 技术克隆得到香蕉MaTLP1基因,利用生物信息学的方法分析该基因的序列特征,采用实时荧光定量PCR 技术,研究在香蕉枯萎病胁迫下该基因的表达情况,为今后深入研究香蕉类甜蛋白在香蕉抵抗枯萎病过程中的功能及香蕉抗枯萎病育种的分子机理提供一定的依据。
1 材料和方法
1.1 实验材料及处理
本研究所用实验材料为感病品种巴西蕉(Musa acuminata L.AAA group,cv.Cavendish)和抗病品种‘农科1 号’。香蕉枯萎病生理4 号小种(Foc TR4)为本实验室保存。香蕉小苗在Hoagland 溶液(pH 6.0)中生长,生长条件为温室中25~32℃,光周期为16h光/8h暗。用Foc TR4孢子悬浮液(1.0×106conidia/mL)侵染五叶一心的感病与抗病香蕉苗2h后,分别移栽在花盆中。选Foc TR4侵染0、2、4和6d的香蕉根作为实验材料,液氮速冻后于-70 ℃冰箱保存待用。每个点取10株苗的根系冻存。0d选取未受Foc TR4侵染的香蕉苗。
1.2 方 法
1.2.1 香蕉根系总RNA 提取 采用Wan等[13]的方法提取总RNA。再用DNaseⅠ(TaKaRa)处理总RNA,除去RNA 中可能含有的DNA 污染,然后再用PrimeScriptⅡ1st Strand cDNA Synthesis Kit(TaKaRa)以0.8 μg 总RNA 为 模 板,以Oligo(dT)16为引物合成第一链cDNA。
1.2.2 3′-RACE 克隆 按照RACE 克隆试剂盒(美国BD 公司)说明书,进行3′-RACE 克隆。利用试剂盒合成3′-Ready cDNA,并根据获得的已知序列设计2条反向嵌套PCR 引物P1和P2(表1),正向引物UMP为试剂盒所带,用UMP和P1引物对3′-RACE进行第1轮PCR 反应。取1μL 做模板,用UMP和P2引物进行第2轮PCR 反应。
1.2.3 5′-RACE 克 隆 用 试 剂 盒 合 成5′-Ready cDNA,并根据香蕉根转录组获得的已知序列,设计2条反向嵌套PCR 引物P3和P4(表1)。正向引物UMP 为 试 剂 盒 自 带,用UMP 和P3 引 物 对5′-RACE进行第1轮PCR 反应。取1μL 做模板,用UMP和P4引物进行第2轮PCR 反应。
1.2.4 全长cDNA扩增 将3′-RACE 和5′-RACE扩增获得的3′端和5′端cDNA 序列在Vector NTI 8.0上进行拼接,获得全长cDNA 序列,并根据该序列设计全长克隆的两端引物P5和P6(表1)扩增全长cDNA。PCR 反应体系包含2μL cDNA,5μL 10×PCR buffer,4μL dNTPs(2.5 mmol/L),4μL MgCl2,0.5μL Taq酶,2μL P5,2μL P6,加水至50 μL。PCR 反应程序为94 ℃预变性10min;94 ℃变性40s,57 ℃退火40s,72 ℃延伸2min,35个循环;72 ℃延伸10min。
1.2.5 克隆与测序 PCR 产物用低熔点琼脂糖凝胶电泳纯化和回收目的扩增片段。在T4DNA 连接酶作用下,将回收的DNA 片段插入pMD18-T 载体,构建重组质粒,转化到大肠杆菌DH5α,取阳性菌落送上海生工公司测序。
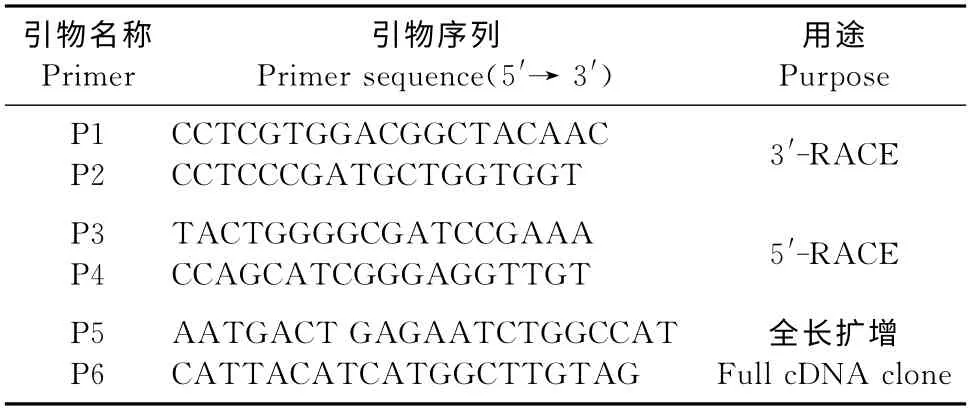
表1 香蕉MaTLP1克隆引物Table 1 Cloning primers of banana gene MaTLP1
1.2.6 基因编码蛋白的生物信息分析 根据MaTLP1的蛋白序列,利用ExPASy ProParam tool软件对其进行分析。运用NCBI的Conserved Domain Search Service(CD Search)软件分析其保守区域。使用NCBI上的Blastx比对寻找与其相似的序列,构建系统进化树。
1.2.7 MaTLP1组织特异性分析 采用Wan等[15]的方法分别提取根、球茎、假茎、叶、花和果实的RNA,再用不含RNase的DNaseⅠ(TaKaRa)处理各器官的总RNA,除去RNA 中可能含有的DNA污染,然后再用PrimeScriptⅡ1st Strand cDNA Synthesis Kit(TaKaRa)分别以各个器官0.8μg总RNA 为模板,以Oligo(dT)16为引物合成第一链cDNA。以cDNA 为模板,用基因特异引物进行基因特异性PCR。基因特异引物为P9(5′-AGCCGTCGTCCTACTCCCA-3′)和P10(5′-CGAAGATTTCTGGCTTGTGGT-3′),采用Actin1作为内参,特异引物为P11(5′-CGAGGCTCAATCAAAGA-3′)和P12(5′-ACCAGCAAGGTCCAAAC-3′)。
1.2.8 实时荧光定量PCR 实时荧光定量PCR使用TaRaKa公司的试剂盒,染料为SYBR Green,在吉泰生物科技公司Mx 3005P 荧光定量PCR 仪上进行。以香蕉Actin 1 片段为内参,以前文方法1.2.1 提取出的cDNA 第一链为模板。所用的MaTLP1引物为P9(5′-AGCCGTCGTCCTACTCCCA-3′)和P10(5′-CGAAGATTTCTGGCTTGTGGT-3′),Actin1引物P11(5′-CGAGGCTCAAT-CAAAGA-3′)和P12(5′-ACCAGCAAGGTCCAAAC-3′),荧光定量PCR 反应程序为95℃预变性3 min;95℃变性7s,57℃退火10s,72℃延伸30s,循环40 次。使用Stratagene Mx3000P machine(La Jolla,CA,USA)进行QPCR 反应,每一个样品设3个重复。扩增检测完后得到的数据使用MxProTM QPCR software(Stratagene)进行分析。
2 结果与分析
2.1 MaTLP1基因全长扩增和序列分析

图1 MaTLP1全长序列PCR 扩增结果M.DL2000;1.MaTLP1Fig.1 PCR results of full length sequence of MaTLP1

图2 香蕉MaTLP1基因序列及编码氨基酸序列Fig.2 Nucleotide acid and deduced amino acid sequences of MaTLP1from banana

图3 MaTLP1的氨基酸序列与其他TLP氨基酸序列比较黑框内为保守结构域,灰色区域为部分TLP共有氨基酸残基,黑色区域为全部TLP共有氨基酸残基;FvTLP.野草莓(XP_004291353.1);NnTLP.荷花(XP_010271556.1);PdTLP.海枣(XP_008781004.1);ZmTLP.玉米(AFW86928.1);SiTLP.粟(XP_004985028.1);SbTLP.高粱(XP_002438563.1);PvTLP.菜豆(XP_007160648.1);OsTLP.水稻(NP_001049533.1)Fig.3 Amino acid sequence alignment of MaTLP1with TLP homologs in plants Black frame shows conserved domain.Grey area shows shared amino acid residues of partial TLPs.Black area shows shared animo acid residues of all TLPs;FvTLP.Fragaria vesca(XP_004291353.1);NnTLP.Nelumbo nucifera(XP_010271556.1);PdTLP.Phoenix dactylifera(XP_008781004.1);ZmTLP.Zea mays(AFW86928.1);SiTLP.Setaria italica(XP_004985028.1);SbTLP.Sorghum bicolor(XP_002438563.1);PvTLP.Phaseolus vulgaris(XP_007160648.1);OsTLP.Oryza sativa(NP_001049533.1).
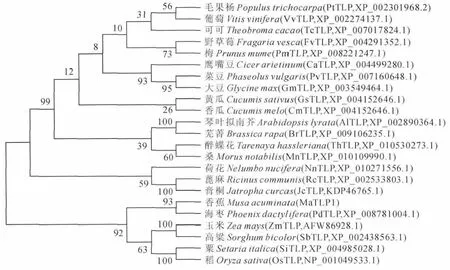
图4 MaTLP1与其他植物TLP的遗传进化树节点上的数值表示bootstrap重复1 000次的置信度Fig.4 Phylogenetic tree of MaTLP1and other TLPs Values at nodes show the confidence level of bootstrap replication 1 000
以香蕉EST 文库中获得的序列设计特异引物(表1)分别进行3′-RACE和5′-RACE,对得到的序列进行拼接,获得MaTLP1全长序列(图1)。序列分析表明该基因全长1 019bp(图2),包含942bp完 整 开 放 阅 读 框,编 码3 1 3个 氨 基 酸,分 子 量 是32 073.5Da,理论等电点4.38。用NCBI CD Search工具发现它的保守区域包含230个氨基酸残基,属于植物和动物同源的抗真菌类甜蛋白亚家族(antifungal thaumatin-like proteins:plant and animal homologs),此保守结构域是该亚家族的特有特征(图3)。用DNAMAN软件进行序列比对发现与其他TLP氨基酸序列相似度仅达56.10%(图3)。
2.2 MaTLP1氨基酸序列的进化分析
为研究MaTLP1氨基酸序列的进化情况,使用Mega3.1软 件 的Neighbor-Joining将23 条 不 同 物种的TLP氨基酸序列绘制成遗传进化树。结果(图4)显示,进化树大致分为两个分支,上支是双子叶植物,下支是单子叶植物。在进化关系上,香蕉MaTLP1与海枣PdTLP 最近,与其他单子叶植物玉米ZmTLP、高粱SbTLP、粟SiTLP 和稻OsTLP亲缘关系较近,与双子叶植物毛果杨PtTLP、葡萄VvTLP、野草莓FvTLP等亲缘关系较远。
2.3 MaTLP1的组织特异性表达
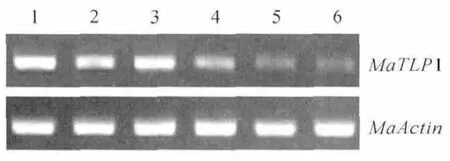
图5 半定量RT-PCR 检测MaTLP1在香蕉不同部位中的表达情况1.根;2.球茎;3.假茎;4.叶;5.花;6.果实Fig.5 Semi-quantitative RT-PCR analysis of the expression MaTLP1in banana tissue 1.Root;2.Rhizome;3.Pseudostem;4.Leaf;5.Flower;6.Fruit
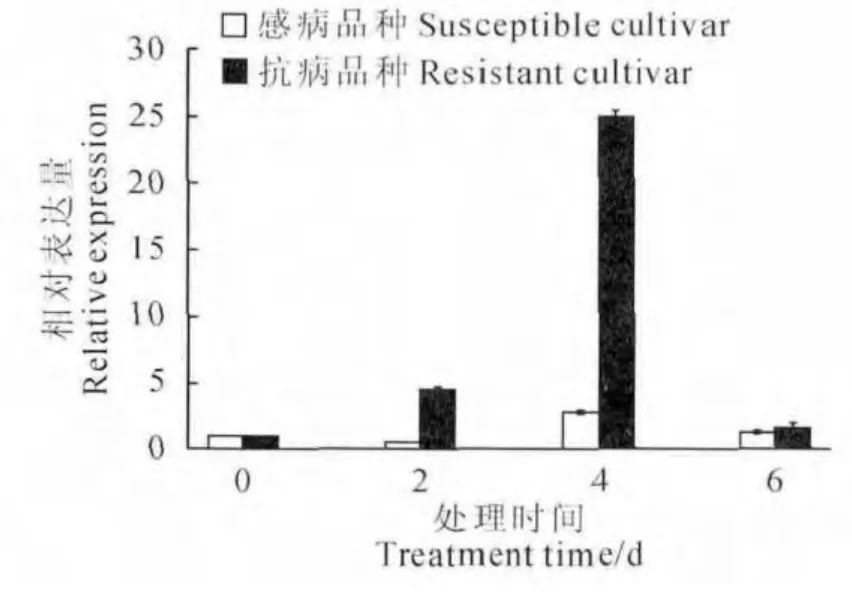
图6 感病品种与抗病品种接种枯萎病菌后MaTLP1的表达情况Fig.6 Expression of MaTLP1in susceptible cultivar and resistant cultivar
为了确定MaTLP1在香蕉中的表达模式,在不同组织中进行了半定量RT-PCR。MaTLP1在根、球茎、假茎、叶、花和果实中均有表达(图5),但主要集中在根、球茎和假茎中表达,叶中表达略低,花和果实中只有微量表达。
2.4 实时荧光定量PCR
实时荧光定量PCR 结果表明,MaTLP1 在接种枯萎病菌的巴西蕉(感病品种)中表达趋势先降低后升高再降低,总体变化不大(图6)。在‘农科1号’(抗病品种)中表达趋势先升高后降低,表达量总体增大,在4d达到最大,表达量与对照相比高24倍(图6)。
3 讨 论
TLPs在参与植物抵抗真菌的过程中发挥着重要 的 作 用[14]。TLP 蛋 白 对 不 同 的 真 菌 具 有 抗性[15-17]。在很多高等植物中,TLP基因在病原菌胁迫下上调表达[18]。中国甘蓝中的20个TLP 基因在接种死体营养型细菌后的qRT-PCR 中有2 个TLP基因被抑制了,表明这2个TLP 基因可能参与了抗菌过程[19]。在转基因水稻中过表达水稻的1个TLP基因表现出对立枯丝核菌(Rhizoctonia solani)的抗性[20];转入了1个TLP 基因的烟草对烟草赤星病菌(Alternaria alternate)表现出抗性[21]。在转基因拟南芥中过表达PdPR5-1表现出对甘蓝链格 孢 菌(Alternaria brassicicola)的 抗 性[22]。这些结果都表明TLP 在植物抵抗许多病原菌过程中起到了重要作用。
本实验克隆得到的MaTLP1含有TLP特有的保守结构域,在系统进化树上,与其他单子叶植物的TLP蛋白聚为一支,在进化关系上与海枣最近,与双子叶植物亲缘关系较远,这些结果都与Angelique等研究结果一致[23],表明克隆获得的MaTLP1确实是香蕉的TLP 基因。Foc TR4是一种侵染根的病原菌,组织特异性表达结果表明,MaTLP1集中在根茎中表达,可能与香蕉在被侵染部位抵抗病原菌有关。荧光定量分析结果发现在接种Foc TR4 的抗Foc TR4品种中,MaTLP1表达量明显增高,最高达对照的25倍,表明MaTLP1在Foc TR4胁迫下激活。而在同样处理下的感病品种中,接菌2d后它的表达量下调,虽然在接菌4d后的表达量上调,但相比抗病品种上调较小,这说明在感病品种中接Foc TR4后MaTLP1的表达量发生了变化,但变化幅度相较抗病品种并不明显。以上结果说明MaTLP1参与香蕉抵抗Foc TR4的过程,但是调控方式和作用机制还不清楚,需要进一步的试验来探讨。
[1] AURORE G,PARFAIT B,FAHRASMANE L.Bananas,raw materials for making processed food products[J].Trends in Food Science &Technology,2009,20(2):78-91.
[2] PLOETZ RC.Fusarium wilt of banana is caused by several pathogens referred to as Fusarium oxysporumf.sp.cubense[J].Phytopathology,2006,96(6):653-656.
[3] CHRISTENSEN A B,CHO B H O,NAESBY M,et al.The molecular characterization of two barley proteins establishes thenovel PR-17 family of pathogenesis-related proteins[J].Mol.Plant Pathol.,2002,3(3):135-144.
[4] VAN LOON LC,REP M,PIETERSE CMJ.Significance of inducible defense-related proteins in infected plants[J].Annu.Rev.Phytopathol.,2006,44:135-162.
[5] ROBERTS W K,SELITRENNIKOFF CP.Zeamatin,an antifungal protein from maize with membrane-permeabilizing activity[J].J.Gen.Microbiol.,1990,136(9):1 771-1 778.
[6] LIU JJ,STURROCK R,EKRAMODDOULLAH AK.The superfamily of thaumatin-like proteins:its origin,evolution,and expression towards biological function[J].Plant Cell Rep.,2010,29(5):419-436.
[7] XING L P,WANG H Z,JIANG Z N,et al.Transformation of wheat thaumatin-like protein gene and analysis of reactions to powdery mildew and fusarium head blight in transgenic plants[J].Acta Agronomica Sinica.2008,34(3):349-354.
[8] MALEHORN D E,BORGMEYER J R,SMITH C E,et al.Characterization and expression of an antifungal zeamatin-like protein(Zlp)gene fromZea mays[J].Plant Physiol,1994,106(4):1 471-1 481.
[9] GLORIA GONZ?LEZ,LIDA FUENTES,MARIA A,et al.Characterization of two PR genes from Fragaria chiloensis in response to Botrytis cinereainfection:A comparison with Fragaria x ananassa[J].Physiological and Molecular Plant Pathology,2013,82:73-80.
[10] MUNIS,LILI TU,FENGLIN DENG,et al.A thaumatin-like protein gene involved in cotton fiber secondary cell wall development enhances resistance against Verticillium dahliae and other stresses in transgenic tobacco[J].Biochemical and Biophysical Research Communications,2010,393(1):38-44.
[11] KOGA H,DOHI K,NISHIUCHI T,et al.Proteomic analysis of susceptible rice plants expressing the whole plant-specific resistance against Magnaporthe oryzae:involvement of a thaumatin-like protein[J].Physiological and Molecular Plant Pathology,2012,77(1):60-66.
[12] RAJAM M V,CHANDOLA N,GOUD P S,et al.Thaumatin gene confers resistance to fungal pathogens as well as tolerance to abiotic stresses in transgenic tobacco plants[J].Biol.Plant,2007,51(1):135-141.
[13] WAN C Y,WILKINS T A.A modified hot borate Method significantly enhances the yield of high quality RNA from cotton[J].Analytic Biochemistry,1994,223(1):7-12.
[14] BATALIA M A,MONZINGO A F,ERNST S,et al.The crystal structure of the antifungal protein zeamatin,amember of the thaumatinlike,PR-5protein family[J].Nat.Struct.Biol.,1996,3(1):19-22.
[15] VLEESHOUWERS,V.G.A.A.,VAN DOOIJEWEERT,et al.Does basal PR gene expression in Solanum species contribute to non-specific resistance to Phytophthora infestans?[J].Physiological and Molecular Plant Pathology,2000,57(1):35-42.
[16] MONOT,C.,PAJOT,E.,LE CORRE,D,et al.Induction of systemic resistance in broccoli(Brassica oleracea var.botrytis)against downy mildew(Peronospora parasitica)by avirulent isolates[J].Biol.Control,2002,24(1):75-81.
[17] SUO Y,LEUNG D W M.Accumulation of extracellular pathogenesis-related proteins in rose leaves following inoculation of in vitro shoots with Diplocarponrosae[J].Sci.Hortic.,2002,93(2):167-178.
[18] MUKHERJEE A K,CARP M J,ZUCHMAN R,et al.Proteomics of the response of Arabidopsis thaliana to infection with Alternaria brassicicola[J].J.Proteomics,2010,73(4):709-720.
[19] SPOEL SH,KOORNNEEF A,CLAESSENS SMC,et al.NPR1modulates cross talk between salicylate-andjasmonate dependent defense pathways through a novel function in the cytosol[J].Plant Cell,2003,15(3):760-770.
[20] DATTA K,VELAZHAHAN R,OLIVA N,et al.Over-expression of the cloned rice thaumatin-like protein(PR-5)gene in transgenic rice plants enhances environmental friendly resistance to Rhizoctonia solani causing sheath blight disease[J].Theor Appl Genet,1999,98(6-7):1 138-1 145.
[21] VELAZHAHAN R,MUTHUKRISHNAN S.Tansgenic tobacco plants constitutively overexpressing a rice thaumatinlike protein(PR5)show enhanced resistance to Alternaria alternata[J].Biol.Plant,2003,47(3):347-354.
[22] EL-KEREAMY A,EL-SHARKAWY I,RAMAMOORTHY R,et al.Prunus domestica pathogenesis-related protein-5activates the defense response pathway and enhances the restistance to fungal infection[J].PLoS One,2011,6(3):e17973.
[23] D’HONT A,DENOEUD F,AURY J M,et al.The banana(Musa acuminata)genome and the evolution of monocotyledonous plants[J].Nature,2012,488(7 410):213-217.
