玉米叶表皮短细胞发育过程的形态特征及栓质细胞作用研究
2015-07-05王巧艳姚雅琴
董 鹤,李 思,张 莉,王巧艳,姚雅琴
(西北农林科技大学 生命科学学院,陕西杨陵712100)
玉米不仅是重要的粮食作物,而且是重要的饲料、工业和能源原料。叶片是植物生长和发育过程中对环境变化比较敏感且可塑性较大的器官,也是植物进行光合、呼吸和蒸腾作用的重要场所[1]。目前,对于玉米叶片结构和功能的研究大多针对的是与光合作用相关的叶肉细胞[2-3],及其与叶表皮上气孔器运动有关的保卫细胞、副卫细胞[4-7]的相关研究,而关于玉米叶表皮短细胞结构与功能方面的系统研究未见详细报道。短细胞是禾本科、莎草科等单子叶植物特化的表皮细胞,包括硅质细胞和栓质细胞两种,成熟的硅质细胞是充满硅质体的死细胞,而栓质细胞是一种细胞壁栓质化的活细胞[8]。在不同植物或同一植物的不同组织部位,两种细胞的形态、分布数量均不同[9]。Blackman[10]用光学显微镜观察了小麦叶鞘硅质细胞和栓质细胞的产生以及硅质细胞硅质的沉积;Kaufman等[11]用透射电子显微镜研究了燕麦节间表皮中硅质细胞和栓质细胞形成过程的超微结构变化;Agarie等[12]用扫描电镜结合X 射线能谱分析,观察研究了水稻叶表皮硅细胞的分布特征和硅含量的变化。在水稻、高粱、小麦等植物中的研究已表明,短细胞具有形态学分类依据[9,13]、硅质细胞具有抗倒伏、抗病[14]、抗旱性[15]等重要作用。也有研究认为植物体中硅的积累对提高植 物的 抗 旱 性[16-17]、抗 病 性[18-20]至 关 重 要;施 硅 能促进硅在叶片的积累和硅细胞的发育[21],调节气孔蒸腾促进光合[22],提高植物对水分的吸收和利用[23-24]。迄今为止未见系统研究玉米叶表皮短细胞的相关文献,且目前有关短细胞功能的研究均与硅细胞或外源硅对植物的作用有关,而对于具有大的细胞核、丰富的线粒体、粗面内质网的栓质细胞功能方面的研究,报道几乎是空白。因此,掌握玉米叶片短细胞发生发育过程的细胞学变化特征,对于进一步探究短细胞的新功能,阐明短细胞的功能与作用机理,提高玉米抗逆性,保障高产稳产至关重要。为此,本研究利用多项技术,在系统地观察研究玉米叶表皮短细胞的发生时期、发育过程、分布规律、形态结构特征的基础上,研究K+、H2O2在栓质细胞中的分布变化与表皮其它细胞中K+、H2O2的分布及气孔器开关的关系,旨在为短细胞功能和作用机理的研究,提供细胞学依据和新的线索与途径。
1 材料和方法
1.1 试验材料
供试玉米品种为‘郑单958’。试验于2014 年在西北农林科技大学试验田进行,6月中旬、6月下旬、7月上旬分别播种3次。
1.2 试验方法
1.2.1 短细胞发生时期观察 当玉米第1片叶的叶片刚露出叶尖端时,从叶基部(叶舌以上部分)剥离出嫩叶,将嫩叶从基部向顶部用刀片依次切成2.5×2.5mm2的小块,苏木精直接染色,光镜观察是否出现短细胞。每次分别取长势基本一致的3株玉米苗进行试验。玉米第2叶、第3叶、第4叶等的观察方法同上,直到发现短细胞出现为止。短细胞发生后,统计并记录50株玉米短细胞发生的叶位、玉米的叶期,3次重复。
1.2.2 短细胞发生和未发生的区分方法 宏观上,用尼康D3300单反相机对玉米叶背面进行拍照;微观上,根据栓质细胞和硅质细胞各自的特点,筛选出最优方案——番红甲苯胺蓝复染法。取玉米叶下表皮,番红染色约10min,蒸馏水冲洗后,再用甲苯胺蓝染色1min,蒸馏水冲洗干净,制成临时装片,Olympus BX51显微镜下观察拍照。
1.2.3 短细胞发育过程的观察 确定短细胞的发生时期后,当发生短细胞的叶片刚露出叶尖端时,观察方法同1.2.1。
1.2.4 不同叶位短细胞数目统计 短细胞在叶片不同部位的数量分布测定用单位面积计数法,选取5株长势基本一致的玉米,分别取每株玉米完全展开叶的第7、8、9叶靠近主叶脉的顶部、中部、基部及中部靠近叶边缘的4个部位的表皮,甲苯胺蓝染色,利用Olympus BX51显微镜,在20倍物镜下统计全视野内短细胞数目(不分别统计栓质细胞和硅质细胞数目),再换算成每mm2内短细胞数目,分析数据并计算各部位短细胞数目平均值及标准误。
1.2.5 短细胞形态学观察 将玉米叶片切成5×5 mm2的小块,常规扫描电镜样品制备法处理后,用Hitachi S-3400N 扫描电镜观察,拍照并记录结果。
1.2.6 短细胞解剖结构观察 将玉米叶片切成2×2.5mm2的小块,迅速放入体积分数为4%的戊二醛固定液进行固定,常规环氧树脂法对样品进行包埋,利用LKB-V 型超薄切片机,选取3个包埋块进行半薄切片,番红染色,Olympus BX51显微镜下观察拍照。
1.2.7 光暗处理条件下栓质细胞中K+分布观察 参考Raschke等[25]提出的方法,利用改进的亚硝酸钴铅钠组织化学染色法,对玉米叶表皮K+进行细胞化学定位。取玉米叶下表皮,放入2个分别装有1mL Mes-KCl负载缓冲液(pH6.15,10mmol·L-1Mes/KOH、50 mmol·L-1KCl、0.1 mmol·L-1CaCl2)的2mL离心管中,每个离心管放入3个表皮条,其中1个离心管套上黑色纸袋避光处理,然后将2 个离心管均放在温度23℃,光强度为350 μmol·m-2·s-1的光照培养箱中光照4h,之后分别取出表皮条,进行K+染色。对照组不做任何处理,将表皮直接进行K+染色,Olympus BX51显微镜下观察拍照,3次重复。
1.2.8 光暗处理条件下栓质细胞中H2O2的分布观察 H2O2表皮条的处理方法同上,进行光暗处理后,分别取出表皮条,对应放入2 个装有1 mL Tris-KCl负载缓冲液(pH7.2,10mmol·LTris、50mmol·L-1KCl)的2 mL 离心管中,再加入1 μL 荧光染液2,7-二氯荧光素 二乙酸 酯(H2DCFDA),摇匀后避光孵育15~20 min进行荧光染色,新鲜负载缓冲液漂洗3次,制成临时装片。对照组不做任何处理,将表皮直接进行荧光染色,在Olympus BX51荧光显微镜下观察拍照,3次重复。事先已验证表皮中无自发荧光物。
1.3 数据处理
采用Excel 2010处理数据,SPSS 17.0软件对数据 进 行 差 异 显 著 性 分 析,OriginPro 9.0 软 件作图。
2 结果与分析
2.1 短细胞的发生时期
根据1.2.1的观察方法,由图1可知,7叶期从新生叶的第7叶发生开始,所有玉米的第7叶就开始形成短细胞,此时极少数玉米第5叶,大部分玉米第6叶的基部在新产生表皮细胞的同时也开始形成短细胞,此后8叶期的第8、9叶期的第9叶从新生叶开始也全部发生短细胞,而之前第5、6叶未出现短细胞的植株随着玉米叶期的增多第5、6叶将不再发生短细胞,第5、6叶与第7、8、9叶发生短细胞的植株数差异显著,而不同叶期的相同叶位发生短细胞的植株数无显著性差异,并且所有玉米的1~4叶随着植株的生长也均无短细胞的出现。说明玉米叶表皮短细胞是同步发生在多叶位新表皮组织的形成过程中的,在7叶期第7叶新生叶发生时已经形成的表皮组织不再有短细胞的发生。

图1 不同叶期的不同叶位发生短细胞的植株数量图中不同小(大)写字母表示当P<0.05时,相同叶期的不同叶位(不同叶期的相同叶位)之间发生短细胞植株数量的显著性差异Fig.1 The plants number of maize generating short cells in different positions of different leaf stages Different normal(capital)letters indicated statistical significance between the plants number of maize generating short cells in different leaf positions of the same leaf stages(same leaf positions of the different leaf stages)at P<0.05
2.2 短细胞发生和未发生叶片宏观和微观水平的结构特征
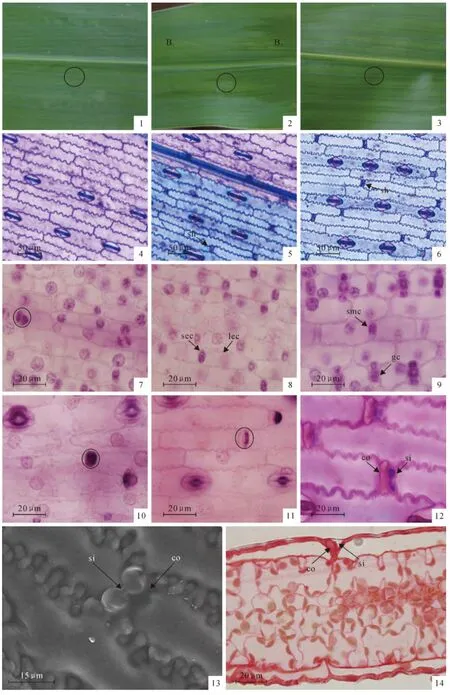
根据试验观察发现,未发生短细胞的玉米叶片(图版Ⅰ,1)与发生短细胞的玉米叶片(图版Ⅰ,3)不同;就同一玉米叶片(图版Ⅰ,2)未发生的部位(B1)与发生短细胞的部位(B2)也不同。发生短细胞的部位较未发生短细胞的部位有1层蜡质膜的覆盖,且发亮,手感光滑,叶片较厚。说明短细胞发生后,在视觉和触觉上玉米叶片外部均发生了变化,并且随着叶片的继续生长,未发生短细胞的部位以后也不会发生短细胞。对表皮进行常规染色观察发现,未出现短细胞的部位被染成紫色(图版Ⅰ,4、5),出现短细胞的部位被染成紫蓝色(图版Ⅰ,5、6),这可能是短细胞发生后,表皮细胞的组成成分发生了变化,导致相同的染液着色不同。短细胞发生后可看到气孔器和短细胞大多数不在同列排列,每2列气孔器之间相隔2~3列的长细胞间夹有短细胞(图版Ⅰ,5、6)。
2.3 短细胞的发育过程
随着叶片的生长发育,初期分化的表皮细胞进行不对称的细胞分裂(图版Ⅰ,7圆圈所示),生成相互交替的长、短细胞(图版Ⅰ,8),有些短表皮细胞纵(平行叶脉)分裂,逐渐分化为保卫细胞(图版Ⅰ,9),在这个过程中,夹在2列气孔器间的2~3列短细胞的前体母细胞(图版Ⅰ,9),开始进行横(垂直叶脉)分裂,产生2个子细胞(图版Ⅰ,10圆圈所示),其中一个子细胞的细胞核逐渐退化,最终消失,另一个子细胞的核继续保留(图版Ⅰ,11圆圈所示),细胞核退化的细胞开始积累硅质,最终形成硅质细胞,另一个细胞不积累硅质,细胞核完好,最终形成栓质细胞。成熟的栓质细胞呈面包形柱状,硅质细胞呈哑铃形扁状,形成栓质、硅质细胞对(图版Ⅰ,12)。
2.4 短细胞的分布规律
由图2可知,同一叶片中靠近主叶脉的部位,从顶部、中部到基部,短细胞密度依次呈显著性增加;随着叶位的升高,不同叶片的顶部、中部、基部短细胞密度均呈显著性增大。从图3可看出,同一叶片中,叶片中部靠近主叶脉的部位较叶边缘的部位短细胞密度大,随着叶位的上升,两部位短细胞密度差异减小;不同叶片中靠近主叶脉和叶边缘的部位随着叶位的上升,两部位短细胞密度均呈显著性增大。综上说明从低位叶到高位叶,叶片各部位短细胞密度都在增大。
2.5 短细胞的形态结构

图2 不同叶位靠近主叶脉的不同部位短细胞密度比较图中不同小(大)写字母表示当P<0.05时,同一叶位的不同部位(不同叶位的相同部位)之间短细胞密度的显著性差异Fig.2 The comparison of short cells density in different parts of the different leaf positions near the main leaf vein Different normal(capital)letters indicated statistical significance between short cells density in different parts of the same leaf positions(same parts of the different leaf positons)at P<0.05
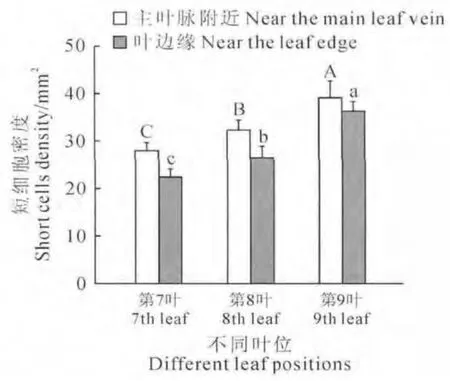
图3 不同叶位叶片中部靠近主叶脉与靠近叶边缘短细胞密度比较图中不同小(大)写字母表示当P<0.05时,不同叶位的相同部位之间短细胞密度的显著性差异Fig.3 The comparison of short cells in the leaf middle of the different leaf positions near the main leaf vein and the leaf edge Different normal(capital)letters indicated statistical significance between short cells density in same parts of the different leaf positons at P<0.05
短细胞扫描电镜形态观察发现,表面观形状为哑铃形扁状的细胞为短细胞中的硅质细胞,与其相邻的面包形柱状细胞为栓质细胞,栓质细胞与硅质细胞不在一个平面上,相对于硅质细胞向叶片内部凹陷(图版Ⅰ,13);光镜下观察玉米叶片的解剖结构纵切图,可以清楚地看到被番红着色的栓质细胞,栓质细胞与长细胞厚度相近,基部与叶肉细胞相邻,而硅质细胞夹在栓质细胞与长细胞之间偏上,几乎未被着色,这与硅质细胞的组成成分有关,并且厚度较薄,与硅质细胞形态观察相一致(图版Ⅰ,14)。
2.6 光暗处理条件下栓质细胞中K+分布变化与表皮其它细胞中K+分布及气孔器开关的关系
对表皮进行K+染色后观察发现,对照组(图版Ⅱ,1、4)的保卫细胞、副卫细胞、短细胞中的栓质细胞都有黄黑色沉淀物的积累,即为K+;与对照组相比,光处理后(图版Ⅱ,2、5),保卫细胞黄黑色沉淀物,即K+积累增多,而副卫细胞和栓质细胞几乎没有K+积累,说明光处理后,气孔器打开,导致了K+在保卫细胞大量积累;与对照组相比,暗处理后(图版Ⅱ,3、6),可看到副卫细胞和栓质细胞有黄黑色沉淀物,即K+大量积累,而保卫细胞几乎没有K+积累,说明暗处理后,气孔器关闭,导致了K+在副卫细胞的积累。但结合光暗处理结果分析可知,栓质细胞中K+积累变化始终和副卫细胞K+积累变化相一致,而硅质细胞和长细胞在光暗处理诱导的气孔器运动过程中始终没有K+积累。综上说明栓质细胞K+积累变化与光暗诱导的气孔器开关有关。
2.7 光暗处理条件下栓质细胞中H2O2 分布变化与表皮其它细胞中H2O2 分布及气孔器开关的关系
对表皮进行H2O2荧光染色后观察发现,对照组(图版Ⅱ,7、10)有发荧光的保卫细胞、副卫细胞和短细胞中的栓质细胞,说明保卫细胞、副卫细胞和栓质细胞有H2O2积累;与对照组相比,光处理后(图版Ⅱ,8、11),保卫细胞发微弱的荧光,积累了少量的H2O2,而副卫细胞和栓质细胞不发荧光,没有H2O2积累,说明光处理后,气孔器打开,导致了H2O2在保卫细胞、副卫细胞和栓质细胞的积累均减少;与对照组相比,暗处理后(图版Ⅱ,9、12),保卫细胞、副卫细胞和栓质细胞的荧光强度均增强,说明暗处理后气孔器关闭,导致了H2O2在保卫细胞、副卫细胞的大量积累。但结合光暗处理分析可知,栓质细胞中H2O2积累变化始终和副卫细胞H2O2积累变化相一致,而硅质细胞和长细胞在光暗处理诱导的气孔器运动过程中始终没有H2O2积累。综上说明栓质细胞中H2O2积累变化与光暗诱导的气孔器开关有关。
3 讨 论
3.1 短细胞发生发育过程的形态学变化特征
有研究发现,小麦拔节以后第9叶便开始出现短细胞[26],高粱幼苗三叶期的3片叶,贴叶脉的上、下表皮中已经出现了短细胞,但是贴叶肉的上、下表皮中却无短细胞[15]。本研究结果表明,玉米叶表皮短细胞是同步发生在多叶位新表皮组织的形成过程中,所有植株第7新生叶,极少数植株第5叶、大部分植株第6叶从叶基部同时开始发生短细胞,1~4叶无短细胞发生。这与前人报道的短细胞发生时期不一致,可能是由于不同属间存在差异所致。有研究认为,在禾本科植物中,叶片表皮的短细胞是由初期发育的表皮细胞分化而来的[27],本试验通过常规染色光镜观察,清楚系统地展示了短细胞发育过程的每个阶段,初期发育的叶表皮细胞进行不对称分裂,产生相互交替的长、短细胞,有的短表皮细胞垂直叶脉分裂,形成栓质细胞和硅质细胞对,有的短表皮细胞平行叶脉分裂形成保卫细胞,最终和副卫细胞组成气孔器。这与前人研究燕麦短细胞发育过程[9]相似,但该文献只有简单的文字描述并无相应的图片佐证。结构是功能的基础,植物结构的变化必然会直接影响到植物生理生态功能的改变[13],本试验就短细胞的形态结构特征观察发现,硅质细胞较栓质细胞厚度薄,2种细胞不在一个平面上,表面观形态特征也不同,栓质细胞为面包形柱状细胞,硅质细胞为哑铃形扁细胞,栓质细胞基部与叶肉细胞相邻,硅质细胞嵌在栓质细胞和表皮细胞间偏上。同一叶片表皮有无短细胞部位对同一染色剂着色有明显的差异。染色是利用染色剂与细胞内的某些成分发生作用,通过光谱吸收和折射,使其各种微细结构能显现不同颜色的过程。短细胞出现后表皮细胞的着色发生了变化,说明短细胞对周围相邻的其它表皮细胞的代谢有影响。
有研究表明,蜡质结构的形成受植株生长发育阶段和环境条件的综合影响[28],叶片表面的蜡状物质是植物抵御外界胁迫的第一层保护性屏障[29]。Jenks等[30]认为蜡质的积累能抵抗病菌入侵,也有研究认为[31]蜡质含量的增加能提高植物抗旱能力。Bianchi等[32]指出,玉米表皮蜡质合成有两种途径,一种是在幼叶的前5叶或前6叶,另一种是发生在玉米整个生命周期。前一种情况与我们观察到的玉米叶片短细胞发生时期相吻合。本研究发现,发生短细胞的叶片较未发生的叶片背面发亮,用手触摸,叶片较厚,叶面光滑,很清楚看到叶表面有明显的蜡质层覆盖,并且撕取表皮后染色观察确实发生了短细胞。说明玉米叶表皮短细胞的生成与蜡质的积累有相关性。植物蜡质的合成和运输是一个非常复杂的过程,需要一系列酶和编码这些酶的基因参与。蜡质主要由内质网合成,转运途径有两种假说:第一种是蜡质组分从内质网到质膜的直接运输;第二种是内质网合成后,由囊泡转运至高尔基体经修饰加工后通过胞吐作用转向质膜运输[33]。这样,比长细胞核大、质多、质浓、线粒体、核糖体、内质网和高尔基体丰富得多的栓质细胞,是否参与表皮沉积的蜡质的合成转运或调节,值得研究。
3.2 栓质细胞中K+、H2O2 分布及其与气孔器开关的关系
K+是植物细胞中含量最丰富的阳离子之一,对生物体具有重要的生理功能,如调节气孔器运动,增强植物光合、蒸腾速率及植株体内物质的合成,提高能量代谢等[34]。气孔器运动是由保卫细胞的膨压变化引起的,K+被证明是引起保卫细胞膨压变化最重要的离子[35]。Majore等[36]采用全细胞电压钳技术证实了玉米气孔器运动是保卫细胞和副卫细胞K+互相转移调节的结果。Sirichandra等[37]也发现玉米体内保卫细胞和副卫细胞K+通道表达相反。我们用细胞化学染色技术,观察研究了光照和黑暗条件诱导的气孔器开关过程中K+在长、短细胞,保卫和副卫细胞中的变化,不仅验证了Raschke等[25]的气孔器张开时K+积累在保卫细胞中,副卫细胞几乎没有,关闭时K+积累在副卫细胞,保卫细胞几乎没有,而且发现短细胞中的栓质细胞有K+积累,硅质细胞则没有。更有意义的是栓质细胞中K+积累与气孔器的开关有关,气孔器张开时栓质细胞中几乎没有K+积累,气孔器关闭时栓质细胞积累了大量的K+,与相距较远的副卫细胞中K+积累变化一致,而位于栓质细胞和副卫细胞之间的长细胞却没有K+分布。这些充分说明,栓质细胞K+积累与气孔器的开关存在一定的联系。
过氧化氢(hydrogen peroxide,H2O2)是活性氧(reactive oxygen species,ROS)重要的代表之一,化学性质比较稳定,存留时间较长。起初认为H2O2在植物体内的产生与积累有害,会损伤细胞膜系统,近期研究认为在胁迫条件下产生的H2O2是植物感知并传递胁迫信号的重要分子,其在各种刺激引起的气孔器运动信号级联反应中起着中心调节作用[38]。阎炜等[39]发现,在光/暗调控下H2O2可调节气孔器的运动。Lee 等[40]认为保卫细胞内源H2O2的产生是激发子诱导气孔器关闭必需的信号分子。现研究普遍认为,气孔器关闭时,保卫细胞积累了大量的H2O2[41-42],近期研究发现[7],不仅保卫细胞中的H2O2对气孔器的运动有调节作用,副卫细胞中的H2O2也有作用,但调节机理不完全相同。气孔器张开时,保卫细胞有少量H2O2积累,而副卫细胞没有;当气孔器关闭时,保卫细胞和副卫细胞中H2O2积累都大增。本研究发现,栓质细胞中积累的H2O2与K+一样,随着气孔器的开关呈周期性变化,即气孔器张开时,栓质细胞中几乎没有H2O2积累,气孔器关闭时栓质细胞中积累了大量的H2O2,也与副卫细胞中H2O2积累变化一致,但硅质细胞和长细胞中始终没有H2O2积累。
尽管现在还不清楚气孔器关闭时,栓质细胞中积累大量K+和H2O2的具体功能,与相距较远的副卫细胞中K+和H2O2积累又为何一致,并随气孔器的开关呈周期性变化,而相邻且位于栓质细胞和副卫细胞之间的长细胞中却没有。我们还发现,随着水分胁迫的加重,玉米叶片气孔器开度逐渐降低的同时,副卫细胞中K+和H2O2积累逐渐增加,栓质细胞中K+和H2O2积累也逐渐增加(图略),栓质细胞中K+和H2O2积累的多少与气孔器开度呈负相关。K+和H2O2是目前公认的调节气孔器开关的重要因子,而气孔又是植物蒸腾过程中水蒸气从体内排到体外的主要出口,也是光合作用和呼吸作用与外界进行气体交换的通道,气孔器的开关直接影响着植物蒸腾、光合、呼吸等重要的生理过程。因此可推测,始终保持高度活性的栓质细胞是否会通过调控K+和H2O2变化,影响气孔器的开度,调节光合、呼吸强度和蒸腾速率来提高植物抵抗非生物逆境、生物逆境以及病菌侵袭的能力等,还需进一步的研究证实。本研究可为该方面的深入探索,尤其是栓质细胞功能和作用机理的研究,提供细胞学依据或新的线索与途径。
[1] ZHAO L H(赵立华),HU ZH H(胡中会),LI CH Y(李成云),et al.The effect of different shading degrees on maize leave structure[J].Chinese Agricultural Science Bulletin(中国农学通报),2012,28(6):43-46(in Chinese).
[2] GILES K L,BEARDSELL M F,COHEN D.Cellular and ultrastructural changes in mesophyll and bundle sheath cells of maize in response to water stress[J].Plant Physiol,1974,54:208-212.
[3] WANG SH F(王盛锋),GAO L L(高丽丽),LIU Z F(刘自飞),et al.Effect of zinc on maize leaf cell ultrastructure under different soil moistures[J].Chinese Journal of Eco-Agriculture(中国生态农业学报),2013,21(8):959-965(in Chinese).
[4] HUMPHRIES J A,VEJLUPKOVA Z,LUO A,et al.ROP GTPases act with the receptor-like protein PAN1to polarize asymmetric cell division in maize[J].The Plant Cell,2011,23:2 273-2 284.
[5] FARQUHARSON K L.Polarization of subsidiary cell division in maize stomatal complexes[J].The Plant Cell,2012,24:4 313.
[6] ZHANG X G,FACETTE M,HUMPHRIES J A,et al.Identification of PAN2by quantitative proteomics as a leucine-rich repeat-receptorlike kinase acting upstream of PAN1to polarize cell division in maize[J].The Plant Cell,2012,24:4 577-4 589.
[7] YAO Y Q,LIU X P,LI Z Z,et al.Drought-induced H2O2accumulation in subsidiary cells is involved in regulatory signaling of stomatal closure in maize leaves[J].Planta,2013,238:217-227.
[8] KAUFMAN P B,PETERING L B,SONI S L.Ultrastructural studies on cellular differentiation in internodal epidermis of Auena satiua[J].Phytomorphology,1970,20:281-309.
[9] XU A J(徐爱菊).Review on the plant cork cells and silica cells[J].Bulletin of Biology(生物学通报),1989,(7):4,9(in Chinese).
[10] BLACKMAN E.Observations on the development of the silica cells of the leaf sheath of wheat(Triticum aestiuum)[J].Canadian Journal of Botany,1969,47:827-838.
[11] KAUFMAN P B,PETERING L B,SMITH J G.Ultrastructural development of cork-silica cell pairs in avena internodal epidermis[J].Botanical Gazette,1970,131:173-185.
[12] AGARIE S,AGATA W,UCHIDA H,et al.Function of silica bodies in the epidermal system of rice(Oryza sativa L.):testing the window hypothesis[J].Journal of Experimental Botany,1996,47:655-660.
[13] WANG H Q(王海清),XU ZH(徐 柱),QI J(祁 娟).Prospect and progress of leaf blade comparative anatomy of Poaceae in China[J].Grassland and Turf(草原与草坪),2009,(2):93-97(in Chinese).
[14] YANG B Y(杨秉耀),CHEN X F(陈新芳),LIU X D(刘向东),et al.Observation of silicon cells on the leave surface in different varieties of rices[J].J.Chin.Electr.Microsc.Soc.(电子显微学报),2006,25(2):146-150(in Chinese).
[15] XU A J(徐爱菊),LU P ZH(鲁鹏哲),WANG X P(王献平).Silica cells and silica bodies in vegetative organ of sorghum(Sorghum vulgares Pers.)[J].Acta Agron.Sin.(作物学报),1990,16(1):57-63(in Chinese).
[16] GONG H J,CHEN K M,CHEN G C,et al.Effects of silicon on growth of wheat under drought[J].J.Plant Nutr.,2003,26:1 055-1 063.
[17] GONG H J,ZHU X Y,CHEN K M,et al.Silicon alleviates oxidative damage of wheat plants in pots under drought[J].Plant Sci.,2005,169:313-321.
[18] SUN W CH(孙万春),LIANG Y CH(梁永超).Influences of silicon and inoculation with colletotrichum lagenarium on peroxidase activity in leaves of cucumber and their relaion to resistance to anthracnose[J].Sci.Agric.Sin.(中国农业科学),2002,35(12):1 560-1 564(in Chinese).
[19] YANG Y F(杨艳芳),LIANG Y CH(梁永超),LOU Y SH(娄运生).Influences of silicon on peroxidase,superoxide dismutase activity and lignin content in leaves of wheat(Tritium aestivum L.)and its ralation to resistance to powdery mildew[J].Sci.Agric.Sin.(中国农业科学),2003,36(7):813-817(in Chinese).
[20] XUE G F(薛高峰),SUN W CH(孙万春),SONG A L(宋阿琳),et al.Influence of silicon on rice growth,resistance to bacterial blight and activity of pathogenesis-related proteins[J].Sci.Agric.Sin.(中国农业科学),2010,43(4):690-697(in Chinese).
[21] WANG H ZH(王惠珍),YU M(喻 敏),XIAO H D(萧洪东),et al.Influences of si on si cells formation and content of soluble sugars in seashore paspulum(Paspalum vaginatum Swarfz.)under different light duration[J].Journal of Huazhong Agricultural University(华中农业大学学报),2007,26(4):482-485(in Chinese).
[22] LI Q F,MA C C,SHANG Q L.Effect of silicon on photosynthesis and antioxidative enzymes of maize under drought stress[J].Chinese Journal of Applide Ecology,2007,18(3):531-536.
[23] HATTORI T,INANAGA S,ARAKI H,et al.Application of silicon enhanced drought tolerance in Sorghum bicolor[J].Physiol.Plant.,2005,123:459-466.
[24] GAO X P,ZOU C Q,WANG L J,et al.Silicon improves water use efficiency in maize plants[J].Journal of Plant Nutrition,2005,27:1 457-1 470.
[25] RASCHKE K,FELLOWS M P.Stomatal movement in Zea mays:shuttle of potassium and chloride between guard cells and subsidiary cells[J].Planta,1971,101:296-316.
[26] DUAN X CH(段续川),XU L Q(许霖庆),ZUO B Y(左宝玉),et al.Studies on the leaf cells of wheat-the ontogeny of winter wheat and variations in the structure of the mesophyll and many other types of cells[J].Bulletin of Botany(植物学报),1974,16(3):254-262(in Chinese.
[27] CAI L B(蔡联炳),GUO Y P(郭 延平).Studies on constituent cells of leaf epidermis,systematics and phylogenetic path of the family poaceae[J].Acta Bot.Boreali-Occident Sin.(西北植物学报),1995,15(4):323-335(in Chinese).
[28] PENNY VON W K.Ultrastructure and origin epicuticular wax tubes[J].Journal of Ultrastructure Research,1974,46:483-498.
[29] RIEDERER M.Thermodynamics of the water permeability of plant cuticles:characterization of the polar pathway[J].Journal of Experiment Botany,2006,57:2 937-2 942.
[30] JENKS M A,JOLY R J,PETERS P J,et al.Chemically induced cuticle mutation affecting epidermal conductance to water vapor and disease susceptibility in Sorghum bicolor L.Moench[J].Plant Physiol,1994,105:1 239-1 245.
[31] BOURDENX B,BERNARD A,DOMERGUE F,et al.Overexpression of arabidopsis ECERIFERUM1promotes wax very-long-chain alkane biosynthesis and influences plant response to biotic and abiotic stresses[J].Plant Physiol,2011,156:29-45.
[32] BIANCHI A,BIANCHI G,AVATO P,et al.Biosynthetic pathways of epicuticular wax of maize as assessed by mutation,light,plant age and inhibitor studies[J].Maydica,1985,30:179-198.
[33] KURATA J,KAWABATA-AWAI C,SAKURADANI F,et al.The YORE-YORE gene regulates multiple aspects of epidermal cell differentiation in Arabidopsis[J].Plant J,2003,36:55-66.
[34] NI W ZH(倪吾钟),HE N Z(何念祖),LIN R X(林荣新).Study on K-nutrition of Chinese cabbage and its physiological mechanism[J].Journal of Plant Nutrition and Fertilizer(植物营养与肥料学报),1997,3(2):117-121(in Chinese).
[35] 武维华.植物生理学[M].北京:科学出版社,2008:66.
[36] MAJORE I,WILHELM B,MARTEN I.Identification of K+channels in the plasma membrane of maize subsidiary cells[J].Plant and Cell Physiology,2002,43:844-852.
[37] SIRICHANDRA C,WASILEWSKA A,VLAD F,et al.The guard cell as a single-cell model towards understanding drought tolerance and abscisic acid action[J].Journal of Experimental Botany,2009,60:1 439-1 463.
[38] SONG Y W,MIAO Y C,SONG C P.Behind the scenes:the roles of reactive oxygen species in guard cells[J].New Phytol.,2014,201:1 121-1 140.
[39] YAN W(阎 炜),YANG L J(杨利娟),WANG B J(王保军).The role and mechainsms of Auxin and Cytokinin in light/dark-regllated stomatal movement[J].Journal of Shaanxi Normal University (Natural Science Edition)(陕西师范大学学报·自然科学版),2010,38(1):75-78(in Chinese).
[40] LEE S,CHOI H,SUH S,et al.Oligogalacturonic acid and chitosan reduce stomatal aperture by inducing the evolution of reactive oxygen species from guard cells of tomato and Commelina communis[J].Plant Physiol.,1999,121:147-152.
[41] ZHANG X,ZHANG L,DONG F C,et al.Hydrogen peroxide is involved in abscisic acid induced stomatal closure in Vicia faba[J].Plant Physiol.,2001,126:1 438-1 448.
[42] SHE X P,SONG X G,HE J M.Role and relationship of nitric oxide and hydrogen peroxide in light/dark-regulated stomatal movement in Vicia faba[J].Acta Botanica Sinica,2004,46:1 292-1 300.
图版说明:
图版Ⅰ 图1~6.短细胞发生和未发生的区别:1~3.叶片背面;1~2(B1).未发生短细胞;2(B2)~3.发生短细胞;4~6.图1~3圆圈中对应的表皮,番红甲苯胺蓝复染色;sh.短细胞;图7~12.短细胞的发育过程:7~11.苏木精染色;12.番红甲苯胺蓝复染色;sec.短表皮细胞;lec.长表皮细胞;smc.短细胞的母细胞;gc.保卫细胞;co.栓质细胞;si.硅质细胞;圆圈示发育中的短细胞;图13~14.短细胞的形态结构:13.扫描电镜形态观察;14.叶片纵切面;si.硅质细胞;co.栓质细胞。
Explanation of plates:
PlateⅠ Fig.1-6.The differences between generation and non-generation of short cells:Fig.1-3.abaxial leaf;Fig.1-2(B1).short cells non-generation;Fig.2(B2)-3.short cells generation;Fig.4-6.corresponding epidermis of the circle in figure 1-3,counterstain of safranin and toluidineblue;sh.short cell;Fig.7-12.The development process of short cells:Fig.7-11.hematoxylin staining;Fig.12.counterstain of safranin and toluidineblue;sec.short epidermal cell;lec.long epidermal cell;smc.short mother cell;gc.guard cell;co.cork cell;si.silica cell;the circle indicated the development of short cell;Fig.13-14.The morphological structure of short cells:Fig.13.SEM morphology;Fig.14.leaf longitudinal section;si.silica cell;co.cork cell.
图版Ⅰ PlateⅠ

图版Ⅱ 图1~6.光暗处理条件下栓质细胞中K+的分布变化:1、4.对照;2、5.光处理;3、6.暗处理;si.硅质细胞;co.栓质细胞;圆圈示短细胞;图7~12.光暗处理条件下栓质细胞中H2O2 的分布变化:7、10.对照;8、11.光处理;9、12.暗处理;co.栓质细胞;圆圈示短细胞。PlateⅡ Fig.1-6.The distribution change of K+in the cork cells under the light and dark treatment:Fig.1and 4.control;Fig.2and 5.light treatment;Fig.3and 6.dark treatment;si.silica cell;co.cork cell;the circle indicated the short cell;Fig.7-12.The distribution change of H2O2in the cork cells under the light and dark treatment:Fig.7and 10.control;Fig.8and 11.light treatment;Fig.9and 12.dark treatment;co.cork cell;the circle indicated the short cell.
