玉米萜类植保素代谢关键基因对小斑病侵染的防御响应分析
2015-07-05杜鹏飞
李 珂,马 良,杜鹏飞,王 强
(四川农业大学 农学院,成都611130)
玉米小斑病是玉米的常见病害,喜温暖潮湿的环境,在世界各个玉米产区都有发生。该病是由玉蜀黍平脐孺胞引起的真菌性病害[1],病原菌以菌丝或分生孢子在病株残体外越冬,菌丝发育温度范围在10~35℃,适温为28~30 ℃,pH 2.6~10.0,最适pH 8.7[2]。玉米小斑病主要发生在叶部,叶片被害后,叶片组织光合机能受影响,一般造成15%~20%的减产,严重时可达50%以上[3]。植保素为植物受到病原菌侵染后产生的具有物种特异性的次生代谢产物,具有广谱抑菌活性,积极参与植物的生物防御响应。2011年,玉米中发现了两类植保素Zealexin[4]和Kauralexin[5],分别为倍半萜和二萜化合物,具有对禾谷镰刀菌、黄曲霉菌、炭疽菌和小孢根霉的抑菌活性,也能被这些病原菌侵染诱导积累。这两类萜类植保素分别由母体倍半萜(β-macrocarpene)和二萜(异)贝壳杉烯[ent-(iso)kaurene]经过氧化修饰而来,其代谢关键基因为TPS6、TPS11和An2,分别编码萜类合成酶催 化β-macrocarpene和(异)贝 壳 杉 烯 的 产 生[6-7]。已有研究表明,这些代谢关键基因同样能够被病原菌侵染所诱导表达,和玉米萜类植保素的诱导积累呈正相关性[4-5],可以作为指纹基因分析这两类植保素的积累情况。植物对生物胁迫的响应往往依赖植物激素的参与和调控,外源施加茉莉酸和乙烯能够协同诱导Zealexin和Kauralexin的产生[4-5],推测这两类植保素的生物合成受茉莉酸和乙烯的调控。有报道表明茉莉酸甲酯能够诱导水稻、葡萄、高粱等多种植物中植保素的积累[8],显示茉莉酸介导的植保素代谢机制广泛存在于高等植物中。
虽然现有研究发现Zealexin 和Kauralexin 能够被多种病原菌诱导所积累,参与生物胁迫防御响应[4-5],但在玉米小斑病防御响应中的角色并不清楚,茉莉酸是否参与其中、这两类植保素是否与各个自交系的不同抗病性有关也亟待深入研究。本研究通过分析不同抗性自交系被小斑病病原菌侵染后Zealexin、Kauralexin和茉莉酸生物合成关键基因的表达模式,为阐明萜类植保素参与小斑病防御响应的机理奠定基础,也为抗性育种提供理论依据。
1 材料和方法
1.1 实验材料及处理
根据以往研究[9],本研究使用对小斑病具有不同抗性的3个玉米自交系Mo17(较抗)、‘郑58’(中抗)、‘吉419’(感)作为研究材料。各取10粒饱满种子,经氯化汞(1%)表面消毒,在培养箱发芽后播种于装有高温灭菌土壤的培养钵中,每个自交系种植10盆,每盆1株,放于温室中培养生长。玉米小斑病病原菌用PDA 培养基,28 ℃恒温培养,待菌落铺满平板,用无菌水将病原菌分生孢子洗下,用0.1%吐温-20无菌水配成浓度为每毫升105个孢子的悬浮液。当玉米生长到21~28d时,采用喷雾接种法将孢子悬浮液喷于植株表面,喷雾后将玉米苗套袋保湿。玉米接种小斑病病原菌后的0、6、12、24、36和48h,以0h为对照,取对照组和处理组玉米相同部位叶片0.5~1.0g,液氮研磨成粉末于-80℃保存,取材过程中观察有无病斑产生并记录。玉米自交系叶片总RNA 采用Trizol方法提取,并用1%琼脂糖凝胶电泳检测RNA 的完整性,用Nanodrop2000测定浓度。
1.2 An2基因表达的RT-PCR分析
质量检测合格的RNA 使用宝生物的M-MLV反转录试剂盒按照说明进行反转录合成cDNA。以Ef1α作为内参基因,根据NCBI数据库中Ef1α(GenBank 登 录 号NM-001112465)和An2(Gen-Bank登录号NM-001111787)的基因序列,在Primer 3上设计特异性引物用于半定量RT-PCR 分析(表1)。其扩增条件为95 ℃预变性5min,95 ℃变性30s,55 ℃退火30s,72 ℃延伸1min,30个循环。内参基因和目的基因分别进行PCR。扩增产物用1%琼脂糖凝胶电泳检测,Gelred染色照相。
1.3 TPS6、TPS11、An2 和AOC 基因表达的qRTPCR 分析
为了定量分析玉米萜类植保素代谢关键基因表达情况,使用Primer 3在线软件设计荧光定量PCR特异性引物,确保每对引物Tm 值相同,在60 ℃左右,引物G+C 含量在40%~60%,避免自我互补和3′端重复的G 或C,扩增片段大小在80~120 bp。以接种小斑病病原菌不同时间后材料的cDNA作为模板,以Ef1a 作为内参基因,使用Bio-Rad公司的SsoFast Eva Green Supermix 试剂在Bio-Rad CFX96 荧光定量PCR 仪上进行检测。反应程序为95 ℃预变性3min;95℃变性15s,55℃退火15s,72 ℃延伸20s,40个循环,每个样品均设3个重复,采用 仪 器 自 带 的Bio-Rad CFX Manager 软 件 按2-ΔCt法处理数据,使用Origin 9 作图。Ef1a 引物同时用于半定量和定量PCR。

表1 RT-PCR和qRT-PCR分析引物Table 1 The primers for RT-PCR and qRT-PCR analysis
2 结果与分析
2.1 小斑病病原菌诱导An2基因表达的RT-PCR分析
不同抗性玉米叶片中An2基因表达的半定量RT-PCR 结果(图1)显示,接种后48h内,An2基因表达呈现明显增加趋势,其中Mo17和‘吉419’的An2表达呈先增后降再增加的趋势。接种0~6h内,‘郑58’叶片中未检测到An2的积累,接种24h时An2有明显积累。接种后48h,Mo17、‘郑58’和‘吉419’的An2表达量达到高峰。半定量RT-PCR分析显示玉米萜类植保素代谢能够响应小斑病病原菌的侵染,不同抗性品种中An2 均能被诱导表达,推动Kauralexin的诱导积累以参与对小斑病病原菌的防御。
2.2 小斑病病原菌诱导TPS6、TPS11、An2基因表达的qRT-PCR分析

图1 小斑病病原菌胁迫下3种不同抗性玉米自交系中An2基因表达的RT-PCR分析Fig.1 RT-PCR analysis of An2gene expression in three maize inbred lines in response to C.heterostrophus infection
上述的实验证明玉米萜类植保素代谢能够响应小斑病病原菌的侵染,为了准确分析各个自交系在小斑病病原菌侵染下萜类植保素的防御响应和代谢差异,运用实时荧光定量PCR 检测Zealexin 和Kauralexin生物合成的关键基因TPS6、TPS11、An2的表达模式。结果(图2)显示,Mo17中TPS6、TPS11基因基本不被诱导表达,甚至TPS11 基因表达还有少许下调。‘郑58’中TPS6基因表达量呈现先增加后减少的趋势,在小斑病病原菌侵染12 h后,TPS6、TPS11 基因表现出明显的上调趋势,在24h时2 个基因表达量达到最大。‘吉419’中TPS6、TPS11 基因表达量在侵染12h 后逐渐增加,但要慢于‘郑58’,在48h后才达到最大。相对于TPS6、TPS11,‘吉419’中An2基因诱导表达趋势明显,在侵染24h 后就达到最大,这与半定量RT-PCR 结果有一定差异,表明后者结果的不确定性,需定量PCR 进行准确分析。Mo17的An2基因在侵染后的早期就被诱导表达,表明其具有对病原菌侵染的快速响应机制。‘郑58’中An2基因尽管被诱导表达,但上升幅度不显著。总的来说,对于TPS6、TPS11,‘郑58’基 因 诱 导 表 达 快 于‘吉419’,而Mo17中TPS6、TPS11诱导不明显,但其本底表达高于其余2个自交系。而对于An2,Mo17中基因诱导表达明显快于另外2个自交系。
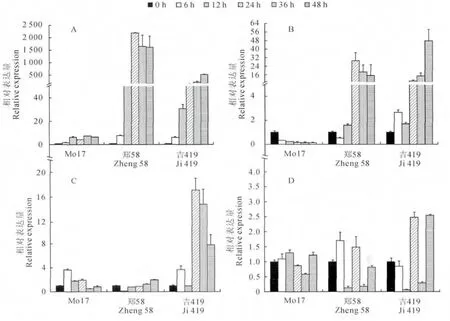
图2 玉米小斑病病原菌侵染下3种玉米自交系中TPS6(A)、TPS11(B)、An2(C)和AOC(D)基因表达定量分析Fig.2 qRT-PCR analysis of gene expression of TPS6(A),TPS11(B),An2(C)and AOC(D)in three maize inbred lines in response to C.heterostrophus infection
2.3 茉莉酸代谢关键基因AOC 的qRT-PCR分析
茉莉酸广泛参与植物的胁迫响应,其生物合成关键基因AOC 的表达情况能够反映出植物体内茉莉酸代谢情况及其对植物代谢的调控,结合植保素代谢基因的防御响应表达模式,能推测出茉莉酸和植保素代谢在生物胁迫防御中的关系。结果(图2,D)显示,接种小斑病病原菌后,Mo17中AOC 基因表达表现为先增加后减少再增加的趋势,在12h表达量最大;‘郑58’中AOC 基因表达量在6 和24h上调,12h基因表达量最低;‘吉419’中AOC 基因表达有下调的趋势,在12h基因表达量最低。随着侵染时间延长,‘吉419’中AOC 基因表达量在24h明显增加,差异显著,在48h达到最高。
3 讨 论
植物与环境长期相互作用下自身会形成一套精密的防御网络系统,比如诱导合成植保素、茉莉酸等小分子化合物参与生物或非生物胁迫应答。分析合成萜类植保素和防御激素茉莉酸关键基因的表达情况,对于研究不同抗性自交系/品种的次生代谢产物对玉米小斑病防御响应有重要意义。以往的研究已经确定玉米萜类植保素代谢关键基因的诱导表达和植保素的诱导积累具有正相关性[4-5]。相对于测定植保素含量的复杂提取步骤和昂贵的GC-MS 分析,用PCR 技术分析植保素合成关键基因的表达进而确定植保素的代谢情况更加便捷实惠。本研究中,采用半定量和定量PCR 分析发现不同抗性自交系对小斑病病原菌侵染表现出不同的防御响应机制。Mo17在病原菌侵染过程中,TPS6、TPS11基因诱导表达不显著,而An2 基因表达迅速增加,AOC 基因表达在接种0~12h 内明显上调。‘郑58’在接种小斑病病原菌后,TPS6、TPS11基因表达为先增加后减少的趋势,在24h 积累量达到高峰。An2 基因表达逐渐增加但差异不显著。而AOC 基因表达量在接种6h 后显著增加。当‘吉419’受到病原菌侵染时,TPS6、TPS11基因表达量逐渐增加,但要慢于‘郑58’,而An2基因尽管在侵染24h时表达量达到最大,但响应时间明显迟于另外2个抗性自交系。
抗病与感病株系的一个主要差异在于能否快速激发自身的防御机制及时地限制病原体的入侵。抗病株系会快速激活大范围的防御响应,阻止病原体进一步入侵。但是,感病株系只表现出微弱的响应并且不能限制病原体的入侵和生长,结果可能会导致植物严重的损伤和大量的细胞死亡[10]。在病原菌侵染下,植物可以通过合成植保素等次级代谢产物来增强自身防御。本研究中,Mo17和‘郑58’受到病原菌侵染6h就能快速激活植保素和茉莉酸代谢关键基因,积极参与防御响应,抵御小斑病的侵染。相反,‘吉419’在接种小斑病病原菌后,TPS6、TPS11、An2基因都是在24h才显著上调,相对于抗病自交系反应迟缓,表现为对小斑病的易感性状。
Mo17的TPS6、TPS11基因诱导表达不显著,推测Zealexin 积累对于小斑菌侵染影响较小,但AOC 基因诱导表达显著,表明茉莉酸防御机制较快速启动,能促进包括植保素合成基因在内的抗性基因的诱导表达,快速提高植物的防御能力。‘郑58’在病原菌侵染过程中,TPS6、TPS11 和An2 基因分别在24和48h达到最大。而在6h 时,TPS6、TPS11基因基本不表达,主要是诱导茉莉酸参与外来病原菌的防御响应。对于具有较高抗性的Mo17和‘郑58’,茉莉酸基因诱导表达早于两类植保素代谢关键基因,可能促进其他防御机制的启动[11]。而感病自交系‘吉419’在接种12h后才积极诱导体内抗病相关基因表达以参与抵抗病原菌侵染,并且在24h茉莉酸和Kauralexin代谢关键基因表达量达到最高,两者相互作用参与防御应答,在侵染48h后Zealexin代谢关键基因表达量最高,表明随着病原菌的侵染,茉莉酸和两类植保素之间积极地协同抵御小斑病的侵染。
植物抗病防御响应涉及一个庞大而复杂的系统,植物在与病原菌长期相互作用和共同进化过程中,通过各种代谢途径在体内形成多种多样的抵抗病原菌侵染的代谢物[12]。本研究通过分析不同玉米抗性自交系中两类植保素和茉莉酸代谢关键基因对玉米小斑病的防御应答,解析了不同品种间抗性的差异,为进一步探究植保素和激素在玉米重要病害防御响应中的关系提供依据,也为萜类植保素在抗性育种中的应用提供了理论依据。
[1] ZHONG CH M(钟承茂).The occurrence and integrated control technology of southern leaf blight[J].Agricultural Extension Service(农技服务),2008,25(2):83-84(in Chinase).
[2] 赖传雅.农业植物病理学[M].北京:科学出版社,2003:72.
[3] ZENG X(曾 兴),LI Y(李 芸),LIN H J(林海建),et al.Differences in different resistant maize inbred lines after inoculation with Rhizoctonia solani expression[J].Journal of Agricultural Biotechnology(农业生物技术学报),2011,19(2):250-257(in Chinase).
[4] ALISA H,FATMA K,MARTHA M,et al.Novel acidic sesquiterpenoids constitute a dominant class of pathogen-induced phytoalexins in maize[J].Plant Physiology,2011,156(4):2 082-2 097.
[5] ERIC A S,FATMA K,ALISA H,et al.Identity,regulation and activity of inducible diterpenoid phytoalexins in maize[J].PNAS,2011,108(13):5 455-5 460.
[6] KOLLNER T G,SCHNEE C,LI S,et al.Protonation of a neutral(S)-beta-bisabolene intermediate is involved in(S)-beta-macrocarpene formation by the maize sesquiterpene synthases TPS6and TPS11[J].The Journal of Biological Chemistry,2008,283(30):20 779-20 788.
[7] HARRIS L J,SAPARNO A,JOHNSTON A,et al.The maize An2gene is induced by Fusariumattack and encodes an ent-copalyl diphosphate synthase[J].Plant Molecular Biology,2005,59(6):881-894.
[8] AHUJA I,KISSEN R,BONES A M.Phytoalexins in defense against pathogens[J].Trends in Plant Science,2012,17(2):73-90.
[9] 王晓鸣,王会伟.玉米大斑病小斑病及其防治[M].北京:金盾出版社,2009:119-120.
[10] 韩志群.硫酸锌、赛众28及菌根健对玉米抗性相关酶和基因表达水平影响[D].河北保定:河北农业大学,2012.[11] RABBANI M A,MARUYAMA K,ABE H,et al.Monitoring expression profiles of rice genes under cold,drought and high-salinity stresses and abscisic acid application using cDNA microarray and RNA gel-Blot analyses[J].Plant Physiology,2003,133(4):1 755-1 767.
[12] XIA Q ZH(夏启中),ZHANG M J(张明菊),et al.Basic metabolism of plant disease resistance[J].Journal of Huanggang Polytechnic(黄冈职业技术学院学报),2004,6(3):38-41(in Chinase).
