EGTA 对Cd胁迫下蓖麻Cd积累和营养元素吸收的影响
2015-07-05王明新孙向武刘建国
李 君,葛 跃,王明新,孙向武,刘建国
(常州大学 环境与安全工程学院,江苏常州213164)
随着工业化、城市化和经济的快速增长,中国土壤Cd等重金属污染也日趋严重[1-2]。据环保部调查,目前受污染的耕地约有0.1亿hm2,耕地质量堪忧,主要是重金属和有机物污染。Cd是生物毒性极强的一种重金属,土壤中过量的Cd被植物吸收后积累在体内,会对植物产生一系列毒害作用,还会通过食物链传递进入人体,直接威胁人类健康。因此,在减少或禁止污染排放的同时,Cd污染土壤的生物、非生物修复已经成为生态学研究热点问题。
蓖麻作为世界十大油料作物之一,其生物量大,适应性广,是理想的油料作物和环保植物。蓖麻虽然生物量大,但也存在地上部重金属积累量较低的问题,这限制了其对土壤重金属的修复能力。因此,提高地上部重金属含量是提高蓖麻对重金属积累量的关键问题。有研究表明,向土壤中施加螯合剂(如EDTA、EGTA、DTPA、柠檬酸等)能够活化土壤中的重金属,提高重金属的生物有效性,促进植物吸收[3]。其 中,螯 合 剂EGTA 对Cd 选 择 性 高、Cd-EGTA 络合物稳定,可优先用于活化土壤中的Cd[4]。但过量施用往往对植物生长造成严重的负面作用,从而会影响修复植物的经济价值[5]。Cd能损伤植物细胞质膜的透性,影响营养元素的吸收和转运,导致植株中元素含量的改变。有研究表明,随着Cd浓度的增加,花生籽粒中P元素不断下降,而K、Mg、Ca、Fe、Zn 元素呈现先升后降的趋势[6]。Cd促进龙葵叶片吸收Ca、叶片和根系吸收K,也促进根系吸收Mg,但抑制其向地上部转运;龙葵根、茎、叶Zn含量随Cd处理浓度的提高均表现为低促高抑;随Cd浓度提高,其根系Cu吸收增加,叶片Cu吸收先增后降;各器官Fe含量随Cd浓度提高逐渐降低,而根系Mn含量受Cd抑制[7]。可见,Cd胁迫对植株吸收和转运不同营养元素有着不同的影响,但外源EGTA 强化Cd萃取修复条件下植株对矿质元素的吸收还鲜有报道。
因此,本研究选择‘淄蓖麻5号’品种为供试材料,通过盆栽实验分析了Cd胁迫下EGTA 对蓖麻生长情况、Cd吸收积累以及植株各部分器官中K、Ca、Mg、Fe、Mn、Cu、Zn 等营养元素含量的影响,旨在揭示外源EGTA 对Cd胁迫条件下蓖麻生长、Cd积累与转运以及矿质营养元素吸收的效应,为通过外源螯合剂调控Cd污染土壤上植物修复效应提供科学依据。
1 材料和方法
1.1 实验材料
供试土壤采自江苏省常州科教城周边菜地,将采集的表层0~20cm 土壤样品经风干后过2 mm筛,混匀后备用。土样速效氮、速效磷和速效钾含量分别为35.51、54.73和121.32mg·kg-1,土壤有机质含量为26.37g·kg-1,pH 为6.8,土壤全Cd含量为0.37 mg·kg-1。重金属Cd 以分析纯CdCl2·2.5H2O 溶液形式喷施入土壤,充分混匀,将经过Cd处理的过筛风干土装入塑料盆内(直径20cm,高15cm),每盆装人工污染土2.5kg,静置平衡4个月,模拟Cd重度污染土壤(Cd含量为100 mg·kg-1)。
供试蓖麻品种为“淄蓖麻5号”,种子由山东淄博农业科学研究院提供。选择饱满种子经日晒后直接播种于潮湿的石英砂中,置于全封闭光照培养箱中进行育苗,光周期为12h∶12h(光∶暗),昼/夜温度为25 ℃/18 ℃,培养1周后挑选大小一致、长势良好的蓖麻幼苗移栽入盆,每盆“品”字型栽植3株,10d后进行间苗,每盆留下1株长势最好的蓖麻定株。培养期间土壤湿度保持在60%田间持水量。
1.2 实验设计
盆栽试验在常州大学温室大棚内进行。移栽前1d每盆施入氮素(尿素)200mg·kg-1、磷素(磷酸二氢钙)40mg·kg-1、钾素(氯化钾)160mg·kg-1作为基肥,充分混匀。根据天气情况和土壤持水量情况,移栽后浇适量去离子水,每2d浇1次水,使土壤湿度保持在60%田间持水量左右;塑料花盆编号并随机排列,置于温室大棚内(上覆阳光板)。试验土壤Cd 含量为100 mg·kg-1,试验共设对照(CK)、E0、E1、E2、E35个处理,每个处理6次重复。其中,CK 为不施入任何外源添加剂,土壤Cd含量为0.37mg·kg-1;E0~E3的土壤Cd含量为100 mg·kg-1,再分别加入0、0.5、1.0 和2 mmol·kg-1外源EGTA。以移栽日为盆栽第0 天开始计时,盆栽第30天时以溶液滴灌形式加入不同浓度的EGTA 处理试剂,处理20d后即盆栽第50天时收获植株。
1.3 样品处理与分析
用自来水将植株冲洗干净后用20mmol·L-1Na2-EDTA 浸 泡20 min,去 除 根 系 表 面 吸 附 的Cd[8],再用自来水冲洗3~4次,最后用去离子水润洗,吸干表面水分,分成根、茎、叶3部分,用电子天平称取植株各部分鲜重后,于105 ℃下杀青0.5h,75 ℃烘干至恒重,用电子天平称取各部分干质量。测定Cd含量时,取450mg植株叶片的粉碎烘干样品(植株茎部和根系各取150mg和100mg粉碎烘干样品,其余同叶片操作)加入65%HNO38mL 和30%H2O21mL,采用微波消解仪(上海新仪MDS-8G)进行消解,消解液中的Fe、Mn、Cu、Zn、K、Ca、Mg及Cd含量采用火焰原子吸收分光光度计(德国耶拿novAA300)测定并换算成植物各组织干重单位重量的Cd含量。进而计算出植株Cd积累量。
1.4 数据分析
实验数据采用SPSS19统计软件进行方差分析和LSD 差异显著性检验,采用Microsoft Excel 2010制表。
2 结果与分析
2.1 外源EGTA对镉胁迫条件下蓖麻生长的影响
由表1可以看出,Cd胁迫条件下蓖麻根、茎、叶生物量(干重和鲜重)与CK 相比均显著降低。与E0相比,加入不同浓度的EGTA 后,蓖麻植株叶片和茎部鲜重及叶片和单株干重没有显著变化;根系鲜重和茎干重仅在EGTA 投加量达到2 mmol·kg-1时比E0处理分别显著降低37.75%和31.82%(P<0.05),其余添加量处理也无显著变化;单株鲜重和根系干重在加入不同量EGTA 后均较E0处理显著下降(P<0.05),但不同浓度EGTA 处理间差异不显著。以上结果说明Cd胁迫抑制了蓖麻植株的生长,外源添加适宜浓度的EGTA 对Cd胁迫下蓖麻植株生长受到的抑制有显著的缓解作用。
2.2 外源EGTA 对Cd胁迫条件下蓖麻植株Cd含量及积累量的影响
由表2可见,在E0处理中,蓖麻根系和茎部Cd含量、Cd积累量及植株总Cd积累量均比CK 显著上升,而叶片Cd含量及Cd积累量虽呈上升趋势,但与CK 的差异未达到显著水平,表明蓖麻对Cd的积累主要集中在根系,地上部对Cd的富集能力较弱。在Cd胁迫条件下,EGTA 的加入明显增加了植株各器官对Cd的富集,并有随EGTA 添加量增加而上升的趋势(表2)。其中,蓖麻茎部Cd含量在E1、E2、E3处理下分别是E0的1.51、2.16 和2.62倍,叶 片Cd 含 量 分 别 是E0的20.26、33.22 和41.34倍;根系Cd含量在E3处理条件下达到最大值(463.88 mg·kg),分 别 是E0、E1和E2的1.57、1.69和1.33倍;在Cd胁迫条件下,蓖麻各组织中Cd含量分布特征表现为根>茎>叶。同时,随着投加EGTA 浓度的增加,E1、E2和E3处理蓖麻叶片中Cd积累量也逐渐显著大幅度增加(P<0.05),分别是E0处理的15.0、25.3和46.6倍,分别占相应植株总积累量的36.89%、48.25%和58.63%;茎中Cd积累量在E1处理下比E0处理稍低,其在E2和E3处理下虽比E0处理显著提高,但其增幅远低于叶片;而根系Cd 积累量在加入EGTA 后与E0相比则显著降低(P<0.05),但其占植株总积累量比例仍明显高于茎部。可见,外源EGTA 处理改变了Cd在蓖麻根、茎、叶中的积累分布情况,提高了Cd从根系向地上部,尤其是向叶片的转移能力,从而强化了蓖麻对Cd污染土壤的修复效率。
2.3 外源EGTA 对Cd胁迫条件下蓖麻各器官营养元素含量的影响
Cd胁迫下,外源EGTA 对蓖麻植株营养元素的吸收有着显著影响(表3)。与CK 相比,Cd胁迫显著降低了根系Fe、Mn、Cu、Zn、Mg 含量(P<0.05),同时也明显抑制了植株对K 的吸收,但促进了蓖麻根系对Ca 的吸收。E3处理下,根系Fe、Mn、Cu含量分别是E0的1.33、4.23 和6.86 倍(P<0.05);EGTA 处理使根系Zn含量呈先升后降的趋势,根系K 吸收无明显变化,植株Ca吸收表现为低促高抑;根系Mg 含量在E3处显著增加,较E0、E1和E2分 别 增 加 了28.66%、62.50% 和36.37%(P<0.05)。
同时,与CK 相比,Cd胁迫对蓖麻茎部Fe、Mn含量无显著影响,而使茎部Cu、Zn含量均显著降低(P<0.05);Cd 胁迫抑制茎部对Ca的吸收,茎部Mg含量显著增加(P<0.05)。添加EGTA 对蓖麻茎部Fe吸收无显著影响;而茎部Mn和Cu含量均在E3处理下达到最大,E3处理茎部Mn含量是E0的4.22倍,而E0和E1处理茎部Cu含量未检测出;茎部Zn含量呈先升后降的趋势;EGTA 使蓖麻地上部K含量呈上升趋势,E3处理茎部K 含量较E0增加了38%;茎部Mg含量在E2处达到峰值,之后又下降,E3茎部Mg吸收已经下降到与E0相近水平。

表2 不同处理下蓖麻各组织Cd含量及Cd积累量的变化Table 2 The cadmium content and cadmium accumulation in the tissues of R.communis under different treatments
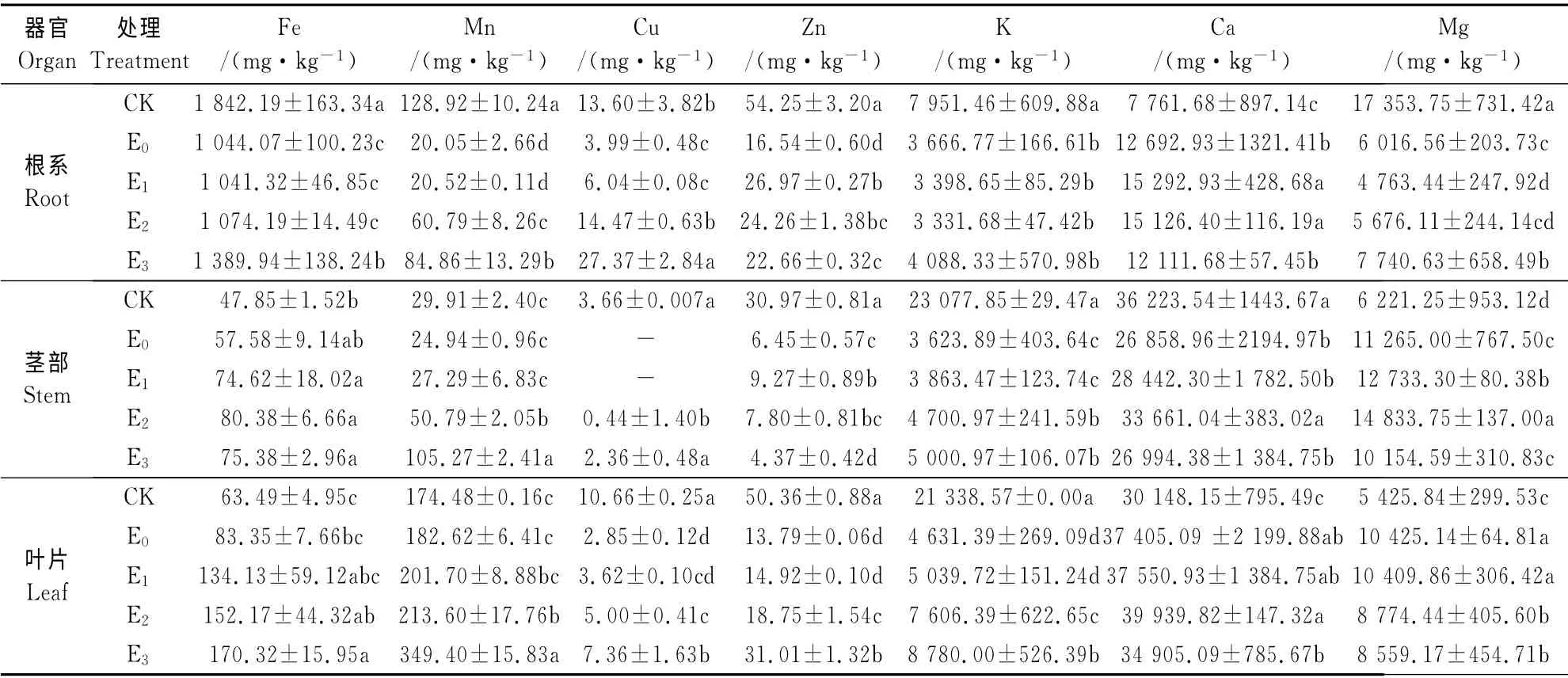
表3 不同处理下蓖麻各组织营养元素含量的变化Table 3 The concentrations of nutrient elements in the tissues of R.communis under different treatments
另外,与CK 相比,Cd 胁迫增加了蓖麻叶片Fe、Mn吸收量,但均未达到显著差异水平;但使叶片Cu、Zn含量均显著降低(P<0.05);Cd胁迫增加了蓖麻叶片Ca和Mg含量。E3处理蓖麻叶片Fe、Mn、Cu、Zn含量分别是E0的2.04、1.91、2.58 和2.25倍,其K 含量较E0显著增加了89.58%,但叶片Mg含量较E0显著下降了17.90%(P<0.05)。
总之,Cd胁迫明显抑制了蓖麻植株对Cu和Zn的吸收,使根系Fe、Mn含量显著降低,而其地上部Fe、Mn含量无显著变化,说明Cd胁迫不影响Fe和Mn向地上部的转移;同时,Cd胁迫明显抑制了植株对K 的吸收,也抑制了根系对Mg的吸收,促进其向地上部转运,增加了蓖麻根系和叶片Ca含量。Cd胁迫条件下,EGTA 使根系Fe、Mn、Cu、Mg含量均在E3处理下达到最大,同时使根系Zn含量先升后降,而根系K 吸收无明显变化;植株Ca吸收表现为低促高抑;叶片Fe、Mn、Cu、Zn、K 含量均在E3处达到最大,其Mg含量在E3处明显下降。由此可见,在Cd污染的土壤介质中添加EGTA 对蓖麻矿质元素含量的影响随着不同元素、不同植株部位及EGTA 在介质中的浓度不同而有所差异。
3 讨 论
螯合剂通常会显著增加植株对重金属的吸收,因此广泛用于重金属污染土壤植物修复的外源调控[9]。本研究表明,投加不同浓度的EGTA 均提高了蓖麻植株的Cd 积累总量,且对于不同浓度的EGTA 处理,蓖麻叶片Cd积累量显著高于不添加处理(E0),其中的高EGTA 处理(E3)使蓖麻叶片Cd积累量比E0增加了41.34倍,这与雒焕章等[5]对EGTA 强化杨树富集土壤Cd的研究结果一致。这可能是由于EGTA 对于Cd的高活化能力增大了蓖麻根部EGAT-Cd络合物的浓度,致使Cd通过植物蒸腾作用向地上部的迁移量也随之增多。
Cd影响植物对矿质元素的吸收和运输,导致营养元素不足或营养元素间失去平衡,扰乱了植物正常的生理代谢,从而影响植物生长[7]。首先,Fe是一种需量较多的植物必需微量营养元素,在植物的许多生理生化过程中都起作用。本研究中,蓖麻叶片和根系Fe含量在高EGTA(E3)条件下显著增加,茎部Fe含量基本不受影响。刘建国等的研究结果也表明,水稻根系和叶片Fe含量在Cd胁迫下均与Cd含量存在正相关关系[10]。根系Fe含量的增加很可能是因为根表面有铁氧化物胶膜的形成,铁胶膜可以作为Fe的储存库,增加细胞对Fe的吸收,从而增强了植物对重金属的耐性,进而促进Fe以及其它化学结构类似的重金属吸收的增加,这也是其它微量营养元素根系含量增加的原因之一[11]。
其次,随着EGTA 浓度的提高,本研究中蓖麻植株Mn吸收量显著增加,同时Mg含量则表现为根系中先降后升,叶片中先升后降,这可能是由于EGTA 处理同时提高了土壤中有效态Cd和Mg的含量,有助于促进植株根系对它们的吸收,但也可能是植株根系对两者的吸收存在竞争关系,使得EGTA 低浓度时以抑制为主,高浓度时又逐渐恢复了对Mg的吸收。有研究表明,Mg含量增加能够防止Cd阻碍叶绿体合成叶绿素,并且能够减缓Cd毒害作用[12]。因此,Mg吸收量的增加可能是蓖麻防御Cd毒害的重要生理机制之一。
再次,本实验中EGTA 也促进了蓖麻地上部对K 的吸收,对根部K 的吸收无显著影响,表明EGTA 处理显著提高了土壤中Cd的有效性,显著提高蓖麻对Cd的吸收,进而产生逆境胁迫。蓖麻遇到逆境胁迫后,通过增加体内的K 含量来抵御逆境[13]。Ca是植物细胞壁胶层的组成成分,主要以果胶酸钙形式存在,可增强细胞壁的强度,并能调节细胞的充水度、粘性、弹性及渗透性等使其维持在正常的生理状态。此外,Ca也参与植物蛋白质的合成、酶的代谢等过程,对植物生长发育具有重要的意义。蓖麻植株Ca含量在高EGTA 处理条件下显著降低,这可能是因为高浓度EGTA 处理使Cd胁迫程度加剧,引起蓖麻植株的膜脂过氧化,从而导致细胞质膜的透性增加,导致小分子物质外流[14]。
另外,微量元素Cu和Zn营养与植物蒸腾作用有关,同时Cu、Zn浓度也会影响植物的枯萎过程。Zn还参与植物生长素的形成,促进光合作用和蛋白质合成,因此它是植物生长发育过程中必需的微量元素之一[15]。Cu是植物所必须的微量元素,是多种酶的组成成分,参与碳素同化、氮素代谢以及多条生理代谢途径,对植物的生长发育具有重要影响[16]。本研究中,蓖麻叶片Zn含量随EGTA 浓度的增加呈现上升趋势,而茎部和根系Zn 含量随EGTA 浓度的提高呈现先升后降的趋势。说明EGTA 处理有助于提高植株根系对Zn的吸收,但高浓度处理可能由于伤害了植株的正常生长而又降低了根系对Zn的吸收能力;EGTA 处理也显著提高了Zn从根系到叶片的迁移能力,因而提高了地上部对Zn的积累量。同时,随着EGTA 浓度的提高,也促进了蓖麻植株对Cu的吸收。
综上所述,EGTA 可以提高蓖麻植株体内重金属的含量,对植株不同营养元素的吸收则有着不同的影响。外源EGTA 能促进蓖麻地上部对K 的吸收,对根部K 的吸收无显著影响(P>0.05),同时抑制Mg向植株地上部转运。随外源EGTA 浓度的提高,蓖麻植株对Ca吸收表现为低促高抑,其叶片Zn含量和植株Cu含量增加,其叶片和根系Fe含量及植株各器官Mn含量也显著增加(P<0.05)。这可为外源EGTA 强化蓖麻修复Cd污染土壤的营养调控提供参考。EGTA 对Cd胁迫下植物营养元素吸收呈抑制或促进作用可能受植物的种类、品种、EGTA 投加浓度及元素种类有关[17],也可能与非必需重金属离子与不同微量营养元素之间的相互作用关系有关,这些都有待于进一步的深入研究。
[1] YU L L(于玲玲),ZHU J Y(朱俊艳),HUANG Q Q(黄青青),et al.Bioavailability of cadmium in the rotation system of oilseed rape and rice grown in Cd-contaminated soil[J].Environmental Science and Technology(环境科学与技术),2014,37(1):1-6(in Chinese).
[2] QIU Q,WANG Y T,YANG Z Y,et al.Responses of different chinese flowering cabbage(Brassica parachinensis L.)cultivars to cadmium and lead exposure:screening for Cd+Pb pollution-safe cultivars[J].CLEAN-Soil Air Water,2011,39(11):925-932.
[3] CHEN Y H(陈亚慧),LI J(李 君),WANG M X(王明新),et al.Regulation of EGTA and tartaric acid on Cd stress and accumulation in Ricinus communis L.[J].Acta Botanica Boreali-Occidentalia Sinica(西北植物学报),2014,34(5):1025-1031(in Chinese).
[4] HU Y H(胡亚虎),WEI SH H(魏树和),ZHOU Q X(周启星),et al.Application of chelator in phytoremediation of heavy metals contaminated soils:A review[J].Journal of Agro-Environment Science(农业环境科学学报),2010,29(11):2055-2063(in Chinese).
[5] LUO H ZH(雒焕章),NAN ZH R(南忠 仁),HU Y H(胡亚虎),et al.Chelate-induced uptake and accumulation of Cd in soil by poplar(Populus bolleana Lauche)[J].China Environmental Science(中国环境科学),2013,33(3):461-465(in Chinese).
[6] WANG L X(王丽香),CHEN H(陈 虎),GUO F(郭 峰),et al.Effects of cadmium on peanut growth and mineral nutrient uptake[J].Journal of Agro-Environment Science(农业环境科学学报),2013,32(6):1 106-1 110(in Chinese).
[7] GUO ZH(郭 智),YUAN H Y(原海燕),AO Y S(奥岩松).Effect of cadmium on photosynthesis and nutrient elements uptake of Solanum nigrum L.seedlings[J].Ecology and Environmental Sciences(生态环境学报),2009,18(3):824-829(in Chinese).
[8] DU R J,HE E K,TANG Y T,et al.How phytohormone IAA and chelator EDTA affect lead uptake by Zn/Cd hyperaccumulator Picres divaricata[J].International Journal of Phytoremediation,2011,13(10):1 024-1 036.
[9] ZHENG M X(郑明霞),FENG L(冯 流),LIU J(刘 洁),et al.Effects of chelators on species and bioavailability of cadmium in soil[J].Environmental Chemistry(环境化学),2007,26(5):606-609(in Chinese).
[10] LIU J G,LI K Q,XU J K,et al.Interaction of Cd and five mineral nutrients for uptake and accumulation in different rice culticasrs and genotypes[J].Field Crops Research,2003,83(3):271-281.
[11] ALI N A,BERNAL M P,ATER M.Tolerance and bioaccumulation by Phragmites australis grown in the presence of elevated concentrations of cadmium,copper,and zine[J].Aquatic Botany,2004,80(3):163-176.
[12] KÜPPER H,KOCHIAN L V.Transcriptional regulation of metal transport genes and mineral nutrition during acclimatization to cadmium and zinc in the Cd/Zn hyperaccumulator,Thlaspi caerulescens(Ganges population)[J].New Phytologist,2010,185(1):114-129.
[13] DENG L J(邓禄军),XIA J H(夏锦慧),ZHANG Y L(张亚莉),et al.Effeets of cadmium pollution in soil on nitrogen,phosphorus,potassium and cadmium elements content and accumulation of potato[J].Journal of Anhui Agricultural science(安 徽 农 业 科 学),2013,41(14):6 238-6 240(in Chinese).
[14] LI S(李 隼),HUANG SH D(黄胜东),ZHAO F G(赵福庚).Effects of cadmium on K+uptake in root hair cells of rice[J].Plant Physiology Journal(植物生理学报),2011,47(5):481-487.
[15] WU F(吴 峰),XIONG J F(熊俊芬).Interaction between arsenic and phosphorus,potassium,calcium and other nutrient elements in Pteris vittata L.[J].Modern Agricultural Sciences and Technology(现代农业科技),2010,(8):278-280(in Chinese).
[16] LI H Y(李虹颖),SU Y H(苏彦华).Effect of cadmium on tolerance physiology and nutrient accumulation in Amaranthus hypochondriacus L.[J].Ecology and Environmental Sciences(生态环境学报),2012,21(2):308-313(in Chinese).
[17] ZHAO X L(赵秀兰),LIU X(刘 晓).Differences in plant growth,Cd and nutrient uptake,Cd translocation between two tobacco cultivars under Cd stress[J].Journal of Soil and Water Conservation(水土保持学报),2009,23(1):117-122(in Chinese).
