干旱胁迫下辣椒幼苗光合与荧光参数测定的最佳叶片
2022-07-28张泽宇曹红霞裴书瑶李曼宁
张泽宇,曹红霞,裴书瑶,李曼宁
(西北农林科技大学水利与建筑工程学院旱区农业水土工程教育部重点实验室,陕西 杨凌 712100)
光合作用是作物生长最基本的生理过程之一,作物有机物的积累都是通过直接或间接地改善作物的光合生理性能来实现[1]。植物叶片是植物进行光合作用的重要器官,叶片中的光合色素是叶片光合作用的物质基础,叶绿素含量的高低在很大程度上反映了植株的生长状况和叶片的光合能力,并与叶片光合强度密切相关[2]。为了维持叶绿素分子吸收光能的平衡,除了光合作用消耗的能量外,光合器官将其余光能以荧光和热的形式散失。其中叶绿素荧光能快速灵敏地反映植物光系统的运转状况[3-4]。随着植物光合作用研究的深入,越来越多的植物学科如农学、林学、植物生理学、植物生态学、园艺学和遗传学的研究均涉及到叶片光合、荧光作用的测定[5]。目前用于测定光合、荧光参数的仪器一般是针对于植物叶片的,因此在对叶片的选择上,应该尽量选择有代表性的叶片,这对于光合、荧光参数测定代表性起着决定性的作用。在以往的研究中,学者们普遍选择功能叶来测量叶绿素含量、气体交换参数及叶绿素荧光等参数,以对植株的光合潜力进行评价。比如,通常选择小麦完全展开的旗叶[6]、棉花的第三片或第四片叶[7]和完全展开的番茄幼叶[8]来量化光合作用。总的来说,所选择的叶片都是充分展开并维持较高光合速率,能为植株提供有机养料的叶片[9-10]。但是这些研究并没有考虑不同环境条件下功能叶片的变化。有研究得出,在胁迫条件下,如干旱胁迫,叶片会经历一系列的变化。水分缺乏可能通过削弱抗氧化系统中CAT、POD和SOD的活性而加速叶片衰老。衰老叶片下调Rubisco活性/表达,导致叶绿素降解,影响光合作用[11]。此外,由于叶片在不同位置的生长发育阶段不同,不同叶片对能量的需求也不同。根据植物生长发育规律,成熟早的叶后期光合能力会下降;而刚展开的叶,以输入有机物为主,只有那些刚达到最大面积的叶才是光合产物的主要贡献者。然而,这些叶片的光合作用对干旱胁迫的响应可能存在显著差异[12]。因此,在干旱条件下哪个叶位最适宜进行光合、荧光参数测量还有待深入研究。
辣椒(Capsicumgenus)属于茄科辣椒属,是一年或多年生草本植物,因其营养丰富、味道鲜美而大量应用于食品、中药行业,并在世界各地广泛栽培[13]。从形态结构上来看,辣椒属于浅根系植物,根细而弱,木栓化程度高,因此极易受干旱影响[14-15]。在以往的研究中,有学者选择辣椒完全展开的第1片、第3片或第4片功能叶来测量光合、荧光参数[16-18]。但是在干旱胁迫下,哪个叶位对水分胁迫最敏感,最适宜测定光合、荧光参数还有待深入研究。
因此,本研究通过分析辣椒幼苗1~6叶位在不同干旱胁迫程度下叶绿素含量、气体交换参数、叶绿素荧光参数及叶面积的变化,探索干旱条件下不同叶位的适应性机制,选择出对水分胁迫最敏感的一个功能叶作为干旱条件下最适宜测定光合、荧光参数的典型叶片,以期为干旱条件下光合作用的快速评价提供参考。
1 材料与方法
1.1 试验材料与试验地概况
试验于2020年5—7月在西北农林科技大学旱区农业水土工程教育部重点实验室日光温室内进行(34°17′N、108°01′E,海拔521 m)。该区属暖温带季风半湿润气候,多年平均降水量632 mm,主要集中在6—10月,年均蒸发量1 500 mm。多年平均气温12.5℃,年均日照时数2 163.8 h,无霜期210 d。供试材料为辣椒,品种为“世纪红”。试验土壤为重壤土,取自西北农林科技大学附近0~20 cm 表土层,土壤容重1.4 g·cm-3,田间持水量33.6%(体积含水率)。
采用育苗移栽的方式种植,待4叶1心时定植(2020年5月29日),在定植前施基肥:每盆施0.071 g尿素(N:46.4%)、0.314 g磷酸二铵(P2O5:42%,N:15%)、0.404 g硫酸钾(K2O:54%)。定植后浇一次缓苗水,隔两周后(6叶期)开始水分胁迫处理,每天18∶00 采用称重法补水,使土壤含水率维持在设定范围内。试验设有3个水分处理,即土壤相对含水率分别为土壤田间持水率的75%~85%(对照组CK)、65%~75%(轻度胁迫MS)和55%~65%(重度胁迫SS)。在土壤相对含水量达到各处理相应胁迫程度的第10、13、16天(8叶期)对辣椒幼苗从上到下完全展开的1~6叶位进行指标测定及取样,每处理重复3次。采用盆栽方法,盆大小为:上口直径×下底直径×高为14.7 cm×9.1 cm×11.4 cm,每盆装土1 kg。试验过程中,每盆种植1株辣椒,每个处理10株,共种植30株。
1.2 测定指标与方法
(1)气体交换参数。在各处理每一重复的3盆中随机取1盆,共取3盆,从顶端向下选取完全展开的1~6片叶,采用Li-6800便携式光合仪在晴天9∶00—11∶00测定净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)及蒸腾速率(Tr)。
(2)叶面积及叶绿素荧光参数。应用PlantScreen植物表型成像系统FluorCam 700 MF (Photon Systems Instruments, Czech Republic)对各叶位叶片的叶面积及荧光参数进行测量。暗处理30 min后放入表型成像系统中,测定暗适应后的最小荧光(F0)、叶片的PSⅡ最大光化学效率(Fv/Fm)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)等叶绿素荧光参数。
(3)叶绿素及类胡萝卜素含量。应用80%丙酮提取各叶位叶绿素及类胡萝卜素,再用分光光度计测量各色素的吸光度,通过Beer-Lambert公式计算其浓度:
Chla=12.21×A663-2.81×A646
Chlb=20.13×A646-5.03×A663
Car=(1000×A470-3.27×Chla-104×Chlb)/229
TChl=Chla+Chlb
再按以下公式计算各色素含量:

式中,C为叶绿体色素的浓度(mg·L-1),FW为鲜重(g),VT为提取液总体积(mL),n为稀释倍数。
将水分胁迫后第10、13、16天3 d测量结果取平均值作为实际测量结果,采用Microsoft Excel 2019对试验数据进行处理;使用SPSSv.21.0统计软件进行双因素方差分析,使用Tukey检验在P<0.05及P<0.01的显著性水平上进行多重比较,并应用OriginPro 2021作图。
2 结果与分析
2.1 水分胁迫对辣椒幼苗不同叶位气体交换参数的影响
水分胁迫对辣椒幼苗不同叶位气体交换参数的影响见图1。由表1可知,水分处理(W)、叶位(L)及水分与叶位的交互作用(L×W)对Pn、Gs、Ci和Tr的影响均达到了极显著水平(P<0.01)。由图1A、1B、1D可知,在相同水分处理下,随着叶位的增加(1~6叶位),Pn、Gs和Tr先升高后降低。其中,充分供水时,Pn、Gs和Tr均在第3叶位达到最大值,分别为5.81、0.08、4.42 mmol·m-2·s-1,并与其他叶位呈显著差异(P<0.05);而在水分胁迫时(MS、SS),Pn、Gs和Tr均在第4叶位达到最大值。对于同一叶位,随着水分胁迫程度的增加,1~3叶位的Pn、Gs和Tr逐渐下降,4~6叶位的各参数值先升高后降低,在MS处理下取得最大值。

表1 水分处理、叶位及其交互作用对气体交换参数影响的显著性分析Table 1 Significance analysis of water treatment, leaf position and their interactions on gas exchange parameters
Ci的变化趋势与Pn、Gs和Tr相反。由图1C可知,在相同水分处理下,随叶位的增加,Ci先降低后升高。其中,在充分供水时,第3叶位的Ci值最小,为235.94 μmol·mol-1,而在水分胁迫时(MS、SS),第4叶位的Ci值最小,分别为242.58 μmol·mol-1和256.45 μmol·mol-1。对于同一叶位,随着水分胁迫程度的增加,1~3叶位的Ci值逐渐增大,4~6叶位的Ci值先降低后升高,MS处理Ci值下降程度最大。
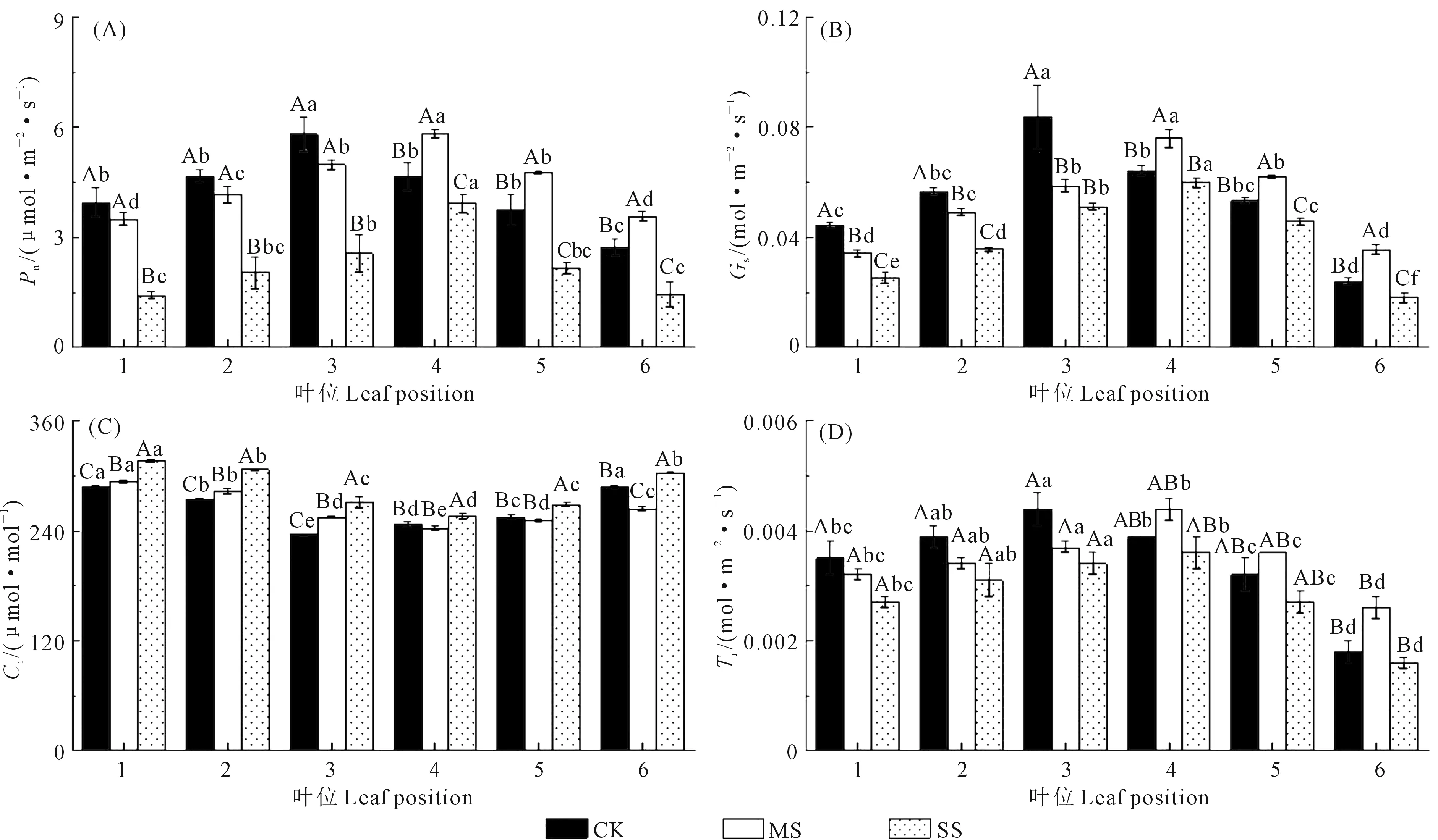
注:不同大写字母表示水分处理间差异显著(P<0.05);不同小写字母表示叶位间差异显著(P<0.05)。下同。Note: Different capital letters indicated significant difference between water treatments (P<0.05); Different lowercase letters indicate significant difference between leaf positions (P<0.05). The same below.图1 不同处理下辣椒幼苗不同叶位气体交换参数Fig.1 Gas exchange parameters of pepper seedling at different leaf positions under different treatment
2.2 水分胁迫对辣椒幼苗不同叶位叶面积的影响
水分胁迫对辣椒幼苗不同叶位叶面积的影响见图2。水分处理、叶位及水分与叶位的交互作用均对叶面积产生了极显著的影响(P<0.01)。由图2可知,不同叶位叶面积的变化趋势和Pn相似,在相同水分处理下,随着叶位的增加,叶面积先增大后减小;而同一叶位,随着水分胁迫程度的增大,1~3叶位的叶面积逐渐减小,4~6叶位的叶面积先升高后降低。其中,在充分供水时,第3叶位的叶面积最大,为2 800.67 mm2,受干旱胁迫时(MS和SS),第4叶位的叶面积最大,分别达到了2 919.31 mm2和2 051.26 mm2。

图2 不同处理下辣椒幼苗不同叶位叶面积Fig.2 Leaf area of pepper seedling at different leaf positions under different treatments
2.3 水分胁迫对辣椒幼苗不同叶位叶绿素荧光参数的影响
辣椒幼苗不同叶位叶绿素荧光参数受水分处理、叶位及水分与叶位的交互作用影响极显著(P<0.01)(表2)。由图3A、3D可知,同一水分处理下,随叶位增加,F0与NPQ均为先降低后升高的趋势,其中,在充分供水时,第3叶位的F0与NPQ值最小,分别为264.75和0.68;而在水分胁迫时(MS和SS),第4叶位的F0与NPQ值最小。对于同一叶位,随着水分胁迫程度的增加,F0逐渐增加,而NPQ在1~3叶位逐渐增加,4~6叶位却先降低后增加,在MS处理时的值最小。

表2 水分处理、叶位及其交互作用对叶绿素荧光参数影响的显著性分析Table 2 Significance analysis of water treatment, leaf position and their interactions onchlorophyll fluorescence
Fv/Fm、qP的变化趋势与F0、NPQ相反。由图3B、3C可知,在相同水分处理下,随叶位增加,Fv/Fm与qP先增加后降低,在第3叶位达到最大值;对于同一叶位,随水分胁迫程度的增加,1~3叶位的qP逐渐下降,4~6叶位的qP先升高后降低,其中,MS处理4~6叶位的qP较CK分别增加12.53%、11.27%及14.30%。干旱胁迫显著降低了各叶位的Fv/Fm,且随着胁迫程度的增加,Fv/Fm逐渐下降。在MS与SS处理,第4叶位的Fv/Fm值最大,分别为0.78和0.70。

图3 不同处理下辣椒幼苗不同叶位叶绿素荧光参数Fig.3 Chlorophyll fluorescence of pepper seedling at different leaf positions under different treatments
2.4 水分胁迫对辣椒幼苗不同叶位光合色素的影响
由表3可知,在相同水分处理下,Chla、Chlb、Car及TChl含量随叶位的增加先升高后降低,其中,在充分供水条件下,第3叶位的色素含量最多,在水分胁迫下(MS、SS),第4叶位的色素含量最多。而对于同一叶位,随着水分胁迫程度的增加,1~3叶位的色素含量逐渐降低,4~6叶位的色素含量先增加后降低,其中,MS处理4~6叶位的TChl含量较CK分别增加了14.44%、15.12%与20.83%。水分处理、叶位及水分与叶位的交互作用对各色素含量均产生极显著影响(P<0.01)。
3 讨 论
本研究表明在充分供水条件下,随叶位的增加,Pn、Gs和Tr的变化趋势与Ci相反,呈倒“V”形(图1)。由于上部叶位叶片刚刚形成,幼叶生长旺盛,但许多内部结构还不完善,所以净光合速率相对较低。但随着叶片成熟,叶片结构逐渐完整,光合色素含量增加(表3),各种调节机制逐步完善,净光合速率相对较高,其中,第3叶位的净光合速率最高。当叶片逐渐衰老,其组织结构开始遭到破坏,发生光合衰退、叶绿素逐步分解(表3),细胞代谢水平下降,导致叶片光合能力也不断下降[19]。在水分胁迫条件下,植物通过调整气孔开闭程度来控制水分、气体交换,气孔开闭程度直接调节了气孔导度。气孔关闭在限制了水分向大气散失的同时也限制了CO2进入气孔腔[20-21]。在本研究中,水分亏缺使各叶位(除4~6叶位)Pn,Gs和Tr显著降低(图1A、1B、1D),由于Pn下降,消耗的CO2减少,导致Ci增加(图1C)。但在水分胁迫条件下(MS、SS),第4叶位的Pn、Gs和Tr较其他叶位更高,说明此叶位应对干旱胁迫的能力更强。在充分供水条件下,随叶位增加,叶面积先增大后减小,其中第3叶位的叶面积最大。而干旱胁迫降低了各叶位的叶面积(除MS处理4~6叶位叶面积增加外),这可能是由于膨压损失、光合作用和能量供应减少,细胞分裂和伸长受到干扰引起的[22-23]。但在水分胁迫条件下,第4叶位的叶面积最大,MS处理下的叶面积甚至比CK更大,可能是因为第4叶早于第3叶,受水分胁迫时第4叶基本达到最大面积,后期受影响小,而第3叶和2、1叶正在生长中,所以受影响较大。在本研究中,第3叶位光合参数及叶面积的变异系数均大于第4叶位,对水分胁迫更加敏感(表4)。光合色素能吸收光能,对植物来说至关重要,而色素浓度又易受叶龄及水分胁迫的影响[24-25]。在本研究中,充分供水条件下,叶绿素含量的变化趋势与Pn相似,表明Chla、Chlb和TChl随叶片成熟逐渐增加,在第3叶位达到最大值,这与Li等[26]的研究结果相似。而叶绿素含量与Pn在4~6叶位逐渐下降,可能是由于叶片衰老引起的(表3)。MS和SS处理各叶位的Chla, Chlb和TChl (除MS处理4~6叶位色素含量增加外)降低,这是氧化胁迫的典型特征,可能是由色素光氧化及叶绿素降解产生的。Car既是一种光合色素,也是一种内源性抗氧化剂,在光合作用和光保护中起着重要作用[27]。在本研究中,干旱胁迫降低了Car含量(除MS处理4~6叶位Car含量增加外)(表3),植物猝灭活性氧的能力降低,细胞内积累了更多氧自由基,叶绿体的膜结构破坏,加速叶绿素的分解[28]。水分胁迫下第4叶位的各光合色素含量最多,对于其维持较高的光合能力具有重要作用。为了维持叶绿素分子吸收光能的平衡,光合器官应用了不同的策略,包括光吸收、光化学和光保护。其中最广泛的光保护机制之一是以热的形式在光系统II天线中耗散多余的光能,这参与了叶绿素荧光的非光化学猝灭(NPQ)[29]。有研究得出,NPQ的变化趋势与Pn相反[30]。在本研究中,随叶位增加,NPQ先降低后升高,且随着水分胁迫程度的增加,各叶位的NPQ逐渐增加(除MS处理4~6叶位NPQ降低外),其中,第4叶位的NPQ在MS处理时最低,说明此时该叶片将更多的能量应用于光化学反应(图3D)。qP值近似于PSII反应中心开放的比例,代表光合作用消耗的能量[31]。在本研究中,qP和Pn的变化趋势相似,干旱胁迫下,qP值降低(除MS处理4~6叶的qP增大外),说明干旱胁迫降低了叶片的光转换能力(图3C),其中CK第3叶位的qP最大,光转换能力最强;水分胁迫时,第4叶位的qP最大,光转换能力最强。F0为暗适应下最小荧光,代表了PSII反应中心的破坏程度[32-33]。本研究结果显示,在充分供水条件下,随着叶片的成熟(1~3叶位)Pn逐渐增加,F0逐渐减小;而随着叶片衰老(4~6叶位),Pn逐渐减小,F0逐渐增加。此外,F0随干旱胁迫程度的增加显著增加(图3A),这可能是由于光系统II (D1蛋白和PS的其他部分)的降解或能量向反应中心转移中断引起的[4]。在水分胁迫时,第4叶位的F0最小,PSII反应中心的破坏程度最小。Fv/Fm可以用来反映PSII的最大效率(所有PSII中心开放时的效率)[34]。在充分供水条件下,1~3叶位的Fv/Fm逐渐增加说明植物的光能利用效率逐渐增强(图3B)。而随着叶片衰老及干旱胁迫程度的增加,Fv/Fm显著下降,这可能是由于PSII反应中心同化能力下调及叶绿素含量降低导致的[35-36]。充分供水时,第3叶位的Fv/Fm最大,水分胁迫时,第4叶位的Fv/Fm最大,但第3叶位对水分胁迫更加敏感,其变异系数较第4叶位更大(表4)。

表3 不同处理下辣椒幼苗不同叶位光合色素含量Table 3 Photosynthetic pigments content of pepper seedling at different leaf positions under different treatments

表4 水分胁迫下辣椒幼苗第3、4叶位各参数的变异系数Table 4 Variation coefficient of parameters at 3rd and 4th leaf positions of pepper seedling under water stress
4 结 论
在充分供水时,随叶位的增加,Pn、Gs、Tr、叶面积、光合色素含量、qP、Fv/Fm均呈先增加后降低的趋势。其中,第3叶位的光合色素含量最多,Pn、qP、Fv/Fm最大,NPQ、F0最小,说明与其他叶位相比,充分供水时第3叶位的光转换能力及光能利用效率更强。而在干旱胁迫时,随着胁迫程度的增大,各参数逐渐降低(除Ci、F0、NPQ外),其中,第4叶位的光合色素含量最多,这对于其维持较高的光合能力具有重要作用。与其他叶位相比,第4叶位的qP、Fv/Fm最大,NPQ、F0最小,说明与其他叶位相比,受干旱胁迫时第4叶位的PSII反应中心的破坏程度更小,光转换能力及光能利用效率更强,并将更多的能量应用于光化学反应。第3、4叶位是对辣椒幼苗生长具有主要贡献的叶片,但在水分胁迫条件下,第3叶位光合参数、叶面积、叶绿素含量及叶绿素荧光参数的变异系数较第4叶位更大,说明第3叶位对于水分胁迫更加敏感。因此,在干旱胁迫试验中,宜选用第3叶位测量辣椒幼苗光合、荧光参数。
