洪湖5种优势沉水植物光合荧光特性比较研究
2015-07-04经博翰袁龙义
经博翰,袁龙义,2*
(1 长江大学 园艺园林学院,湖北荆州434025;2 长江大学 湿地生态与农业利用教育部工程研究中心,湖北荆州434025)
近20年来,全世界都面临着湖泊富营养化加剧的严峻挑战[1],中国的湖泊环境问题尤为突出[2]。沉水植物普遍出现衰退甚至消失的迹象,并引发了水质恶化、水华频发等一系列生态环境问题,严重影响了人们的正常生活和社会经济的持续发展[3-4]。沉水植物是许多淡水生态系统的基本结构框架,是最重要的第一生产者,在湖泊治理方面,利用沉水植物修复富营养化湖泊具有成本低廉、低碳环保等特点,是真正可持续的治理方法[5]。苦草[Vallisneria natans(Lour.)Hara]、黑藻(Hydrillaverticillata)、狐尾藻(MyriophyllumverticillatumL.)、菹草(PotamogetoncrispusL.)和马来眼子菜(PotamogetonwrightiiMorong)是洪湖中心湖区沉水植物群落中具有高耐污高吸污特点的优势物种,对洪湖湖水自净、洪湖淡水生态系统平衡有着重要意义。作为植物净化法的主体,沉水植物的生理生态特征无疑是研究的热门对象,特别是其光合作用,对整个水域生态系统的结构和功能皆有重大的影响[6]。
叶绿素荧光动力学技术具有测量快速、简便、准确和无损伤等特点,已被视为植物光合作用与环境关系的内在探针,是探测和分析植物光合功能的重要手段[7-9]。目前,荧光技术已广泛地应用于陆生高等植物,以及大型的海草和珊瑚的生理生态研究,而在淡水水体中水生高等植物的生理生态研究方面运用较少[10-15],已有的淡水水体中高等水生植物的荧光特性研究,多是在试验控制条件下进行生态因子对水生植物胁迫的对比分析,对自然生境中水生植物光合荧光参数的对比研究还未见相关报道[16-17]。本实验以自然环境中洪湖常见的5 种沉水植物苦草、黑藻、狐尾藻、菹草和马来眼子菜作为研究对象,原位测定这5种沉水植物主要叶绿荧光动力学参数及快速光响应曲线,并比较自然水体中这5种沉水植物PSⅡ主要荧光参数特征,旨在为不同水深条件下人工配置沉水植物群落提供理论依据。
1 材料和方法
1.1 研究地概况
洪湖(29°42′~29°58′N;113°13′~113°29′E)位于长江中游北岸,江汉平原四湖水系尾端,是江汉湖群中最大的湖泊。担负着长江中下游江汉平原地区供水、蓄洪排涝、污染自净、农渔业生产等重任[18]。其植被区划属北极植物区,中国-日本森林植物亚区,从湖滨到湖心,依次出现湿生植物、挺水植物、浮叶植物和沉水植物等生态类型[19]。植物资源丰富,尤其是水生植物,种类多、分布广[20],因此洪湖无疑是野外研究沉水植物较为理想的试验场所。
1.2 研究方法
以沉水植物生长茂密的洪湖凹沟子作为采样区域,将5种常见沉水植物苦草、黑藻、狐尾藻、菹草和马来眼子菜作为研究对象,利用水下调制荧光仪(Diving-PAM)对其叶绿荧光参数进行原位测定,测定过程中每种受试植物在水深150cm 湖区随机选择3 个样株,每株选择1~2 片完全展开的健康叶片。
太阳尚未直射到水草上开启检测光(0.15μmol·m-2·s-1),得到暗适应条件下光系统Ⅱ(PSⅡ)最小荧光(F0),再由饱和脉冲光(4 000μmol·m-2·s-1)测得暗适应的最大荧光(Fm)。根据F0和Fm计算出PSⅡ最大光化学量子产量(Fv/Fm=(Fm-F0)/Fm),以反映PSⅡ反应中心内禀光能转换效率或潜在的光能转换效率。然后,开启光化光照射,当时实荧光达到稳态后关闭光化光,同时打开远红光(约5s),经检测光、饱和脉冲光测得光化光适应条件下最小荧光(F0′)和最大荧光(Fm′)。根据F0′和Fm′算出PSⅡ有效光化学量子产量[Fv′/Fm′=(Fm′-F0′)/Fm′],它反映开放的PSⅡ反应中心原初光能捕获效率[21]。随后,原位测定受试植物的快速光响应曲线,开启光强度分别为:33、104、219、342、515、708、1 042、1 407μmol·m-2·s-1的光化光,在任一光合有效辐射(PAR)强度下,打开饱和脉冲前得到的荧光为F,打开饱和脉冲后得到的最大荧光为Fm′,可变荧光△F=Fm′-F,由此得出光适应条件下水生植物PSⅡ的有效量子产量(Y):
Y=(Fm′-Ft)/Fm′=△F/Fm′
根据Y和PAR计算出相对电子传递速率(relative electron transport rate,rETR)[22]:
rETR=Y×PAR×0.5×0.84
1.3 快速光曲线拟合
采用SPSS软件进行快速光曲线拟合,曲线拟合采用最小二乘法,快速光曲线的拟合采用Platt[23]、Ralph[24]等提出的方程。其方程式为:
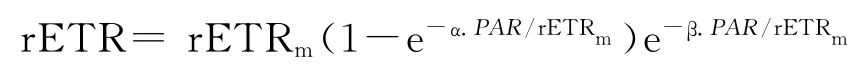
式中,rETRm为无光抑制时的最大潜在相对电子传递速率;α为rETR-PAR 曲线的初始斜率,反映植物对光能的利用能力;β为光抑制参数。由此可以得出半饱和光强:Ek(Ek=rETRm/α)。
1.4 数据处理
采用Excel 2007 和SPSS 17.0 软 件 对 所 有 数据进行统计分析,采用单因素方差分析(one-way ANOVA)比较不同数据组间的差异。
2 结果与分析
2.1 5种沉水植物的荧光参数比较
PSⅡFv/Fm反映PSⅡ内禀光能转换效率。由图1 可以看出,在自然生长条件下,5 种沉水植物PSⅡFv/Fm分别为苦草0.603、黑藻0.723、狐尾藻0.751、菹草0.778、马来眼子菜0.646。其中,苦草与马来眼子菜的Fv/Fm分别与另外4 种沉水植物的差异达到显著水平(P<0.05),且苦草的Fv/Fm为受试植物中最小,马来眼子菜次之;黑藻与菹草的Fv/Fm差异达到显著水平(P<0.05),且菹草的Fv/Fm比黑藻高;狐尾藻的Fv/Fm与黑藻或菹草的差异皆不显著。
PSⅡFv′/Fm′反映开放的PSⅡ反应中心原初光能捕获效率。5种沉水植物的PSⅡFv′/Fm′分别为苦草0.423、黑藻0.574、狐尾0.608、菹草0.653、马来眼子菜0.493。其中,苦草、菹草、马来眼子菜的Fv′/Fm′分别与其他4种沉水植物的差异达到显著水平(P<0.05),且菹草的Fv′/Fm′最高,马来眼子菜次之,苦草的Fv′/Fm′最低;而黑藻与狐尾藻的Fv′/Fm′差异不显著,但二者的Fv′/Fm′皆显著低于菹草且高于马来眼子菜。
2.2 不同沉水植物快速光曲线分析
由图2可知,洪湖5种常见沉水植物快速光曲线(rapid light curves,RLCs)呈明显变化,都可采用指数衰减方程[21-22]拟合(R2>0.998,n=9)。通过分析RLCs,可获得一系列反映光合能力的参数。
α为rETR-PAR曲线初始斜率,反映了植物对光能的利用能力。由图3 可知,5 种沉睡植物的α分别为苦草0.213、黑藻0.373、狐尾藻0.348、菹草0.487、马来眼子菜0.317。其中,黑藻与狐尾藻的α差异不显著,却分别与其他3种受试植物的α差异达到显著水平(P<0.05),且菹草的α最高,黑藻、狐尾藻居中,马来眼子菜次之,苦草最低。
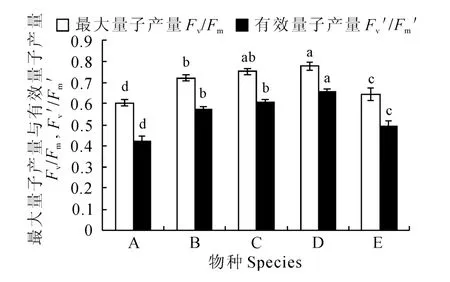
图1 不同沉水植物PSⅡ最大量子产量和PSⅡ光化学有效量子产量Fig.1 Fv/Fmand Fv′/Fm′for submerged macrophytes
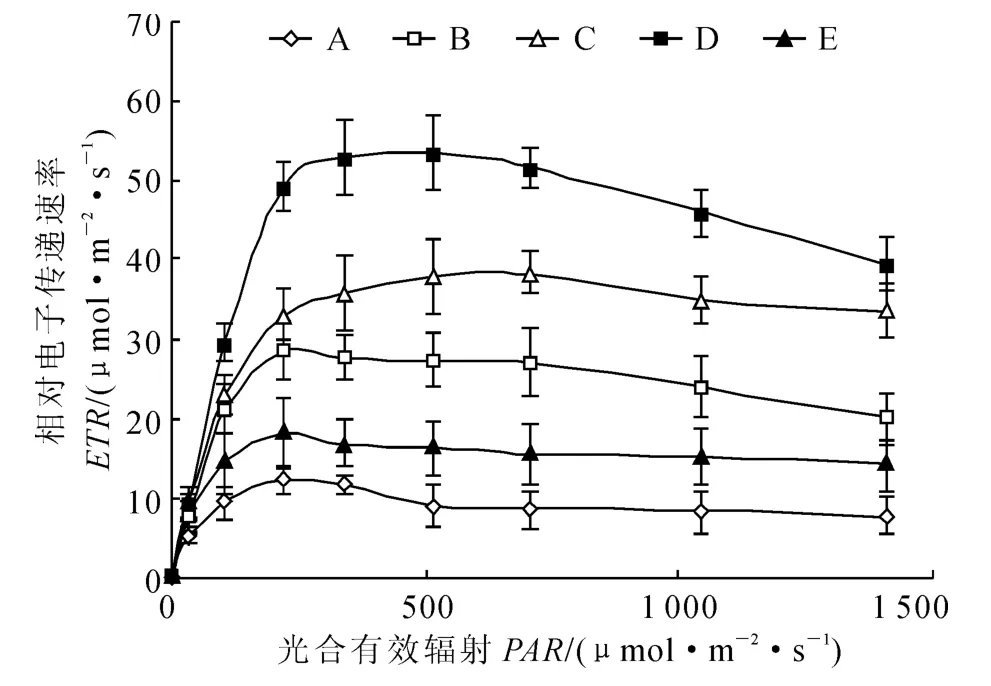
图2 5种沉水植物的快速光曲线比较Fig.2 Comparative study on the rapid light curves of five submerged macrophytes
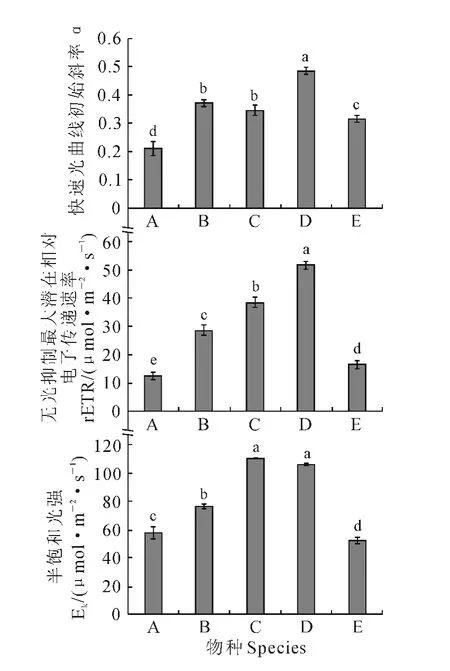
图3 5种沉水植物快速光曲线初始斜率、最大电子传递速率和半饱和光强比较Fig.3 Comparative study on theα,rETRm and Ekof five submerged macrophytes
rETRm为无光抑制时的植物最大潜在相对电子传递速率。由图3可知,5种沉水植物的rETRm分别为苦草12.3、黑藻28.6、狐尾藻38.4、菹草51.7、马来眼子菜16.5。其中,每种沉水植物之间的rETRm差异均达到显著水平(P<0.05)。这表明5种沉水植物在无光抑制时的最大潜在相对电子传递速率菹草最高,狐尾藻次之,黑藻居中,马来眼子菜再次之,苦草最低。
半饱和光强Ek可反映植物对强光的耐性。由图3可看出,5种沉水植物Ek分别为苦草57.90、黑藻76.63、狐尾藻110.35、菹草106.15、马来眼子菜51.99。其中,菹草与狐尾藻的Ek差异不显著,却分别与其他3种受试植物的Ek差异达到显著水平(P<0.05),且这5种沉水植物耐强光性菹草、狐尾藻最强,黑藻居中,苦草次之,马来眼子菜最弱。
3 讨 论
3.1 PSⅡ潜在光能转化效率
Fv/Fm是PSⅡ最大光化学量子产量,代表了PSⅡ反应中心内禀光能转换效率或最大PSⅡ的光能转换效率。已有研究表明[25-26],Fv/Fm不受物种的影响,非胁迫条件下,该参数的变化极小,多数高等植物Fv/Fm约为0.83;当植物受到胁迫时,Fv/Fm会显著降低。叶片叶绿素荧光与光合作用中各反应过程密切相关,任何环境因子对光合作用的影响都可通过叶片叶绿素荧光动力学反映出来[27]。从本实验结果可以看出,5种沉水植物的PSⅡFv/Fm均小于0.8,表明此5种沉水植物均可能受到胁迫,且外界胁迫对沉水植物PSⅡ反应中心造成一定损伤[28]。现如今已有关于UV-B辐射、多环芳烃污染以及网状澡的附着对水生植物Fv/Fm影响的报道[29-30],其他因子胁迫对Fv/Fm影响还未见相关报道。结合采样区域的水质状况,最有可能引起采样区域沉水植物Fv/Fm值降低的原因为植物体上附着的丝状藻类[31],至于不同植物本身Fv/Fm对胁迫因子的耐受性如何,还有待进一步研究。
3.2 洪湖水域沉水植物快速光响应曲线特性
光合作用是沉水植物最重要的代谢活动[4]。沉水植物的光合作用能力受植物本身和外界环境因子的双重影响,其核心是光响应曲线[31]。传统的氧光合曲线(photosynthesis-irradiance curve,P-Ⅰ曲线)测量时,要求在每一PAR梯度下适应较长时间(5~10min),测量过程中的光照会影响受试植物的光合状态,而且在野外难以进行平行测量。而利用调制叶绿素荧光技术可以缩短每一PAR梯度下的适应时间(10s),得出的典型光响应曲线(RLCs)可以基本反映受试植物的自然光合状态[31]。本研究中沉水植物的RLCs均是在自然条件下原位测量的,且测定结果均可采用拟合光合响应曲线方程来拟合[23-24]。经过受试植物RLCs的光合参数比较,植物rETRm和Ek变化趋势基本一致,实验中光合效率较高的菹草与狐尾藻都是耐受强光能力较好的优势种。这是因为Ek反映了植物耐受强光的能力[24],而耐受强光能力强的植物具有较高的最大光合速率。之前已有报道显示苦草有较强的耐低光能力,在仅为5%自然光强下,其细胞膜透性仍无明显变化,在自然水体的底层有很强的生长优势,可能是修复富营养化水体的一个先锋物种[32]。由于本实验对每种沉水植物在150cm 水深条件下的光合荧光特征进行了测定分析,而不同的水深梯度、光强、CO2等环境影响因子皆有不同。因此自然水体中不同水深梯度下各种沉水植物的光合荧光特性比较有待于进一步研究。
[1]ZHANG Y(张 宇),WANG SH R(王圣瑞),LI ZH X(李重祥),etal.Effect of repairing and research prospect of eutrophication water by submersed macrophytes[J].InnerMongoliaPrataculture(内蒙古草业),2009,21(4):17-21(in Chinese).
[2]MA T(马 婷),WANG G X(王国祥),LI Q(李 强),etal.The growth ofPotamogetoncrispusin the eutrophication water[J].Ecology andEnvironment(生态环境),2007,16(3):758-761(in Chinese).
[3]QIN B Q(秦伯强),WANG X D(王小冬),TANG X M(汤祥明),etal.Drinking water crisis caused by eutrophication and cyanobacterial bloom in Lake Taihu:cause and measurement[J].AdvancesinEarthScience(地球科学进展),2007,22(9):896-906(in Chinese).
[4]SU R L(苏睿丽),LI W(李 伟).Advances in research on photosynthesis of submerged macrophytes[J].ChineseBulletinofBotany(植物学通报),2005,22(S):128-138.
[5]ZHANG Y J(张饮江),LIU X P(刘晓培),JIN J(金 晶),etal.Research progress in submerged plant purifying water quality[J].Science&TechnologyReview(科技导报),2012,30(27):72-79(in Chinese).
[6]SU W H(苏文华),ZHANG G F(张光飞),ZHANG Y S(张云孙),etal.The photosynthetic characteristics of five submerged aquatic plants[J].ActaHydrobiologicaSinica(水生生物学报),2004,28(4):391-395(in Chinese).
[7]ZHANG SH R(张守仁).A discussion on chlorophyll fluorescence kinetics parameters and their significance[J].ChineseBulletinofBotany(植物学通报),1999,16(4):444-448(in Chinese).
[8]KUSTER A,ALTENBURGER R.Development and validation of a new fluorescence-based bioassay for aquatic macrophyte species[J].Chem.Osphere,2007,67(1):194-201.
[9]LIU SH R(刘书仁),GUO SH R(郭世荣),CHENG Y J(程玉静),etal.Effect of exogenous proline on the ascorbat-glutahione cycle and photosynthetic fluorescence characteristics in leaves of cucumber seedlings under high temperature stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2010,30(2):309-316(in Chinese).
[10]ZHENG SH X(郑淑霞),SHANGGUANG ZH P(上官周平).Comparison of leaf gas exchange and chlorophyll fluorescence parameters in eight broad-leaved tree species[J].ActaEcologicaSinica(生态学报),2006,26(4):1 080-1 087(in Chinese).
[11]JU ZH CH(鞠郑春),YU ZH W(于振文).Effects of nitrogen topdressing at different growth stage on chlorophyll fluorescence of winter wheat flag leaves[J].ChineseJournalofAppliedEcology(应用生态学报),2006,17(3):395-398(in Chinese).
[12]WANG M(王 梅),GAO ZH K(高志奎),HUANG R H(黄瑞虹),etal.A heat stress characteristics of photosystem Ⅱin eggplant[J].ChineseJournalofAppliedEcology(应用生态学报),2007,18(1):63-68(in Chinese).
[13]BELSHE E F,DURAKO M J,BLUM J E.Photosynthetic rapid light curves(RLC)ofThalassiatestudinumexhibit diurnal variation[J].JournalofExperimentalMarineBiologyandEcology,2007,342:253-268.
[14]LAMOTE M,DUNTON K H.Effects of drift macroalgae and light attenuation on chlorophyll fluorescence and sediment sulfides in the sea grassThalassiatestudinum[J].JournalofExperimentalMarineBiologyandEcology,2006,334(2):174-186.
[15]RALPH P,GADEMANN R,LARKUM A,etal.Spatial heterogeneity in active chlorophyll fluorescence and PSⅡactivity of coral tissues[J].MarineBiology,2002,141(4):639-646.
[16]LI Q(李 强),WANG G X(王国祥),PAN G Q(潘国权),etal.Influence of water turbidity on germination ofPotamogetoncrispusand growth of germinated seedling[J].ActaEcologicaSinica(生态学报),2006,26(11):3 594-3 601(in Chinese).
[17]HANELT D,HAWES I,RAE R.Reduction of UV-B radiation causes an enhancement of photoinhibition in high light stressed aquatic plants from New Zealand lakes[J].JournalofPhotochemistryandPhotobiologyB:Biology,2006,84(2):89-102.
[18]LU SH(卢 山),LI SH J(李世杰),WANG X L(王学雷).Study on the environmental evolution and ecological protection of Honghu Lake[J].WetlandScience(湿地科学),2004,2(3):234-237(in Chinese).
[19]LI W(李 伟).Flora studies on aquatic vascular plants in Lake Honghu[J].JournalofWuhanBotanicalResearch(武汉植物学研究),1997,15(2):113-122(in Chinese).
[20]WANG X L(王雪雷),LIU X T(刘兴土),WU Y J(吴宜进).Analysis of water environment characteristics and purification ability of Honghu Lake wetland in Jianghan Plain[J].J.WuhanUniv.(Nat.Sci.Edi.)武汉大学学报·理学版),2003,49(2):217-220(in Chinese).
[21]WALDHOFF D,FURCH B,JUNK W J.Fluorescence parameter,chlorophyll concentration,and anatomical features as indicators for flood adaptation of an abundant tree species in central Amazonia:Symmeriapaniculata[J].EnvironmentalandExperimentalBotany,2002,48(3):225-235.
[22]RALPH P J,GADEMANN R,DENNISON W C.In situ seagrass photosynthesis measured using a submersible,pulse-amplitude modulated fluorometer[J].MarineBiology,1998,132(3):367-373.
[23]PLATT T,GALLEGOS C L,HARRISON W G.Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton[J].JournalofMarineResearch,1980,38:103-111.
[24]RALPH P J,GADEMANN R.Rapid light curves:A powerful tool to assess photosynthetic activity[J].AquaticBotany,2005,82:222-237.
[25]CAO Y H(曹永慧),ZHOU B ZH(周本智),ZHANG R M(张汝民),etal.Response of chlorophyll fluorescence parameters ofIllicium lanceolatumon different light conditions[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2012,32(3):525-531(in Chinese).
[26]CHENG X R(成向荣),SHU J(舒 骏),LIU J(刘 佳),etal.Growth,Photosynthesis and fluorescence characteristics ofBegoniafimbristipulaandGynuradivaricataunder different light conditions[J].ActaBot.Boreal.-Occident.Sin.(西 北植物学 报),2014,34(7):1 426-1 431(in Chinese).
[27]HUI H X(惠红霞),XU X(许 兴),LI Q R(李前荣).Exogenous betaine improves photosynthesis ofLyciumbarbarumunder salt stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2003,23(12):2 137-2 142(in Chinese).
[28]DAWSON S P,DENNISON W C.Effects of ultraviolet and photosynthetically active radiation on five sea grass species[J].MarineBiology,1996,125(4):629-638.
[29]MARWOOD C A,SOLOMON K R,GREENBERG B M.Chlorophyll fluorescence as a bioindicator of effects on growth in aquatic macrophytes from mixtures of polycyclic aromatic hydrocarbons[J].EnvironmentalToxicologyandChemistry,2001,20(4):890-898.
[30]LI Q(李 强),WANG G X(王国祥),MA T(马 婷),etal.Changes of photosynthetic characters ofVallisneriaasiaticaadhered byHydrodictyonreticulatunm[J].JournalofLakeSciences(湖泊科学),2007,19(3):315-320(in Chinese).
[31]SONG Y ZH(宋玉芝),CAI W(蔡 炜),QIN B Q(秦伯强).Photosynthetic fluorescence characteristics of floating-leaved and submersed macrophytes commonly found in Taihu Lake[J].ChineseJournalofAppliedEcology(应用生态学报),2009,20(3):569-573(in Chinese).
[32]XIAO Y E(肖月娥),CHEN K N(陈开宁),DAI X B(戴新宾),etal.Comparison of adaptive capacity to low light intensity of two angiosperm submerged macrophytes from Taihu Lake[J].PlantPhysiologyCommunication(植物生理学通讯),2006,42(3):421-425(in Chinese).
