水稻种衣剂对秧苗生理生化及叶绿素荧光参数的影响
2015-07-04高友丽汤健良金晨钟胡一鸿
张 浩,高友丽,陈 勇,汤健良,金晨钟,胡一鸿*
(1 湖南人文科技学院 生命科学系,湖南娄底417000;2 湖南省种子质量检测中心,长沙410016;3 湖南亚华种子公司,长沙410205;4 湖南省农田杂草防控协调创新中心,湖南娄底417000)
种衣剂在水稻种子标准化生产和深加工方面起到重要的作用[1]。水稻的栽培方式不同于其他作物,水稻种衣剂主要在秧苗期发挥作用,用种衣剂包衣的水稻种子对苗期病虫害具有较好防治效果[2]。浸种型种衣剂主要的成分为农药,还含有色浆、成膜剂和乳化剂等[3]。在常用的水稻浸种型种衣剂中,2.5%吡·咪的主要成分为吡虫啉和咪酰胺,3%恶·咪的有效成分为恶霉灵和咪酰胺,锐胜的有效成分为噻虫嗪,适乐时有效成分为咯菌腈。种衣剂包衣于水稻种子后,药剂成分缓慢释放,被种子根系和种胚吸收后对水稻的生长产生影响[4-5]。有研究表明,植物受到农药和其他化学物质胁迫时,其光合能力会受到一定影响[6-8]。水稻种衣剂的实质是农药,前人的研究主要集中在种衣剂增产与病虫害防治方面及其抗性机理方面[9-10],而种衣剂对种子和幼苗药害胁迫机理与幼苗的适应机理国内外至今尚未见报道。‘深两优5814’是在中国推广面积较大的优质高产水稻品种,对黑条矮缩病的抵御能力较差,采用含靶标农药的种衣剂对其种子进行包衣,能够提高秧苗的抗病能力。本试验采用有效成分为吡·咪、恶·咪、噻虫嗪、咯菌腈的种衣剂包裹‘深两优5814’水稻种子进行苗期实验,测定幼苗抗氧化酶活性、叶绿素含量、MDA 含量、GSH 的含量和叶绿素荧光参数等指标,探讨种衣剂对幼苗胁迫机理,为种衣剂的安全高效应用提供理论依据。
1 材料和方法
1.1 试验材料
水稻种子‘深两优5814’由湖南亚华种子有限公司提供;2.5%吡·咪、3%恶·咪由北农(海利)公司提供,锐胜、适乐时由先正达公司提供。
1.2 试验方法
将上述4种种衣剂与水稻种子按药种比1∶50包衣,清水处理作为对照,常规方法浸种、催芽。当种子出芽长度与种子长度一致时,将种子播种在栽培盆中,每盆播50 颗种子,共设计5 个处理(含对照),每个处理重复3次,共栽15盆,播种后14d起每隔4d每盆随机取叶龄一致的6~8片叶测定相关指标。
其中,超氧化物歧化酶(SOD)活性测定按照Ruan等[11]的方法,过氧化物酶(POD)活性测定按照Kochba等[12]的方法,过氧化氢酶(CAT)活性测定按照张龙翔等[13]的方法;叶绿素含量测定按照张志良等[14]的方法,GSH 含量测定按照张承圭等[15]的方法;MDA 含量测定采用匡银近等[16]的方法;叶绿素荧光参数的测定参照夏建荣等[17]的方法,采用Yaxin-1161G 连续激发式荧光仪,光源为470nm LED,光强为2 000μmol·m-2·s-1,采样速率为2 ms以前10μs 1次,2ms后1ms 1次,所有样品测定前暗适应30min。
1.3 数据处理
所有实验均重复3次,数据差异显著性分析采用SPSS 13.0(LSD法)检测。
2 结果与分析
2.1 种衣剂对水稻苗期叶片MDA 含量的影响
MDA 是细胞膜脂过氧化的产物,其含量高低可作为膜脂受过氧化伤害大小的标志[10,18]。图1显示,随培养时间的延长,各处理组和对照水稻苗期叶片的MDA 含量均呈上升趋势。其中,播种后22 d的2.5%吡·咪和3%恶·咪处理组叶片MDA 含量上升最为明显,分别比同期对照显著增加65.93%和66.51%,而其他2种种衣处理组的叶片MDA 含量比对照稍低或者显著降低;播种后26d,4种种衣剂处理组叶片MDA 含量与对照比较均无显著性差异。这表明2.5%吡·咪和3%恶·咪对水稻秧苗造成了膜脂过氧化伤害,而其余2种种衣剂均没有造成伤害,但在苗期结束时秧苗都能完全恢复正常。
2.2 种衣剂对水稻苗期叶片抗氧化酶活性和抗氧化物质含量的影响
植物受到胁迫后,通过上调抗氧化酶活性和抗氧化物质含量来缓解氧化胁迫的伤害。其中,SOD通过歧化反应清除超氧自由基保护植物细胞[7],POD 与CAT 清除代谢产生的过氧化物与H2O2,防止植物细胞膜脂过氧化[18]。
首先,随着培养时间的延长,2.5%吡·咪处理组秧苗叶片SOD 活性呈逐渐降低的趋势,在播种后14d达到最大值,而其余种衣剂处理组均呈先升高后降低的趋势,并均在播种后18d达到最大值(图2,A)。其中,在播种后14d时,2.5%吡·咪和锐胜处理组秧苗叶片SOD 活性与对照组相比显著升高,并以吡·咪处理组最为明显,其SOD 活性比对照显著 提高142.71%,其他2种种衣剂处理组SOD活性与对照无显著性差异,表明2.5%吡·咪和锐胜均对秧苗生长环境造成了胁迫,诱导水稻幼苗SOD活性增强;以后随培养时间的延长,各处理组SOD活性与对照的差异缩小,且活性均呈下降趋势。
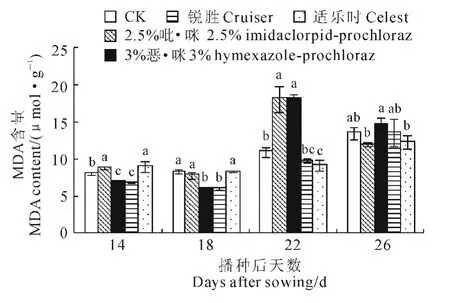
图1 不同种衣剂对水稻幼苗MDA 含量的影响Fig.1 Effect of different seed-coating agents on MDA content in rice seedlings

图2 不同种衣剂对水稻幼苗抗氧化酶活性和抗氧化物质GSH 含量的影响Fig.2 Effect of different seed-coating agents on antioxidant enzyme activities and GSH content in rice seedlings
其次,随着培养时间的延长,水稻秧苗叶片的POD 活性在3%恶·咪处理组表现为降低-升高-降低的变化,并在播种后14d达到最大值,而其余处理组和对照均呈升高后降低的趋势,并均在播种后22d时达到最大值(图2,B)。其中,在播种后14d,3%恶·咪处理组叶片的POD 活性最高,比对照组显著增加193.10%,而其他处理组与对照组无显著差异;在播种后18d,所有种衣剂处理组均显著高于对照,并仍以3%恶·咪处理组最高并显著高于其他处理组;在播种后22d,仅2.5%吡·咪组显著高于对照,其余处理组均与对照无显著差异;随着培养时间继续延长,各处理幼苗POD 活性呈现迅速下降趋势,3%恶·咪和锐胜种衣剂处理组甚至显著低于对照组。可见,在水稻幼苗培养过程中其生长受到3%恶·咪和2.5%吡·咪影响较大,激活POD 活性大幅波动,以利于植株抵御种衣剂胁迫造成的过氧化伤害。
再次,随着培养时间的延长,各种衣剂处理组水稻秧苗叶片的CAT 活性均有逐渐降低的趋势(图2,C)。其中,播种后14d和18d,各处理组叶片的CAT 活性与对照组差异不明显,但到22d 时,2.5%吡·咪和3%恶·咪处理组叶片的CAT 活性与对照相比显著增大,而锐胜和适乐时处理组叶片的CAT 活性与对照差异不明显;播种后26d时,却以锐胜和适乐时处理组叶片的CAT 活性比对照显著增大,而2.5%吡·咪和3%恶·咪处理组叶片的CAT 活性与对照差异不明显。实验结果表明种衣剂在苗期的中后时段对水稻幼苗的抗氧化酶CAT活性有显著的激活作用。
另外,GSH 能清除植物体内的活性氧物质,是生物体内降低氧化胁迫的解毒剂[18]。由图2,D 可知,在整个苗期除18d适乐时处理组与22d锐胜、适乐时处理组叶片GSH 含量与同期对照相比没有显著增加外,其余时期4种种衣剂处理组叶片GSH含量均显著高于对照,其中以3%恶·咪处理组增加最为明显并显著高于其他处理,但各处理组与对照的GSH 含量均随培养时间的延长而下降。由此推测水稻受种衣剂胁迫后促进了体内GSH 合成,始终在降低农药毒害的过程中发挥着重要作用,尤其在在苗期结束时比抗氧化酶的表现更突出。
2.3 种衣剂对水稻苗期叶片叶绿素含量的影响
叶绿素含量是光合能力大小的重要指标[19-20]。由图3可知,播种后前3个时期各处理组水稻叶片的总叶绿素含量与对照相比均显著大幅降低,说明种衣剂处理后可能抑制了叶绿素的合成,但4种种衣剂处理组叶片的总叶绿素含量均随培养时间的延长而增加。到播种后26d,各处理组叶片总叶绿素含量与对照组的差异缩小,其中的3%恶·咪处理已显著超过对照,锐胜处理稍高于对照,而其余两种种衣剂处理仍显著低于对照,这可能是种衣剂在环境中逐渐释放后,秧苗受到的药剂胁迫程度得到缓解,使叶绿素合成得到不同程度恢复。
2.4 种衣剂对水稻苗期叶片叶绿素荧光参数的影响
φPo为暗适应后的最大光化学效率,其值随外界胁迫条件的增加而降低[21-22];PIABS为吸光性能指数,比φPo更能灵敏地反映光合机构的变化[23]。本实验中各种衣剂处理组与对照叶片的φPo值在整个苗期均无明显差异(图4,A)。播种后14d,各处理组叶片的PIABS值与对照相比显著大幅度上升,其中锐胜处理组的PIABS值上升最为明显,达到对照的4.3倍;其余时期除播种后18d3%恶·咪和锐胜处理组、播种后26d适乐时处理组叶片的PIABS值与对照相比下降,其余各处理组叶片的PIABS值与对照基本持平或上升(图4,B),4 种种衣剂处理后与对照相比叶片的PIABS值在苗期均没有呈下降趋势,推测试验中种衣剂浓度没有达到抑制水稻幼苗光合机构功能的程度。同时,Ψo表示光照2ms后反应中心的开放程度,表示叶绿素吸收的光能用于光化学反应的部分,反映植物光合活性的高低[17]。播种后14d、22d,各种衣剂处理组幼苗叶片的Ψo值显著高于对照组;播种后18d除3%恶·咪处理组叶片Ψo值显著低于对照外,其余各种衣剂处理组Ψo值均与对照持平,而播种后26d除锐胜处理组叶片Ψo值与对照持平外,其余各种衣剂处理组Ψo值均低于对照组(图4,C),表明在水稻幼苗生长的初期和中后期,种衣剂能在一定程度上促进植株对光能的利用率。ABS/CSM为比活性参数,表示单位面积吸收的光能[21],如图4,D 所示,播种后14d,2.5%吡·咪和3%恶·咪处理组叶片的ABS/CSM值较对照有所上升,随后各处理组叶片的ABS/CSM值均随培养时间延长出现下降的趋势,播种后22d后,各处理组叶片的ABS/CSM值均显著低于同期对照。其中3%恶·咪处理组叶片的ABS/CSM值下降幅度最大,培养26d时仅为同期对照的15.79%,说明种衣剂均能降低苗期叶片对光能的吸收能力,以3%恶·咪处理后影响最为严重。
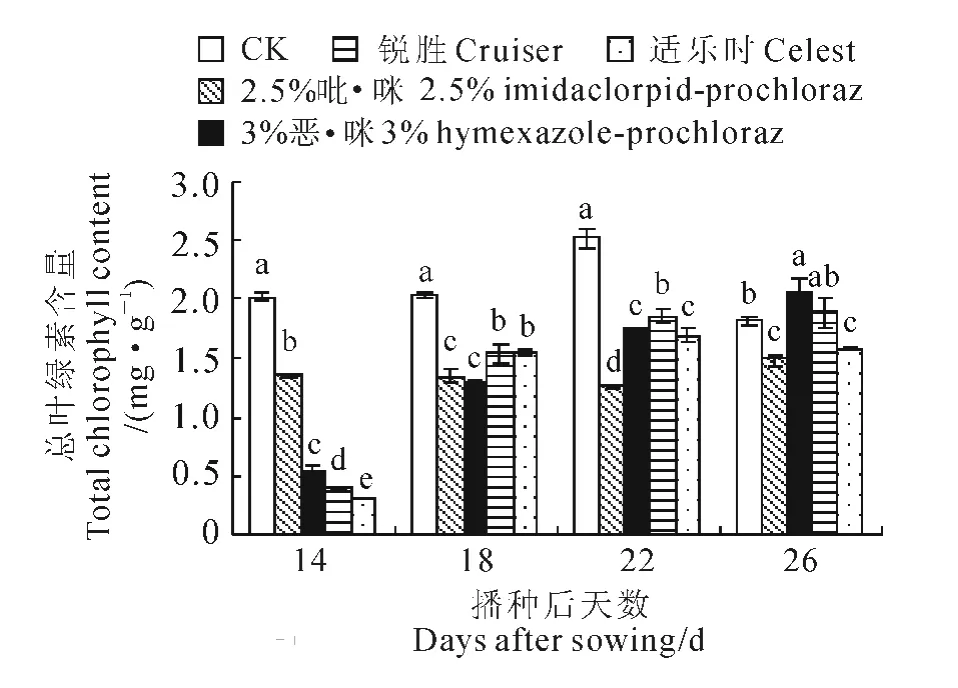
图3 不同种衣剂对水稻幼苗叶绿素含量的影响Fig.3 Effect of different seed-coating agents on chlorophyll content in rice seedlings
另外,DIo/CSM用来表示光合机构的热耗散能力[21]。播种后14d,各处理组叶片的DIo/CSM值均低于对照,但从播种后18d开始,3%恶·咪处理组叶片的DIo/CSM值与对照相比出现显著上升现象,其余种衣剂处理均与对照相近或显著低于对照(图4,E),推测3%恶·咪使幼苗受到严重胁迫从而增大了单位面积的热耗散。
3 讨 论
3.1 种衣剂对水稻苗期叶片抗氧化酶活性与MDA、GSH 含量的影响
植物抗氧化酶系统起着防止植物细胞膜脂过氧化和维持体内活性氧动态平衡的作用,活性氧动态平衡若被打破则会促使膜脂过氧化[24-25]。熊远福等[26]和刘西莉等[10]的实验均表明,种衣剂能明显地提高水稻幼苗抗氧化酶活性。本实验结果也显示,2.5%吡·咪和3%恶·咪分别对播种初期水稻叶片的SOD 和POD 活性有促进作用,4 种种衣剂对成苗期叶片的CAT 也有激活作用,CAT 活性上升滞后于SOD、POD,可能是由于SOD、POD 的产物激活了CAT 活性。
MDA 是膜脂过氧化的指标,刘西莉等[10]的实验发现,药种比1∶40~1∶60的浸种型种衣剂能降低水稻幼苗叶片膜质的过氧化程度。本实验结果发现,4种种衣剂均不能降低膜脂过氧化程度来减缓自由基损害,成苗期2.5%吡·咪和3%恶·咪会造成处理组叶片的MDA 含量上升,说明本试验浓度(药种比1∶50)的这2种种衣剂对水稻幼苗的细胞膜脂系统造成了氧化伤害。
GSH 是生物体内重要的抗氧化剂,通过其自身的氧化清除活性氧保护植物细胞,其值可作为细胞解毒的一个重要指标[10]。本实验结果表明,种衣剂处理后水稻叶片的GSH 含量升高,可能是对药剂造成氧化胁迫的应激反应,促使GSH 合成量增加,从而清除更多的活性氧,在一定程度上缓解种衣剂引起的氧化伤害,这与胡延玲等[27]发现水稻随着镉浓度的增加GSH 含量不断增加的结果相一致。
3.2 种衣剂对水稻苗期叶片叶绿素含量和叶绿素荧光参数的影响
叶绿素含量是体现植物光合能力的一个重要指标,有研究表明种衣剂处理能提高水稻、大豆等作物的叶绿素含量,提高植物的光合利用率[28-29]。种衣剂的主要成分是农药,前人也有研究表明,农药胁迫会造成水稻叶绿素的合成能力下降[30]。本研究结果显示,种子经种衣剂处理后,水稻幼苗在生长过程中降低了叶绿素含量,但随着培养时间的延长,推测种衣剂通过缓慢释放,逐渐降低了对水稻幼苗的胁迫,在成苗期水稻幼苗的叶绿素重新合成加速使叶绿素含量恢复到正常水平。
叶绿素荧光参数能反映叶片光合作用中光合机构对光吸收、传递、耗散和分配方面的特点,能对光合功能进行无损快速鉴定[21,31]。胁迫条件下,植物的光合效率、光合活性、光合电子传递效率均随胁迫条件的加强而下降,热耗散值随胁迫条件的加强而增加[32-34]。本实验表明,在水稻幼苗生长的初期,其叶绿素含量下降,水稻幼苗受到种衣剂的胁迫;但同时暗适应后的最大光化学效率φPo值维持不变,叶片性能指数PIABS值出现了明显的上升,反映光合活性高低的Ψo值也上升,同时热耗散DIo/CSM值也出现了下降,推测水稻叶片在种衣剂胁迫条件下能通过提高光能利用效率、提高吸收光能用于光化学反应的效率来弥补叶绿素含量下降造成的对生长的不利影响。尤其是在成苗期3%恶·咪处理组的单位面积吸收光能指标ABS/CSM值出现较大幅度下降,而其热耗散DIo/CSM值出现上升,说明3%恶·咪相对于其他种衣剂而言对水稻苗期的胁迫较大。
综上所述,水稻通过提高抗氧化酶活性和GSH含量来抵御药害胁迫。种衣剂的药害胁迫造成幼苗初期叶绿素含量下降,但种衣剂能促进水稻叶片对光能的利用,没有造成其光合能力同步下降。各种衣剂对水稻幼苗的胁迫程度不同,其中的3%恶·咪种衣剂对水稻的胁迫伤害较大,成苗期热耗散增大,单位面积吸收光能能力明显下降。
[1]LIU L H(刘丽华),LUO X W(罗锡文),WANG Z M(王在满),etal.Effect of coating with cold indicated seed-coating agents on germination and seedling characteristic of rice seeds[J].JournalofSouthChinaAgriculturalUniversity(华南农业大学学报),2014,35(3):30-34(in Chinese).
[2]ZENG ZH H(曾卓华),ZHANG Y T(张颖弢),LIANG Y(梁 颖),etal.Study on the effect of rice-coating material[J].Seed(种子),2004,23(7):28-29(in Chinese).
[3]CHEN W F(陈文丰),CHEN R B(陈荣彬),WU D H(吴东辉).Study on application effect of soaking suitable seed coating[J].GuangdongAgriculturalSciences(广东农业科学),2005,(2):15-17(in Chinese).
[4]GAO Y Y(高云英),TAN CH X(谭成侠),HU D S(胡冬松),etal.Review on seed coating formulation and its development[J].Modern Agrochemicals(现代农药),2012,11(3):7-10(in Chinese).
[5]KOUFMAN G.Seed coating:a tool for stand establishment:a stimulus to seed quality[J].HortTechnology,1991,1(1):98-102.
[6]XIE R(谢 荣),TANG X X(唐学玺),LI R Q(李永祺),etal.Effect of profenofos on glutathione peroxidase and on the contents of glutathione and carotinoid in two species of marine microalgae[J].JournalofOceanUniversityofQingdao(青岛海洋大学学报),2000,30(4):645-650(in Chinese).
[7]WU J C(吴进才),LIU J L(刘井兰),SHEN Y CH(沈迎春),etal.Effect of several pesticides on SOD activity in different rice varieties[J].ScientiaAgriculturaSinica(中国农业科学),2002,35(4):451-456(in Chinese).
[8]WANG Y X(汪月霞),SUN G R(孙国荣),WANG J B(王建波),etal.Relationships among MDA content,plasma membrane permeability and the chlorophyll fluorescence parameters ofPuccinelliatenuifloraseedlings under NaCl stress[J].ActaEcologicaSinica(生态学报),2006,26(1):122-129(in Chinese).
[9]ZHANG H Q(张海清),ZOU Y B(邹应斌),XIAO G CH(肖国超),etal.Effect and mechanism of cold tolerant seed-coating agents on the cold tolerance of early Indica rice seedlings[J].ScientiaAgriculturaSinica(中国农业科学),2006,39(11):2 220-2 227(in Chinese).
[10]LIU X L(刘西莉),LI J Q(李健强),LIU P F(刘鹏飞),etal.Effect of seed coating formulation for soaking and pregermination of rice seed on the growth and the enzyme activities related to the disease resistance in rice seedling[J].ChineseJournalofPesticideScience(农药学学报),2000,2(2):41-46(in Chinese).
[11]RUAN H,SHEN W,YE M,etal.Protective effects of nitric oxide on salt stress-induced oxidative damage to wheat(TriticumaestivumL.)leaves[J].ChineseScienceBulletin,2002,47(8):677-681.
[12]KOCHBA J,LAVEE S,SPIEGEL-ROY P.Differences in peroxidase activity and isoenzymes in embyogenic and non-embrogenic‘Shamoutic’orange ovular callus lines[J].PlantandCellPhysiology,1977,18(2):463-467.
[13]张龙翔,张庭芳,李令媛.生化实验方法技术(第2版)[M].北京:高等教育出社,1997:348-351.
[14]张志良,瞿伟菁,李小方.植物生理学实验指导(第4版)[M].北京:高等教育出版社,2009:227-229.
[15]张承圭,王传怀,袁玉荪,等.生物化学仪器分析及技术[M].北京:高等教育出版社,1994:96-98.
[16]KUANG Y J(匡银近),PENG H E(彭惠娥),YE G P(叶桂萍),etal.Effects of oligochitosan on cold resistance of eggplant seedlings[J].NorthernHorticulture(北方园艺),2009,(9):14-17(in Chinese).
[17]XIA J R(夏建荣),ZOU D H(邹定辉).Effects of desiccation on PSⅡperformance inUlvalactucaassessed with OJIP chlorophyll a fluorescence transients[J].MarineScienceBulletin(海洋通报),2007,26(4):50-55(in Chinese).
[18]WANG Q M(王启明),ZHENG A ZH(郑爱珍),WU SH G(吴诗光).Effects of drought-stress on protective enzyme activity and membrane lipid peroxidation in leaf of soybean flowering-poding period[J].JournalofAnhuiAgriculturalScience(安徽农业科学),2006,34(8):1 529-1 530(in Chinese).
[19]NOCTOR G,GOMEZ L,VANACKER H,etal.Interactions between biosynthesis compartmentation and transport in the control of glutathione homeostasis and signaling[J].JournalofExperimentalBotany,2002,53(372):1 283-1 304.
[20]WU Z T(伍泽堂),Relationship between superoxide radical and destruction of chlorophyll during leaf senescence[J].PlantPhysiology Communications(植物生理学通讯),1991,27(4):277-279(in Chinese).
[21]LI P M(李鹏民),GAO H Y(高辉远),STRASSER R J.Application of the chlorophyll fluorescence induction dynamics in photosynthesis study[J].JournalofPlantPhysiologyandMolecularBiology(植物生理学与分子生物学学报),2005,31(6):559-566(in Chinese).
[22]HE J Y,REN Y F,ZHU C,etal.Effect of Cd on growth,photosynthetic gas exchange,and chlorophyll fluorescence of wild and Cd-sensitive mutant rice[J].Photosynthetica,2008,46(3):466-470.
[23]PANG T,LIU J,LIU Q,etal.Changes of photosynthetic behaviors inKappaphycusalvareziiinfected by epiphyte[J].Evidence-Based ComplementaryandAlternativeMedicine,2011,2011:ID 658906,7pages.
[24]HU Y H(胡一鸿),WANG M L(王梦龙),YUAN SH J(袁盛建),etal.Effects of glutaraldehyde stress on photosynthesis and antioxidase activity ofHydrillaverticillata[J].JournalofAgro-EnvironmentScience(农业环境科学学报),2013,32(6):1 143-1 149(in Chinese).
[25]XU Q J(许秋瑾),JIN X C(金相灿),WANG X M(王兴民),etal.Effects of different concentration ammonium-N onHydrillaverticillataantioxidant enzymes under Cd stress[J].ChineseJournalofAppliedEcology(应用生态学报),2007,18(2):420-424(in Chinese).
[26]XIONG Y F(熊远福),ZOU Y B(邹应斌),WEN ZH Y(文祝友),etal.Effects of rice seed-coating agent on seedling growth,enzyme activities and internal hormones of rice[J].ScientiaAgriculturaSinica(中国农业科学),2004,37(11):1 611-1 615(in Chinese).
[27]HU Y L(胡延玲),ZHANG CH H(张春华),JU T(居 婷),etal.Differential responses of GSH and GST in two rice cultivars under Cd stress[J].JournalofAgro-environmentScience(农业环境科学学报),2009,28(2):305-310(in Chinese).
[28]LIU H ZH(刘怀珍),HUANG Q(黄 庆),LU X M(陆秀明),etal.Effect of seed coating agent on shoot morphologic and its physiological characteristics in rice[J].JournalofHenanAgriculturalSciences(河南农业科学),2004,(12):19-21(in Chinese).
[29]WANG H Y(王宏燕),LIU SH Y(刘书宇),ZHAO F H(赵福华).The effect of biological seed coating agent on the growth,photosynthesis and enzyme of soybean[J].JournalofNortheastAgriculturalUniversity(东 北 农 业 大 学 学 报),2002,33(2):111-115(in Chinese).
[30]FENG X M(冯绪猛),LUO SH SH(罗时石),HU J W(胡建伟),etal.Effect of pesticides on MDA and chlorophyll content of rice leaves[J].ActaAgriculturaeNucleataeSinica(核农学报),2006,17(6):481-484(in Chinese).
[31]ZHANG SH R(张守仁).A discussion on chlorophyll fluorescence kinetics parameters and their significance[J].ChineseBulletinofBotany(植物学通报),1999,16(4):444-448(in Chinese).
[32]XU H X(徐红霞),WENG X Y(翁晓燕),MAO W H(毛伟华),etal.Effects of cadmium stress on photosynthesis,chlorophyll fluorescence characteristics and excitation energy distribution in leaves of rice[J].ChineseJournalofRiceScience(中国水稻科学),2005,19(4):338-342(in Chinese).
.[33]ZHANG J P(张建平),CHEN J(陈 娟),HU Y H(胡一鸿),etal.Effects of cadmium stress on photosynthetic function of leaves ofLemnaminorL.[J].JournalofAgro-EnvironmentScience(农业环境科学学报),2007,26(6):2 027-2 032(in Chinese).
[34]DU Y D(杜尧东),LI J L(李键陵),WANG H(王 华),etal.Effects of high temperature stress on the flag leaf photosynthesis and chlorophyll fluorescence parameters of rice[J].ChineseJournalofEcology(生态学杂志),2012,31(10):2 541-2 548(in Chinese).
