硝酸镧和兰科菌根真菌对铁皮石斛生理特性的影响
2015-07-04杨超英柴瑞娟
魏 明,杨超英,孔 芳,柴瑞娟
(安徽工程大学 生物与化学工程学院,安徽芜湖241000)
兰科菌根(orchid mycorrhizas,OM)是真菌与兰科植物形成的共生体,共生体双方互惠互利[1]。真菌菌丝体可侵入到兰科植物根系细胞内,菌丝体向外延伸到植物根系达不到的基质中,从基质中吸收营养成分,促进植物生长[2-3]。绝大多数兰科植物在生长发育过程中都能与相应真菌建立共生关系。
铁皮石斛(DendrobiumofficinaleKimura et Migo)为兰科石斛属植物,富含多糖和生物碱等活性成分,是珍稀药用植物[4]。铁皮石斛自然繁殖率低,加上人工大量采摘,野生铁皮石斛已濒临灭绝。随着植物组培技术的发展,铁皮石斛离体繁殖技术已基本成熟,可以实现工厂化育苗[5-6];但是组培苗移栽后的成活率较低,且生长缓慢,这和缺少与之共生的真菌有关。有益的真菌能促进兰科植物的生长发育[7]。菌根技术是目前国际上先进的一种真菌肥料技术,通过菌根技术能极大地提高植物的生长速度和抗逆性,促进植物次生代谢产物的合成[8]。如何提高石斛菌根共生体的形成效率是石斛菌根化栽培的重要问题。
稀土具有重要的生理功能,其可与细胞内的多糖、蛋白质和核酸等形成比较稳定的化合物,从而影响细胞的生理生化代谢过程,提高微生物的生物活性[9-10]。镧的化学性质很活泼且副作用小。研究表明,硝酸镧可促进盐胁迫下小麦幼苗的生长,提高其保护酶活性,降低膜脂过氧化产物含量,增强植物对环境的适应性[11]。硝酸镧、硝酸铈等能促进细茎石斛组培苗的生长,提高其生理活性[12]。但关于稀土和OM 菌根真菌的联合使用对石斛生理特性的影响鲜有报道。我们从野生的石斛中分离出有效菌根真菌,探讨稀土镧和菌根真菌联合使用对铁皮石斛生理特性的影响,以期为应用稀土和菌根技术提高药用石斛的栽培效率及其药用品质提供科学依据。
1 材料和方法
1.1 材料和试剂
铁皮石斛无菌苗由安徽工程大学组培基地提供,菌根真菌为本实验室从野生金钗石斛中分离的丝核菌(编号OM12),由本实验室保存。栽培培养基为树皮和碎石,营养液为MS培养基中的无机营养成分。所有化学试剂均为分析纯。
1.2 接种菌剂的制备和试验设计
将OM12 真菌接种在PDF 液体培养基中,28℃振荡培养4~6d,得到液体菌剂备用,菌体浓度约为2×106cfu·mL-1。试验菌根真菌处理设计接种OM 真菌(+M),接种体积为2 mL 和不接种OM 真菌(-M)两个水平,硝酸镧处理设置0、1.0、3.0、5.0和7.0mg·L-1等5个水平,组成10处理组合,每个组合处理重复3次。选生长一致的铁皮石斛组培苗(苗高3cm 左右)为原始试验材料,以盆栽的方式进行培养,培养基以树皮为主辅以小石子。栽种之前,培养基质进行灭菌处理,然后接种菌根真菌,以不接种菌根真菌作为对照(-M),然后分别添加设计浓度的硝酸镧进行培养,每20d添加1次营养液。培养时间从2013年4月至2013年9月,然后收获测定相关指标。
1.3 菌根侵染情况测定
每组随机抽取鲜根30条,参考Biermann等[13]描述的方法测定菌根的形成情况。将根段洗净除去杂质,用75%的乙醇擦拭表面,无菌水冲洗数次,于培养皿中用解剖刀将根切成2~4cm 长的段,然后放入10%的KOH 溶液中,121℃充分脱色20min,再用无菌水冲洗3次。将冲洗好的材料放入苯胺蓝溶液中染色4h(温度90℃),然后用无菌水冲洗,除去表面的染液,再在碱性双氧水中脱色8 min。最后调查菌根侵染率,脱色后根段中有蓝色部分即表明真菌已成功侵染。
菌根侵染率(%)=有菌根的根段数/根段总数×100%
1.4 测定指标及测定方法
将石斛鲜药取出培养基,按根和茎叶分开,分别称取根部和地上部分的质量。叶绿素含量采用丙酮酸混合液方法提取测定[14];丙二醛(MDA)含量用硫代巴比妥酸(TBA)比色法测定[14];可溶性蛋白质含量用考马斯亮蓝G-250染色法测定[14];多糖含量采用苯酚硫酸法[15]测定。
取1g样品加入20mL 磷酸盐缓冲液,在冰浴中研磨,离心后,上清液用于保护酶活性测定。超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性分别用SOD 和CAT 试剂盒测定,过氧化物酶(POD)活性用愈创木酚法测定,单位均为U·g-1[16]。
1.5 数据处理与统计分析
所有实验重复2次,每个水平重复3次,实验数据采用SAS软件进行统计分析,实验结果以平均值附标准差表示。
2 结果与分析
2.1 硝酸镧对铁皮石斛菌根侵染的影响
硝酸镧对铁皮石斛菌根的形成具有一定的促进作用(表1)。随着硝酸镧浓度的增加,铁皮石斛OM 真菌的侵染率也随之提高,并当硝酸镧浓度达到5.0mg·L-1时,侵染率达到最高(92.8%),继续增加硝酸镧浓度OM 真菌的侵染率反而显著降低,但仍显著高于未添加硝酸镧处理的侵染率(46.4%);由于栽培基质经过灭菌处理,所以,未接种的各处理均未发现OM 真菌侵染。由此可见,适当浓度的硝酸镧有利于OM 真菌的侵染和石斛菌根的发育,过量的硝酸镧会抑制石斛菌根的发育。
2.2 硝酸镧和OM 真菌对铁皮石斛生物量的影响
OM 真菌和硝酸镧对铁皮石斛生物量积累具有显著的促进作用,铁皮石斛组培苗接菌和硝酸镧处理后生长比对照组旺盛,苗色浓绿,产生新根多。由表1可知,随着硝酸镧浓度的增大,接种(+M)和未接种(-M)OM 真菌的铁皮石斛根重、茎叶重和总生物量均呈先增后降的趋势,尤其接种OM 真菌后,根重、茎叶重和总生物量均显著增加(P<0.05);当硝酸镧浓度为5.0 mg·L-1时,接种OM真菌(+M)的石斛根重、茎叶重和总生物量均达到最大,分别是未添加硝酸镧以及未接种对照组(-M)的4.26倍、4.98倍和4.87倍,同时也与该处理最高的菌根侵染率相对应。
2.3 硝酸镧和OM 真菌对铁皮石斛叶绿素含量的影响
叶绿素含量在一定程度上反映了植物光合性能强弱。从图1可以看出,随着硝酸镧浓度的增加,接种(+M)和未接种(-M)OM 真菌的铁皮石斛的叶绿素含量均呈现先增加后降低的变化趋势,并均在硝酸镧浓度为5.0mg·L-1时达到最高值,且与未添加硝酸镧处理相比均显著增加;在相同硝酸镧浓度下,接种OM 真菌处理(+M)始终高于未接种处理(-M)。可见,接种OM 真菌能显著促进铁皮石斛幼苗叶绿素含量提高,在接种OM 真菌同时再添加一定浓度的硝酸镧又能显著增强这种促进作用,并当硝酸镧浓度为5.0mg·L-1时效果最佳。
2.4 硝酸镧和OM 真菌对抗氧化酶活性和丙二醛含量的影响
CAT、POD 和SOD 是活性氧清除系统的重要抗氧化酶。由图2 可知,同一硝酸镧水平下,接种OM 真菌铁皮石斛植株细胞内CAT、POD 和SOD活性均高于未接种OM 真菌植株;铁皮石斛幼苗CAT、POD和SOD活性对不同浓度的硝酸镧处理的响应特征是不同的,在0~3mg·L-1之间,CAT(图2,A)和POD(图2,B)活性随硝酸镧浓度增加而上升,之后又下降;而在0~5mg·L-1之间,SOD的活性随硝酸镧浓度增加而上升,之后又下降(图2,C)。所以,在适量的硝酸镧浓度下接种OM 真菌能够提高铁皮石斛幼苗保护酶活性,增强石斛的抗逆性,促进石斛的生长。
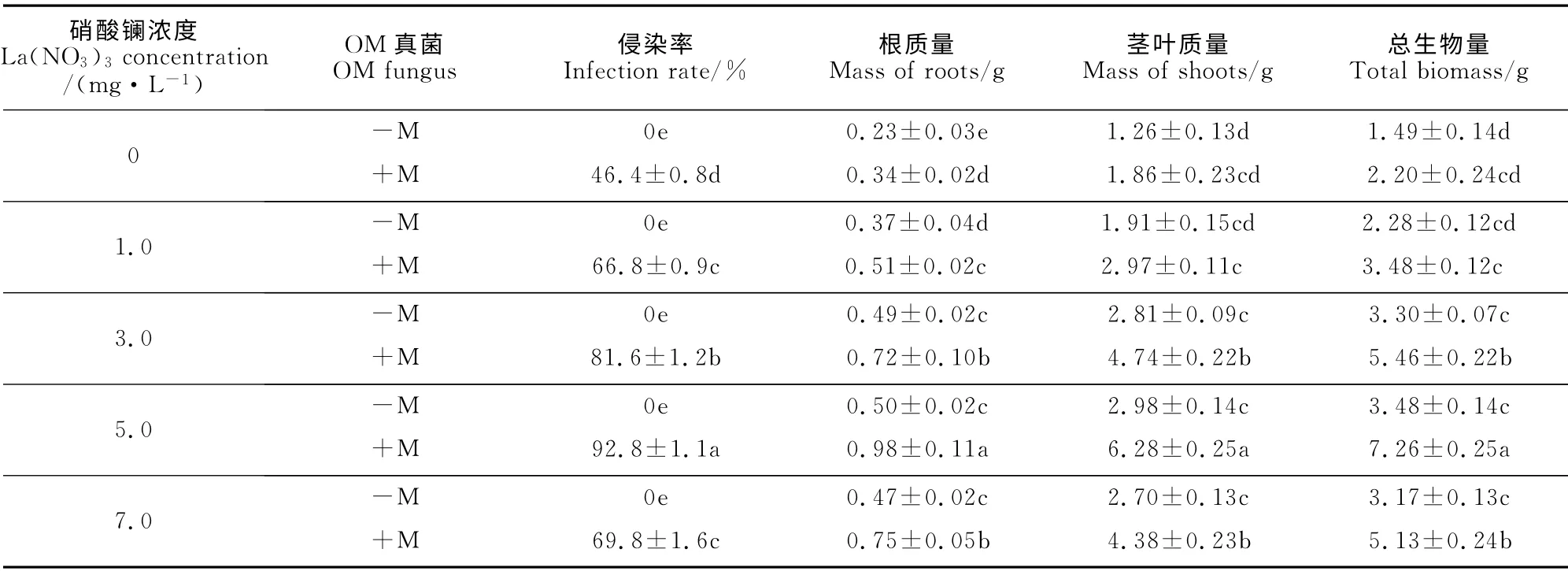
表1 硝酸镧和OM 真菌处理下铁皮石斛生物量Table 1 The biomass of D.officinale seedling with lanthanum nitrate and OM fungus treatments
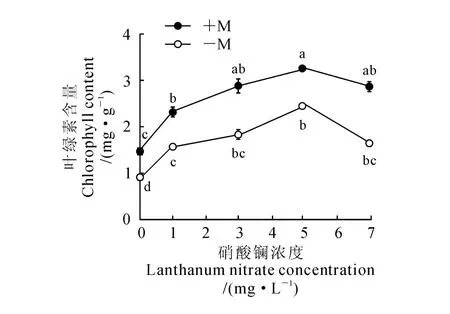
图1 硝酸镧和OM 真菌处理下铁皮石斛叶绿素含量变化Fig.1 The changes of chlorophyll content in D.officinale seedling with lanthanum nitrate and OM fungus treatments
丙二醛是膜脂过氧化的产物,其积累是活性氧毒害作用的体现,由图2,D可知,随着硝酸镧浓度的增加,接种(+M)和未接种(-M)OM 真菌的铁皮石斛的丙二醛含量均呈现先降低后上升的变化趋势,并均在硝酸镧浓度为5.0mg·L-1时达到最低值,且与未添加硝酸镧处理相比显著降低;在相同的硝酸镧浓度下,接种OM 真菌处理(+M)始终低于未接种处理(-M)。可见,接种OM 真菌能显著降低丙二醛含量,在接种OM 真菌同时再添加5.0 mg·L-1的硝酸镧效果最佳。接种OM 真菌和使用适当浓度的硝酸镧降低了细胞膜脂过氧化程度,有助于膜系统的稳定性,从而提高了细胞的生理活性,促进铁皮石斛的生长。
2.5 硝酸镧和OM 真菌对多糖和可溶性蛋白含量的影响
多糖和蛋白质是细胞的基础代谢产物,细胞内多糖和蛋白质含量体现了细胞的基础代谢水平。由图3可知,随着硝酸镧浓度的增加,接种(+M)和未接种(-M)OM 真菌的铁皮石斛多糖和蛋白质含量均呈现先增加后降低的变化趋势,并均在硝酸镧浓度为5.0mg·L-1时达到最高值,且与未添加硝酸镧相比显著增加;在相同硝酸镧浓度下,接种OM真菌处理(+M)始终高于未接种处理(-M)。可见,接种OM 真菌能显著促进铁皮石斛多糖和蛋白质的合成,在接种OM 真菌同时再添加一定浓度的硝酸镧又能显著增强这种促进作用,并当硝酸镧浓度为5.0mg·L-1时效果最好。
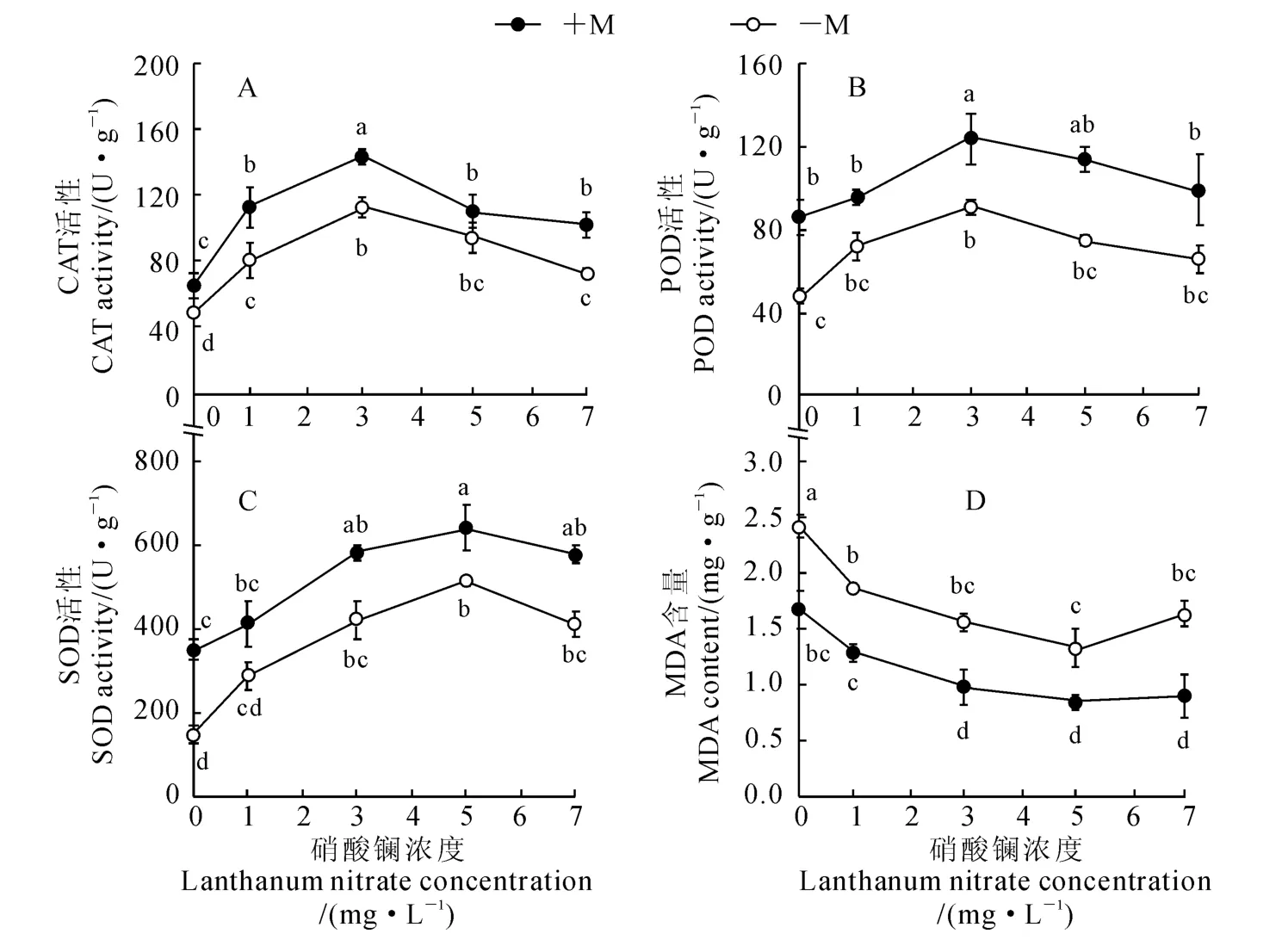
图2 硝酸镧和OM 真菌处理下铁皮石斛CAT、POD、SOD 活性和MDA 含量变化Fig.2 The changes of CAT,POD and SOD activities and MDA content in D.officinale seedling with lanthanum nitrate and OM fungus treatments
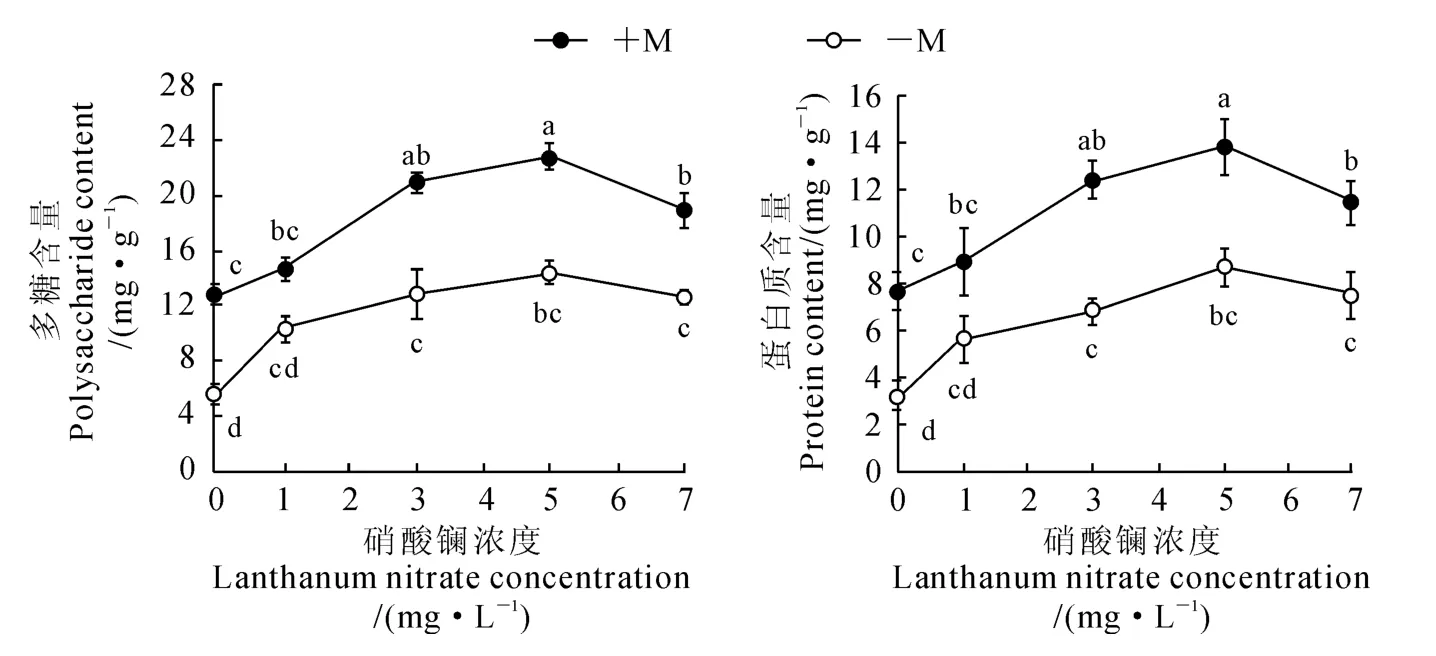
图3 硝酸镧和OM 真菌处理下铁皮石斛多糖和蛋白质含量变化Fig.3 The changes of polysaccharide and protein contents in D.officinale seedling with lanthanum nitrate and OM fungus treatments
3 讨 论
真菌成功浸染是产生菌根效应的基础,石斛菌根的形成与其根际微生物有关,适宜的根际微生态环境有利于菌根的形成,如土壤中施氮量能显著影响AM 菌根的形成[17]。菌根真菌对宿主细胞的侵染与菌根真菌的生理活性有关[18]。稀土元素具有重要的生理功能,可以提高微生物的活性[19],促进石斛菌根的形成。本研究表明,稀土镧不仅能促进铁皮石斛的生长,也能提高根际微生物活性;添加适量的硝酸镧能促进接种OM 真菌对石斛根系的侵染能力,有利于铁皮石斛菌根的形成,从而使铁皮石斛生长比较旺盛,苗色浓绿,产生新根多,生物量明显高于对照组。接种OM 真菌提高了石斛的生长量,可能是菌根的形成扩大了石斛根系的吸收范围,从而使石斛能吸收更多的营养以供生长。同时,叶绿素是植物光合作用的基础色素[20],植物通过叶绿素对光能的吸收、传递和转化来进行光合作用。石斛菌根的形成提高了石斛叶片的叶绿素含量,改变了植物的生长特性,这也可能是接种OM 真菌提高石斛生长量的原因之一。另外,糖和蛋白质是生命的物质基础,细胞内糖类和蛋白质的含量体现了细胞的生理活性,可溶性蛋白质含量的提高能增强植物的光合能力。菌根的形成有助于碳代谢,提高细胞生理活性和植物适应能力[21]。本研究发现,接种OM 真菌同时添加硝酸镧提高了细胞内多糖和蛋白质含量,促进了铁皮石斛中物质的积累,这是石斛植株生物量增加的另一个因素。
植物的抗逆性与防御系统活性密切相关,硝酸镧和OM 真菌能提高细胞生理活性,细胞代谢旺盛,而它们的联合使用效果更显著。有氧呼吸产生了大量的活性氧,加速了氧化胁迫。植物体内存在SOD、CAT 和POD 等活性氧清除酶系统,这些酶协同作用使活性氧产生和清除处于平衡状态,以维持植物的正常生理代谢[22]。同时,POD 是多功能酶,对植物生长还具有调节作用。MDA 是细胞膜脂过氧化的主要产物之一,其含量高低可以反映植物遭受逆境伤害程度。大量活性氧的产生加速了氧化胁迫,促进了细胞膜脂过氧化反应,产生大量MDA。MDA 的积累与保护酶的活性有一定的相关性,保护酶活性的提高有利于降低MDA 的含量。本研究中,适量的硝酸镧和OM 真菌均能提高细胞内保护酶的活性,降低MDA 的含量,二者的变化呈现一定的相关性;在同一硝酸镧水平下,接种OM 真菌的植株细胞内的SOD、CAT 和POD 活性均高于未接种处理,可见,接种OM 真菌再添加适量的硝酸镧效果更佳。适量的硝酸镧和OM 真菌的联合使用能有效防止植株衰老,提高植株的抗逆性和适应性,促进铁皮石斛的生长。
总之,添加适量的硝酸镧和接种OM 真菌能明显改善铁皮石斛生理特性,适量的硝酸镧能促进铁皮石斛菌根的形成,进而提高铁皮石斛的叶绿素含量、可溶性蛋白质含量以及保护酶活性,降低MDA含量,增强了铁皮石斛对环境的适应能力,提高铁皮石斛生物量和多糖等活性成分的积累。本研究结果为今后进一步开展石斛菌根化栽培和稀土菌肥的开发提供了理论依据。
[1]CHEN J(陈 娟),ZHANG L CH(张丽春),XING Y M(邢咏梅),etal.Advances in research on mycorrhizal symbiosis ofDendrobiumorchidaceae[J].Chin.Pharm.J.(中国药学杂志),2013,48(19):1 644-1 648(in Chinese).
[2]XU L J(徐丽娟),DIAO ZH K(刁志凯),LI Y(李 岩),etal.Eco-physiological functions of mycorrhizal fungi[J].ChineseJournalofAppliedEcology(应用生态学报),2012,23(1):285-292(in Chinese).
[3]BONFANTE P,GENRE A.Plants and arbuscular mycorrhizal fungi:An evolutionary developmental perspective[J].TrendsinPlant Sci.,2008,13(9):492-498.
[4]CHEN X M(陈 晓 梅),GUO SH X(郭 顺 星).Advances in the research of constituents and pharmacology ofDendrobium[J].Natural ProductResearchandDevelopment(天然产物研究与开发),2001,13(1):70-74(in Chinese).
[5]XU X R(徐雪荣),YAO Q SH(姚全胜),LEI X T(雷新涛),etal.Development and application of efficient regeneration system forDendrobiumofficinale[J].ChineseJournalofTropicalAgriculture(热带农业科学),2009,29(10):41-44(in Chinese).
[6]WEI M,WEI S H,YANG C Y.Effect of putrescine on the conversion of protocorm-like bodies ofDendrobiumofficinaleto shoots[J].PlantCellTiss.OrganCult.,2010,102(2):145-151.
[7]ZHENG W(郑 伟),ZHANG Y W(张云伟),CHEN L Q(陈龙清).Research advances of mycorrhiza inDendrobium[J].HubeiAgriculturalSciences(湖北农业科学),2010,49(9):2 279-2 282(in Chinese).
[8]JIN H(金 辉),XU ZH X(徐忠祥),CHEN J H(陈金花),etal.Interaction between tissue-cultured seedlingsDendrobiumofficinaleand mycorrhizal fungus(Epulorhizasp.)during symbiotic culture[J].ChineseJournalofPlantEcology(植物生态学报),2009,33(3):433-441(in Chinese).
[9]YAO Y L(姚艳丽),ZHANG X M(张秀梅),LIU ZH H(刘忠华),etal.Effects of lanthanum nitride and cerium nitrate on Pineapple yield and quality and antioxidant enzyme system[J].ChineseJournalofTropicalCrops(热带作物学报),2010,31(8):1 372-1 376(in Chinese).
[10]CHEN X P(陈小攀),FENG X J(冯秀娟),SUN F(孙 峰).Effect of yttrium on activity microbes in soil[J].EnvironmentalScience&Technology(环境科学与技术),2013,36(8):41-45(in Chinese).
[11]SHI D P(史东平),YANG X(杨 笑),ZHANG Y Q(张永清).Effects of lanthanum on the growth and physiological characteristic of wheat seeding under salt stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2008,28(4):730-736(in Chinese).
[12]DUAN X Y(段晓宇),WANG W Q(汪维权),YANG H(杨 红),etal.Effect of La(NO3)3and Ce(NO3)3on the growth ofDendrobium moniliformeplantletsinvitro[J].JournalofSichuanAgriculturalUniversity(四 川 农 业 大 学 学 报),2012,30(2):186-189(in Chinese).
[13]BIERMANN B,LINDERMAN R G.Quantifying vesicular-arbuscular mycorrhizae:aproposed method towards standardization[J].New Phyto.,1981,87(1):63-67.
[14]李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,1999.
[15]WEI M,JIANG ST,LUO J P.Enhancement of growth and polysaccharide production in suspension cultures of protocorm-like bodies fromDendrobiumhuoshanenseby the addition of putrescine[J].Biotechnol.Lett.,2007,29(3):495-499.
[16]WEI M(魏 明),YANG CH Y(杨超英),JIANG SH T(姜绍通).Effect of ultrasonic on the physiological metabolism of cells in suspension cultures of protocorm-like bodies ofDendrobiumhuoshanense[J].PlantPhysiologyJournal(植物生理学报),2011,47(6):619-624(in Chinese).
[17]ZHAO Q H(赵青华),SUN L T(孙立涛),WANG Y(王 玉),etal.Effects of arbuscular mycorrhizal fungi and nitrogen on plant growth,nutrient uptake and tea quality inCamelliasinensis(L.)O.Kuntze[J].PlantPhysiologyJournal(植 物 生 理 学报),2014,50(2):164-170(in Chinese).
[18]LABIDI S,CALONNE M,JEDDI FB,etal.Calcareous impact on arbuscular mycorrhizal fungus development and on lipid peroxidation in monoxenic roots[J].Phytochemistry,2011,72(18):2 335-2 341.
[19]YANG R L(杨荣玲),CHEN W D(陈卫东),WU X Y(吴晓玉),etal.Progress on effect of rare earth on growth,mechanism and application of microorganism[J].JournaloftheChineseRareEarthSociety(中国稀土学报),2005,23(12):110-115(in Chinese).
[20]XU B CH(徐博超),ZHOU ZH Q(周志强),LI W(李 威),etal.Physiological and photosynthetic response to different water conditions ofTaxuscuspidateseedlings[J].JournalofBeijingForestryUniversity(北京林业大学学报),2012,34(4):73-78(in Chinese).
[21]GOICOECHEA N,MERINO S,SÁNCHEZ-D'LAZ M.Arbuscular mycorrhizal fungi can contribute to maintain antioxidant and carbon metabolism in nodules ofAnthylliscytisoidesL.subjected to drought[J].J.PlantPhysiol.,2005,162(1):27-35.
[22]HE X L(贺学礼),ZHAO L L(赵丽莉),LI Y P(李英鹏).Effects of AM fungi on the growth and protective enzymes of cotton under NaCl stress[J].ActaEcologicaSinica(生态学报),2005,25(1):188-193(in Chinese).
