干旱胁迫及复水对香樟幼树生理特性及生长的影响
2015-07-04胡庭兴
胡 义,胡庭兴*,陈 洪,王 彬,李 晗
(1 四川农业大学 林学院,四川雅安625014;2 四川农业大学 生态林业研究所,成都611130)
当今,全球干旱和半干旱地区的面积占陆地总面积的1/3。干旱胁迫是干旱与半干旱地区限制植物生长的最重要因子[1]。随着全球气候与环境的变化,加之降水季节和地域分布极不均匀,水资源短缺日趋明显,土壤有效含水量逐年减少[2]。土壤水分缺乏不仅抑制作物生长,还降低养分吸收,影响土壤养分的有效性,从而限制植物的生长及降低其产量和品质[3]。长江中上游地区在春季和秋季常出现季节性干旱,而在此时正是林木植苗的季节,因此研究树木幼树在干旱条件下的生长状态以及对短期严重缺水的响应,对于正确选择耐旱树种、科学制定苗期水分管理措施、确保造林成功具有重要意义。
干旱胁迫对植物的影响非常广泛,可以表现在生长发育的各个阶段,又可以表现在植物生长、蒸腾作用、光合作用、物质的合成与运输、酶活性等具体的生理代谢过程中[4]。受到干旱胁迫后,植物体活性氧增加、细胞渗透调节物质变化、个体及群体光合作用受到抑制,最终植物个体或群体生长受到抑制,形态结构发生变化[5]。Fridovich 提出生物自由基伤害学说[6],认为植物体内自由基的大量生产会引发膜脂过氧化作用,造成细胞膜系统破坏,严重时导致植物细胞死亡。植物在长期进化中形成了相应的抗氧化保护酶系统,如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等,可以协调有效地清除、H2O2等。目前已有众多的报道,如大丽花(Dahliapinnata)[7]、甘 草(Glycyrrhiza uralensis)[8]、沙 棘(Hippophaerhamnoides)[9]等保护酶活性和植物体抗旱能力有一定的关系。然而,不同植物在受到干旱胁迫后,其抗氧化酶活性变化存在差异。通过抗性生理指标并结合生长指标的方式分析植物体对干旱胁迫及复水的响应机理,对于深入了解植物的抗旱生理机制、科学合理地制定苗期抗旱对策具有重要的理论和现实意义。
香樟(Cinnamomumcamphora)属樟科(Laura-ceae)樟属(Cinnamomum),常绿乔木,是亚热带常绿阔叶林中重要的组成树种,具有芳香特性,是常用的城市行道树[10],也是南方各省区主要的造林树种,以及四旁植树和园林绿化的重要树种[11]。以往对于香樟的研究主要侧重于苗木培育、栽培技术等[12],关于香樟幼树对干旱环境耐受能力的研究则相对较少。本研究通过对香樟幼树进行不同持续时间的连续干旱胁迫,探讨不同土壤水分状态对香樟幼树生理特性与生长的影响,旨在为香樟育苗、造林并进行合理水分管理提供理论依据和技术参考。
1 材料和方法
1.1 供试材料
香樟种子采于四川泸州。将种子与河沙按1∶4的比例沙藏,用于春季播种。采用上口径30cm、底面直径25cm、高27cm 的黑色聚丙烯塑料盆作为移栽容器,选择四川盆地常见农耕土作为栽植基质,田间持水量为24%(用土壤体积含水量(SWC)表示),主要理化性质为:质地中壤,有机质23.74g·kg-1,pH 6.14,全氮1.53g·kg-1,铵态氮1.75mg·kg-1,全磷1.34g·kg-1,全钾27.12g·kg-1。
2012年5月,每盆装10kg土并将幼苗移栽于盆内,每盆3株。常规水分管理,土壤体积含水量控制在20%左右。6个月后每盆保留健壮苗1株。
1.2 试验设计
试验于2013年8月在四川农业大学教学科研园区塑料大棚中进行,海拔580 m。该地区属亚热带湿润气候,年均温16.2℃,≥10℃的积温5 231℃,年均日照时数1 039.6h,年均降水量1 774.3 mm,空气平均湿度79%。
采用单因素试验设计。待苗高长至160cm 左右时(8月1日)开始进行干旱胁迫,试验设置9个水分处理,每处理设置3个重复,以2d为一个处理期,分别持续干旱0d(正常供水)、2d、4d、6d、8d、10d、12d、14d和16d。干旱处理的具体操作方法是:从2013年8月2日开始对第1个处理(干旱16 d)停止浇水,其余8个处理正常浇水并进入下一处理期;2d后对第2个处理(干旱14d)停止浇水,剩下的7个处理正常浇水并进入下一处理期;……;依次类推完成所有处理;到2013年8月18日所有处理结束,至此形成从第1个处理至第9个处理不同土壤含水量梯度系列。各处理相应记作D0(正常供水)、D2、D4、D6、D8、D10、D12、D14、D16。为了便于分析,根据胁迫结束时的土壤体积含水量(SWC)将9个水分处理分为4 个土壤水分等级,即:正常供水(D0,SWC>17%)、轻度干旱(D2、D4,SWC 在10%~15%)、中度干旱(D6、D8,SWC 在6%~10%)和重度干旱(D10、D12、D14、D16,SWC<6%)。
胁迫结束时,立即测定9个水分处理的土壤体积含水量,之后分别采取各处理植株鲜叶样品测定叶片相对含水量和抗性生理指标。采样完成后立即复水,复水48h后再次采取鲜叶样测定抗性生理指标。干旱胁迫开始和结束时分别测定各处理株高和地径,计算各处理胁迫期间株高和地径净生长量。
1.3 测定项目及方法
1.3.1 土壤含水量 干旱胁迫结束次日,采用HH2土壤水分速测仪(ML2x,GBR,England)测定各处理盆中土壤体积含水量(SWC)。
1.3.2 生长指标 树高和地径分别用直尺和电子游标卡尺测量,5次重复。生长量计算公式为:
树高生长量(Zh)=干旱胁迫结束时树高-干旱胁迫开始时树高
地径生长量(Zd)=干旱胁迫结束时地径-干旱胁迫开始时地径
1.3.3 生理指标 在干旱结束当天,选取各处理植株中部成熟叶片,用于叶片水分状况和抗性生理相关指标的测定。其中,叶片相对含水量(LRWC)采用饱和称量法测定[13];超氧阴离子自由基()含量采用羟基-萘胺比色法测定[14];过氧化氢(H2O2)含量采用Ti(Ⅳ)-H2O2比色法测定[15];超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性分别采用氮蓝四唑光化还原法(以抑制NBT 光化还原的50%为1个酶活性单位U)、愈创木酚法(将每分钟OD 增加0.01定义为1个酶活单位U)、紫外分光光度法测定(以1min内OD 减少0.1为1个酶活单位U)[13];丙二醛(MDA)和可溶性糖(SS)含量采用硫代巴比妥酸法测定[13];游离脯氨酸(Pro)含量采用茚三酮比色法测定[13];可溶性蛋白(SP)含量采用紫外分光光度法测定[16]。
1.4 数据处理
用SPSS 16.0软件(SPSS Inc.,USA)进行Pearson相关分析、单因素方差分析(One-way ANOVA),用最小显著差数法(LSD法)进行多重比较。
2 结果与分析
2.1 干旱胁迫对土壤体积含水量和叶片相对含水量的影响
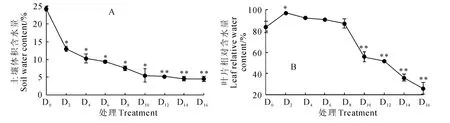
图1 干旱胁迫下香樟幼树土壤体积含水量和叶片相对含水量的动态变化Fig.1 The soil water content and leaf relative water content of C.camphorasaplings under continuous drought stress
由图1看出,随着停水时间的延长,干旱胁迫程度的加重,土壤体积含水量(SWC)表现为逐渐显著下降的趋势,而叶片相对含水量(LRWC)则先上升后下降。其中,土壤SWC 在正常供水处理(D0)下约为24%左右,停水2d后(D2)就大幅度下降到13%左右,而停水6d后(D6)就下降到9%左右,随后持续缓慢降低,并在停水10d后维持在相对稳定的较低水平(图1,A)。同时,香樟幼树叶片相对含水量(LRWC)在轻度干旱(D2、D4)时比对照(D0)上升了9.75%~15.73%,此后逐渐下降,但在中度干旱胁迫(D6、D8)时与对照(D0)无显著差异,而在重度干旱胁迫(D10~D16)时比对照显著下降(图1,B)。这表明停水处理造成了不同程度的土壤干旱环境,香樟叶片具有较强的保水能力,在轻度和中度干旱时可能通过提高水分利用效率和减少水分散失而使叶片相对含水量维持在较高水平。
2.2 干旱胁迫对香樟叶片中超氧自由基和过氧化氢含量的影响
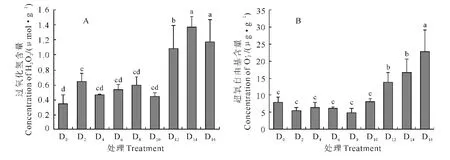
图2 干旱胁迫下香樟幼树叶片过氧化氢和超氧自由基含量的变化Fig.2 Contents of H2O2and O-·2 in leaves of C.camphorasaplings under continuous drought stress
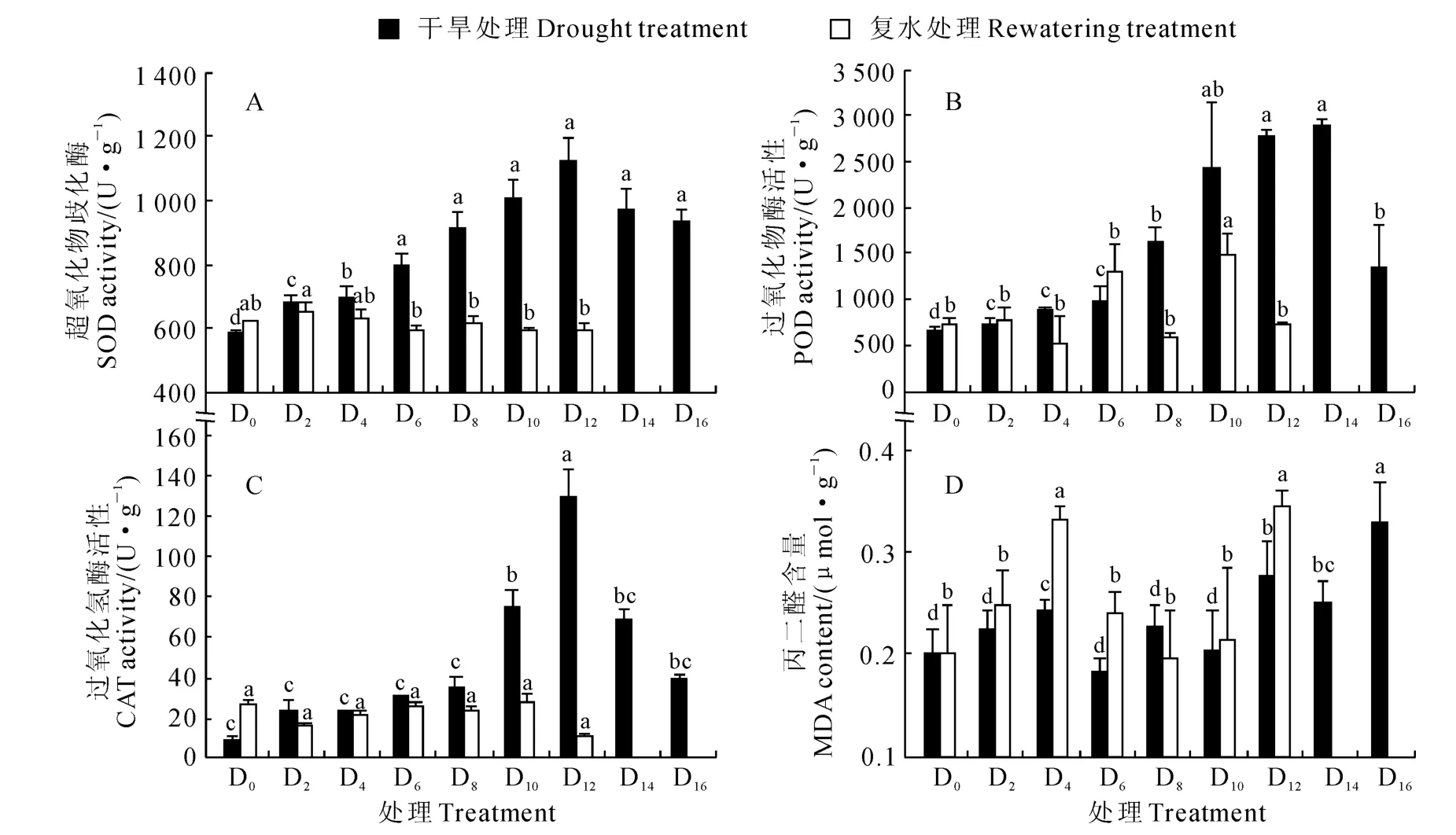
图3 干旱胁迫及复水对香樟幼树叶片超氧化物歧化酶、过氧化物酶和过氧化氢酶活性和MDA 含量的影响Fig.3 Activities of SOD,POD and CAT and MDA content in leaves of C.camphora saplings under continuous drought stress and then rewatering
2.3 干旱胁迫及复水对香樟叶片抗氧化酶活性和MDA含量的影响
干旱胁迫对香樟叶片保护酶系统的SOD、POD、CAT 活性均有显著影响(图3)。首先,香樟幼树叶片超氧化物歧化酶(SOD)活性在各干旱胁迫处理下均得到显著促进,并随着胁迫时间延长和胁迫强度加剧呈现先升高后降低的变化趋势,并在D12处理下达到最大值,之后因幼树植株已经枯萎(D14与D16),叶片SOD 活性有所下降;总体上中度、重度干旱胁迫植株显著高于轻度干旱胁迫,而中、重度干旱胁迫处理间(D6~D16)无显著差异。复水48 h后,D4~D12处理植株叶片SOD 活性恢复到对照水平(无显著差异),但D14和D16处理植株已经干枯,无法测定SOD 活性(图3,A)。
其次,干旱胁迫也显著促进了香樟幼树叶片过氧化物酶(POD)活性,其活性随干旱胁迫强度的变化趋势与SOD 类似,且所有干旱处理均较对照显著上升(图3,B);POD 活性在轻度、中度干旱胁迫下持续升高,并在重度干旱的D14处理下达到最高值,然后显著降低。在复水48h后,香樟幼树叶片POD活性除D14与D16处理无法恢复外,其余处理都基本恢复到正常对照水平。
另外,香樟幼树叶片过氧化氢酶(CAT)活性随干旱胁迫程度加剧的变化趋势总体上与其SOD 和POD 活性相同(图3,C),其仅在D10处理开始显著上升,到D12处理达到峰值,之后显著降低;重度干旱处理均显著高于对照和轻度、中度干旱处理,而轻度、中度干旱处理与对照差异不显著。复水48h后,香樟幼树叶片CAT 活性除D14与D16植株干枯外,其余处理均与对照显著不差异,即基本恢复到正常对照水平。
同时,香樟幼树叶片MDA 含量总体上表现为随着干旱时间的增加而上升趋势,并于D16处理时达到最高(图3,D)。除D4处理外,轻度、中度干旱处理叶片MDA 含量均与对照差异不显著,而重度干旱胁迫下MDA 含量显著上升。复水48h后,除D14和D16植株已干枯无法测定外,其余处理MDA含量仍然保持在复水前的水平,尤其是D4、D12处理的MDA 含量仍显著高于对照D0,且含量也高于复水前。这可能是因为丙二醛是干旱胁迫下膜脂过氧化的一种产物,即使在复水后植株叶片内仍然保持着较高的含量,且在短期内还难以消除;同时干旱胁迫所导致的叶片膜脂过氧化伤害也需要一个恢复过程。
以上结果说明香樟幼树在轻度、中度干旱胁迫下能通过自身抗氧化酶系统避免膜质伤害,重度干旱下细胞膜质受损且短期内难以恢复。
2.4 干旱胁迫及复水对香樟叶片渗透调节物质含量的影响
由图4可见,干旱胁迫条件下香樟幼树叶片中脯氨酸(Pro)、可溶性糖(SS)和可溶性蛋白(SP)含量均发生了显著变化。其中,香樟幼树叶片Pro含量在轻度、中度干旱时与对照无差异,于D8处理开始显著快速持续上升,并在重度干旱的D16处理达到峰值;在复水48h 后,重度干旱处理叶片的Pro含量比复水前显著降低,但仍明显高于对照(图4,A)。同时,同期香樟幼树叶片SS含量变化与Pro含量类似,即轻度干旱和中度干旱的D6处理(SWC>9%)与对照无显著差异,从D8处理开始较对照显著持续升高,并于D14处理达到峰值;复水48h后,叶片SS含量无显著变化(图4,B)。另外,随着干旱胁迫时间的延长,香樟幼树叶片SP 含量与其MDA 含量变化趋势相似,在轻度和中度干旱时处于不稳定状态,但总体上有轻微上升,到重度干旱时显著上升;复水48h后,各干旱处理叶片SP含量仍然处于较高的水平,并大多明显高于复水前,也明显高于相应对照(图4,C)。这表明受干旱胁迫香樟植株体内的渗透调节物质恢复到正常水平也需要一个较长的时间过程。
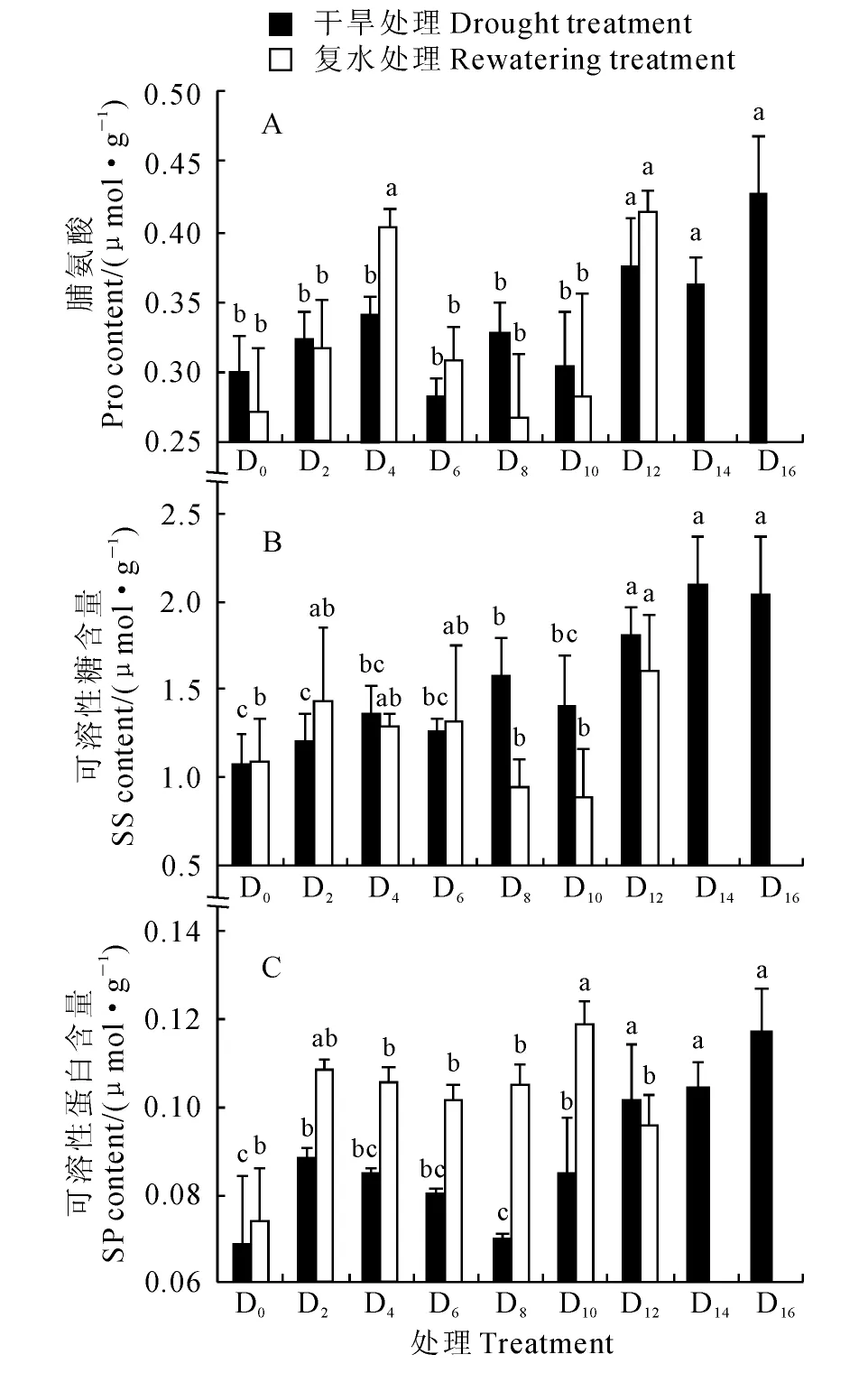
图4 干旱胁迫及复水对香樟叶片中脯氨酸、可溶性糖和可溶性蛋白含量的影响Fig.4 Contents of proline(Pro),soluble sugar(SS)and soluble protein(SP)in leaves of C.camphora saplings under continuous drought stress and then rewatering
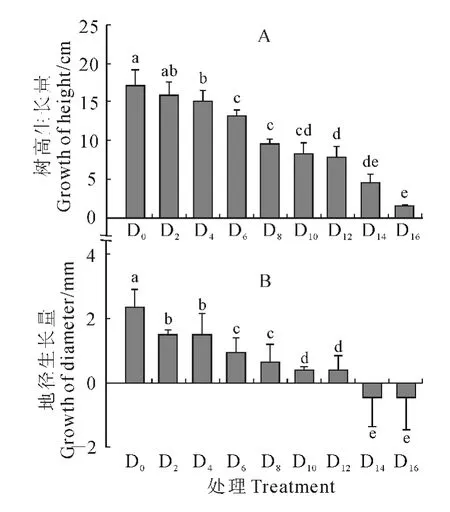
图5 干旱胁迫下香樟幼树树高和地径生长量的变化Fig.5 The net increment of plant height and ground diameter of C.camphora saplings under continuous drought stress
2.5 干旱胁迫对香樟幼树生长的影响
图5表明,干旱胁迫对香樟幼树的生长有显著的抑制作用,且树高生长量(Zh)和地径生长量(Zd)随着干旱胁迫时间延长呈类似的下降趋势。其中,植株Zh在除D2处理外的其他干旱处理(SWC<11%)下均较对照(D0)显著降低,而所有干旱处理的Zd均较D0显著降低。另外,重度干旱处理D14和D16的Zd为负值,同时叶片也出现了严重的卷缩现象。表明在干旱持续时间过长或土壤水分严重亏缺时,受胁迫植株失水过多已导致其茎杆干缩和叶片枯死。
3 讨论与结论
3.1 干旱胁迫及复水条件下香樟幼树叶片活性氧代谢特征
本研究中,香樟叶片相对含水量在轻度和中度干旱状态下高于对照,而在重度干旱时才迅速下降,说明香樟这种常绿树种具有一定的水分控制和适应能力,能够通过减少气孔开度等方式来维持其生理活动的正常进行(另文报道)。同时,香樟叶片ROS含量在干旱胁迫前期没有显著变化,H2O2含量显著升高后降低;同期酶促系统中的SOD 和POD 活性显著上升,CAT 则无显著变化。这表明在干旱胁迫初期(轻度干旱状态)植株已经产生ROS但迅速被清除,其中SOD 和POD 发挥了重要的作用;MDA 含量在此阶段表现为先上升后降低的趋势,表明虽然受胁迫产生的H2O2对植株造成了一定程度的伤害,但细胞膜脂过氧化程度能够维持在正常水平。到了干旱胁迫中期(中度干旱状态,土壤体积含水量SWC为6%~10%),植株ROS和H2O2含量均显著上升,MDA 含量也显著升高,表明随着干旱时间的延长,香樟体内ROS迅速积聚从而造成了氧化胁迫,细胞膜脂过氧化伤害加剧。而酶促系统在此阶段表现为SOD 活性无显著变化,POD、CAT活性达到最大,说明在中度干旱状态下ROS产生量超过了SOD 清除作用的阙值,同时清除过程中产生的H2O2诱导增强了POD 和CAT 活性,但仍难免受到明显的膜脂过氧化伤害。干旱后期(严重干旱状态,SWC<5%),植株体内ROS和H2O2以及MDA 含量持续升高,酶促系统中SOD 活性无显著变化,而POD 和CAT 活性降低,表明在严重的干旱胁迫下香樟幼树体内大量活性氧积累导致细胞膜质伤害加剧,叶片中酶活性也受到抑制。这与孙彩霞等[20]在玉米上的相关研究结果一致。另外,在复水48h后,本试验香樟植株叶片中防御酶活性基本恢复到对照水平,但MDA 含量仍然显著高于对照,表明干旱胁迫对叶片造成的膜脂过氧化伤害在短期内没有得到明显的恢复,而且膜脂过氧化产物含量仍然处于较高水平,这与张红萍等[21]对豌豆的干旱-复水研究结果类似。
3.2 干旱胁迫及复水条件下香樟幼树叶片渗透调节物质动态特征
渗透调节是指细胞通过增减溶质对渗透势进行调节的作用[22]。在水分胁迫下,植物体主要通过渗透调节来主动降低渗透势从而维持体内水分平衡和细胞间膨压基本不变[9]。相关研究表明,高含量的可溶性蛋白可使细胞维持较低的渗透势,抵抗干旱胁迫带来的伤害[9]。但也有研究报道,干旱胁迫抑制了蛋白质的合成并诱导蛋白质的降解,从而使植株体内的总蛋白质含量降低[23]。在本试验中,香樟幼树叶片中的可溶性蛋白含量随着干旱程度的加剧呈先增加后降低的趋势。说明在干旱胁迫初期植物体内的不溶性蛋白转变成可溶性蛋白以增强渗透调节能力,而在干旱后期胁迫已超过植物忍耐的阈值,其体内的蛋白质合成代谢受阻,蛋白降解,这与刘红云等对杜仲(Eucommiaulmoides)幼苗进行干旱胁迫的结果相吻合[24]。另外,在复水48h后,除重度干旱胁迫(SWC<5%,干旱时间>12d)外,香樟叶片可溶性蛋白含量均较复水前显著升高,说明在干旱胁迫结束初期植物体内继续将不溶性蛋白转变为可溶性蛋白以增强渗透调节能力,而对于重度干旱的香樟幼树复水后短期内可溶性蛋白含量没有显著变化,这可能与蛋白的降解有关。
可溶性糖主要在胁迫的中、后期才开始积累,与其他渗透调节物质相比表现出一定的滞后性,但糖的物理化学性质决定了它的渗透调节能力高于其他渗透调节物质[25]。本实验中香樟叶片可溶性糖含量在轻度干旱状态下(SWC>7%,干旱时间>2d)变化不大,而在中度和重度干旱(SWC<8%,干旱时间>8d)状态下则迅速升高,表明在长时间土壤水分亏缺状态下,可溶性糖在渗透调节中起到了主要的作用。同时,在复水后较短时间内,叶片可溶性糖含量除重度干旱胁迫(SWC<5%,干旱时间>12 d)外,其余处理均降低到对照水平,表明复水对香樟植株体内的水分生理具明显的恢复作用,其糖代谢较容易恢复到正常水平。
植物体内游离脯氨酸的积累现象是最初由Kemble等在受到干旱胁迫的黑麦草(Loliumperenne)叶片中发现的[26]。大量研究也表明,干旱胁迫会导致植物体内脯氨酸明显积累[27-28]。本试验结果发现,香樟叶片中脯氨酸含量随土壤水分含量的降低而升高,且积累量与胁迫时间和胁迫程度有关。在轻度干旱时脯氨酸含量与对照无显著差异,从中度干旱的D8处理(SWC=7.53%,干旱时间>8d)开始迅速升高,这与张殿忠[29]和张红萍[21]等的研究结果一致。在复水48h后,香樟幼苗叶片游离脯氨酸含量则显著减少。结合上述3种渗透调节物质含量在干旱-复水状态下变化规律可以看出,干旱胁迫下香樟幼树叶片内可溶性蛋白、可溶性糖和脯氨酸的含量均显著上升,以维持较强的渗透调节能力;而复水初期,香樟幼树主要通过升高可溶性蛋白的含量来维持较强的渗透调节能力,以避免干旱的伤害。
3.3 香樟幼树对干旱胁迫的生长响应特征
现有研究表明,干旱胁迫影响植物各种生理代谢过程,如光合作用、呼吸作用、水分代谢和营养物质的吸收运转、各种酶的活性和有机物质的转化、运输、积累等[30-32]。本研究中,中度、重度干旱胁迫(SWC<10%,干旱时间>6d)下香樟幼树叶片中H2O2和MDA 积累显著增加,表明干旱对膜系统造成伤害,导致细胞生理活动和物质运输发生紊乱,从而影响香樟幼树的生长。同时在本研究中干旱胁迫对香樟幼树的地径生长量和树高生长也产生了显著的抑制作用。轻度干旱胁迫(SWC<13%,干旱时间>2d)对香樟幼树的地径和树高生长就产生明显的抑制,重度的干旱胁迫(SWC<6%,干旱时间>14d)状态下地径出现负生长,原因是植株严重缺水导致茎杆韧皮部和木质部萎缩。
综上所述,香樟的酶促ROS清除系统是抵御干旱逆境胁迫的重要机制,并以SOD 反应最为灵敏,POD、CAT 在干旱胁迫中期作用最明显,在复水后酶活性也能在较短时间内恢复到正常水平。渗透调节物质中的可溶性蛋白较可溶性糖和脯氨酸反应更明显,但干旱的中后期可溶性糖及脯氨酸含量显著上升以维持水分平衡,复水后仍维持在较高水平。因此,在香樟人工林的水分管理中,对幼、中龄林应该制定合理的水分管理措施,在中度干旱状态下(土壤体积含水量低于10%时)应及时补充水分,较长时间的重度干旱(即土壤体积含水量低于7%且持续时间较长)会对幼树造成明显伤害并影响其生长。
[1]GAO Y(高 悦),ZHU Y ZH(朱永铸),YANG ZH M(杨志民),etal.Effects of drought stress and recovery on antioxidant enzyme activi-ties ofAgropyroncristatum[J].ActaAgrestiaSinica(草地学报),2012,20(2):336-341(in Chinese).
[2]MAESTRE F T,VALLADARES F,REYNOLDS J F.Is the change of plant-plant interactions with abiotic stress predictable A meta-analysis of field results in arid environments[J].JournalEcology,2005,(93):748-757.
[3]ZHANG L(张 丽),ZHANG X CH(张兴昌).Interactions of nitrogen with water and light in the growth of plant[J].AgriculturalResearchintheAridAreas(干旱地区农业研究),2003,21(1):43-46(in Chinese).
[4]孙侨南.干旱胁迫对黄瓜幼苗光合特性及活性氧代谢的影响[D].天津:天津大学,2008.
[5]QU T(曲 涛),NAN ZH B(南志标).Research progress on responses and mechanisms of crop and grass under drought stress[J].Acta AgrestiaSinica(草地学报),2008,17(2):126-135(in Chinese).
[6]FRIDOVICH I.Superoxide dismutase[J].Ann.Rev.Biochem.,1975,44:147-159.
[7]SHAO Y J(邵艳军),SHAN L(山 仑),LI G M(李广敏).Comparison of osmotic regulation and antoxidation between sorghum and maize seedlings under soil drought stress and water recovering conditions[J].ChineseJournalofEco-Agriculture(中国生态农业学报),2006,14(1):68-70(in Chinese).
[8]LI M(李 明),WANG G X(王根轩).Effects of drought stress on activity of cell defense enzymes and lipid peroxidation inGlycyrrhiza uralensisseedlings[J].ActaEcol.Sinica(生态学报),2002,22(4):503-507(in Chinese).
[9]HAN R L(韩蕊莲),LI L X(李丽霞),LIANG Z S(梁宗锁),Seabuckthorn relative membrane conductivity and osmotic adjustment under drought stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2003,23(1):23-27(in Chinese).
[10]QIN X(秦 霞).The main function ofCinnamomumcamphora[J].QuarterlyofForestby-ProductandSpecificinChina(中国林业副产品),2001,3:18(in Chinese).
[11]TIAN D L(田大伦),LUO Y(罗 勇),XIANG W H(项文化),etal.Photosynthetic characteristic ofCinnamomumcamphoraand its response to elevation of CO2and temperature[J].ScienceSilvaeSinica(林业科学),2004,40(5):88-92(in Chinese).
[12]GINDABA J,ROZANOV A,NEGASH L.Response of seedlings of two eucalyptus and three deciduous tree species fromEthiopiato severe water stress[J].ForestEcologyandManagement,2004,201(1):119-129.
[13]熊庆娥.植物生理实验教材[M].成都:四川科学技术出版社,2003.
[14]孙 群,胡景江.植物生理学研究技术[M].陕西杨凌:西北农林科技大学出版社,2006.
[15]LÜB(吕 波),LIU J(刘 俊),XU L L(徐朗莱).Study on three methods of determining contents of H2O2in wheat leaves[J].Journal ofNanjingAgriculturalUniversity(南京林业大学学报),2000,23(2):101-104(in Chinese).
[16]李合生.现代植物生理学[M].北京:高等教育出版社,2006.
[17]WEIR T L,PARKS W,VIVANCO J M.Biochemical and physiological mechanisms mediated by allelochemicals[J].CurrentOpinionin PlantBiology,2004,7(4):472-479.
[18]山 仑,陈培元.旱地农业生理生态基础[M].北京:科学出版社,1998.
[19]LIU B(刘 冰),LIANG CH J(梁婵娟).Recent advances of catalase in organism[J].ChineseAgriculturalScienceBulletin(中国农学通报),2005,21(5):223-224(in Chinese).
[20]SUN C X(孙彩霞),LIU ZH G(刘志刚).Effects of water stress on activity and isozyme of the major defense-enzyme in maize leaves[J].JournalofMaizeScience(玉米科学),2003,11(1):63-66(in Chinese).
[21]ZHANG H P(张红萍),NIU J J(牛俊义),XUAN CH X(轩春香),etal.Effects of drought stress and rewatering on content of proline and maldiadehyde in pea leaves[J].JournalofGansuAgriculturalUniversity(甘肃农业大学学报),2008,43(5):50-54(in Chinese).
[22]CUI ZH H(崔震海),ZHANG L J(张立军),FAN J J(樊金娟),etal.Studies on identify indices of water use efficiency of maize during seedlings stage with different water supply[J].JournalofMaizeScience(玉米科学),2007,15(5):76-78(in Chinese).
[23]BAI ZH Y(白志英),LI C D(李存东),LIU Y(刘 渊).Relationship between chromosome and changing of leaf proline and protein content under drought stress in wheat[J].JournalofPlantGeneticResources(植物遗传资源学报),2007,8(3):325-330(in Chinese).
[24]LIU H Y(刘红云),LIANG Z S(梁宗锁),LIU SH M(刘淑明),etal.Effect of progressive drying and rewatering on protective enzyme activities and osmoregulatory molecules in leaves ofEucommiaulmoidsseeding[J].JournalofNorthwestForestryUniversity(西北林学院学报),2007,22(3):55-59(in Chinese).
[25]YU T Q(于同泉),QIN L(秦 岭),CHEN J(陈 静),etal.The studies of a accumulation of solubility sugars and component in Chinese chest nut under drought stress[J].JournalofBeijingAgricultureCollege(北京农学院学报),1996,11(1):48-52(in Chinese).
[26]KEMBLE A R,MACPHERSON H T.Liberation of amino acids in perennial rye grass during wilting[J].BiochemicalJournal,1954,58(1):46-49.
[27]CUI X M(崔秀敏),WANG X F(王秀峰),XU H(许 衡).Response of physiological-biochemical characters of sweet pepper seedlings during different degree water stress to rewatering[J].ChineseAgriculturalScienceBulletin(中国农学通报),2005,21(5):225-229(in Chinese).
[28]李建武.水分胁迫对马铃薯生理生化特性的影响[D].兰州:甘肃农业大学,2005.
[29]ZHANG D ZH(张殿忠),WANG P H(汪沛洪),ZHAO H H(赵会贤).Determination of the content of free proline in wheat leaves[J].PlantPhysiologyCommunications(植物生理通讯),1990,(4):62-65(in Chinese).
[30]WANG F X(王付欣),CHEN Y F(陈耀锋),WANG H P(王惠萍),etal.Study on the effect of density of wheat anther culture[J].JournalofNorthwestA&FUniversity(Nat.Sci.Edi.)(西北农林科技大学学报·自然科学版),2001,29(1):41-43(in Chinese).
[31]SANG Z Y(桑子阳),MA L Y(马履一),CHEN F J(陈发菊).Growth and physiological characteristics ofMagnoliawufengensisseedings under drought stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2011,31(1):109-115(in Chinese).
[32]SUN C H(孙存华),LI Y(李 扬),HE H Y(贺鸿雁),etal.Physiological and biochemical responses ofChenopodiumalbumto drought stress[J].ActaEcol.Sin.(生态学报),2005,25(10):2 556-2 561(in Chinese).
