细胞因子诱导的杀伤细胞在肿瘤生物治疗中的应用进展
2015-07-01兰涛崔乃强
兰涛,崔乃强
(1沧州市人民医院,河北沧州061001;2天津市中西医结合急腹症研究所)
细胞因子诱导的杀伤细胞在肿瘤生物治疗中的应用进展
兰涛1,崔乃强2
(1沧州市人民医院,河北沧州061001;2天津市中西医结合急腹症研究所)
以自体细胞因子诱导的杀伤细胞(CIK细胞)为主体的肿瘤过继免疫治疗已逐渐成为一种重要的肿瘤生物治疗方法其制备方便,效果可靠。本文就其生物学特性、制备及应用方法、作用机制及临床应用效果作一综述。
肿瘤;细胞治疗;生物治疗;细胞因子诱导的杀伤细胞
细胞免疫治疗是一种新兴的、具有显著疗效的肿瘤治疗模式,它是运用生物技术和生物制剂分离、体外激活并回输患者自身或者同种异体的肿瘤特异性或者非特异性杀伤细胞的一种治疗方法。与传统的肿瘤治疗方法相比,其不仅直接发挥抗肿瘤作用,而且更加专注于纠正机体的细胞免疫功能低下,促进宿主抗肿瘤免疫功能。过继免疫治疗对于实体肿瘤和血液肿瘤都是很有希望的治疗方法,它的目的是恢复及增强免疫系统对肿瘤细胞的识别功能。以自体细胞因子诱导的杀伤细胞(CIK细胞)为主体的肿瘤过继免疫治疗已逐渐成为肿瘤生物治疗中最活跃的应用与研究领域之一,近年来研究成果较多。现综述如下。
1 CIK细胞的生物学特性

2 自体CIK 细胞的制备与输注方法

3 CIK细胞的作用机制及特点
CIK细胞介导的肿瘤靶细胞溶解作用机制被认为是由胞质颗粒作为外源性的局部定向的细胞溶解毒素,通过细胞膜而渗透进靶细胞内从而引起靶细胞的溶解。抗CD3-Mab或肿瘤细胞可致CIK细胞脱颗粒,但是这种作用的前提是必须靠黏附分子LAF-l及其配体ICAM-1相互作用使CIK细胞与靶细胞黏附在一起。LAF-1与其配体ICAM-1的单克隆抗体可阻断CIK细胞的杀瘤作用,而抗CD3-Mab不能阻断。虽然CIK细胞表达TCR-α/B表面分子,但是TCR-α/B的单克隆抗体并不能阻断CIK细胞的作用,其作用也不是抗体依赖的细胞介导的细胞毒作用,因其不表达CD16表面分子。
生物免疫治疗癌症的主要困难是许多肿瘤细胞表达FasL,可诱导免疫效应细胞的凋亡,从而降低细胞免疫治疗的成功率。此外,肿瘤周围的微环境存在的免疫抑制。最后,肿瘤中央和周围的免疫耐受共同协力作用灭活和(或)消灭对肿瘤有杀伤作用的免疫效应细胞。Vemeris等[5]研究发现CIK细胞对FasL所致的凋亡有对抗作用,因为其有抗凋亡基因的表达,当蛋白合成受抑时,CIK细胞的抗凋亡能力下降,容易被FasL诱导凋亡。CIK细胞是在体外培养时获得这种能力的,这些结果提示CIK细胞免疫治疗适合FasL阳性肿瘤[6]。
CIK细胞对多种肿瘤细胞包括急性髓系白血病、慢性骨髓性白血病、B-和T-细胞淋巴瘤具有明显的细胞毒功能[7~10]。像CD3细胞一样,CIK细胞同样表达T细胞相关抗原,而且可以迅速地扩大培养。T细胞受体分子的表达对CIK细胞识别肿瘤细胞来说不是一个先决条件,此外,CIK细胞的细胞毒作用不会受到T细胞受体或MHC Ⅰ类或Ⅱ类分子抗体掩蔽的影响。这表明CIK细胞对肿瘤细胞有直接杀伤作用,不需要以靶细胞MHC分子为介导[11]。CIK细胞不参与抗体依赖的细胞介导的细胞毒作用(ADCC)。由于CIK细胞膜缺乏CD16,导致其对一些免疫药物耐药,包括环孢素A 和FK506[12]。CIK细胞对化疗药物敏感,极易被化疗药物杀灭,故临床应用时限制了化疗和CIK细胞治疗的同时应用。有研究将MDR1的重组质粒转染CIK,观察CIK细胞耐药性,结果显示转染后CIK细胞MDR1基因的转录产物mRNA阳性,P-gp的表达较转染前明显增高,且对顺铂的耐药性明显提高。故MDR1基因转入CIK细胞后,细胞获得了多药耐药性,同时保持了对原有肿瘤细胞的杀伤活性,为化疗同时进行CIK细胞治疗提供了实验依据[13]。另外,CIK细胞通过识别NKG2D配体发挥杀伤肿瘤细胞能力,NKG2D向CIK细胞传递活化信号,使CIK细胞具有攻击靶细胞的能力。NKG2D能增强CIK细胞的细胞毒性和促进CIK细胞增殖,CIK细胞通过NKG2D发挥细胞毒活性[14]。
4 CIK细胞的临床应用
大量研究显示恶性肿瘤根治性切除术后,辅助CIK免疫治疗是可以获益的[15]。有研究显示肝癌根治性切除术后或微创术后的CIK辅助治疗可以有效降低复发率和转移率[16,17]。CIK细胞主要以非主要组织相容性复合体杀伤肿瘤细胞,因此对任何一种肿瘤均具有杀灭作用,无法进行手术、放疗、化疗的中晚期患者级放化疗失败的患者等均可以考虑行CIK维持治疗,维持治疗可以明显改善患者的预后,获益大小与回输次数具有相关性[18]。
从20世纪90年代起,国内外主要采用患者自体的CIK细胞进行肿瘤治疗。Schmidt-Wolf等[11]采用编码IL-2基因的质粒载体转染自体CIK细胞来治疗实体瘤(转移性肾癌、结肠癌、淋巴瘤),CIK细胞毒活性明显增强。Shi等[19]证实了自体CIK细胞在原发性肝癌的临床Ⅰ期试验中的安全性。最近,国外有报道thymoglobulin结合IFN-g和IL-2在扩大CIK细胞方面比CD3单克隆抗体更有效,CIK细胞结合甲状腺球蛋白(TG)在杀死K562细胞方面比TG联合抗CD3单克隆抗体更有效,并且可以释放较大量的具有生物活性的IL-12p40[20]。在I期后续研究中,给5例放化疗失败的成年肿瘤患者注入了结合TG的CIK细胞,结果证明其安全无副作用。应该强调的是:功能性的含有TG的CIK细胞会危害有转移性肿瘤的患者,因为会改变病情正在进展中的癌症患者的免疫抑制机制。进一步研究发现,患者来源的CIK细胞只能表达较低水平的激活/抑制NK受体的作用和在体外实验中较低的裂解活性。最近,CIK细胞的国际认证组织IRCC报道了426例患有肝癌、胃癌和复发性淋巴瘤的患者,通过输入自体或异体移植CIK细胞治疗的临床试验结果[21],成功回访并观察到临床反应的有384例,虽然肿瘤缩小的只有3例,但与未输注CIK细胞的对照组相比,输注CIK免疫治疗的患者预后更好。在移植异基因造血干细胞后,一些输入异体CIK细胞的患者会出现血液恶性肿瘤复发的情况。在剂量递增的研究中,CIK细胞来自于通过最初的供体,扩展为具有抗CD43抗性、IFN-g和IL-2活性的细胞,作用于18例血液恶性肿瘤成年患者,在CIK输注后的20个月随访当中,总生存期的平均值为28个月,有2例患者发生了急性移植物抗宿主病。值得一提的是,5例患者通过输注CIK细胞治疗病情获得了长时间的缓解。效果比输注同种异基因造血干细胞的患者还要好,在另一项研究中,输注了CIK细胞的11例患者中,有3例接受同种异基因移植者完全康复。11例中观察到4例急性移植物抗宿主病(1级和2级),2例进展为慢性移植物抗宿主病[22]。

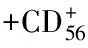
[3] Lirm YC, Hui KM. Cytokine-induced NK-like T cells: from bench to bedside[J]. J Biomed Biotechnol, 2010,2010(3):435745.
[4] 艾军,白引莳,张超,等.CIK细胞的生物学特性及荷瘤鼠体内分布特点研究[J].中国免疫学杂志,2010,26(7):606-610.
[5] Wang ZH, Li H, Zhang CY, et al. Antitumor Immunity and vaccine effect induced by IL-12 sylnergizes B7-1 gene transfected cells[J].Chin J Cancer Res, 2003,15(1):5-8.
[6] Stasi A, Tey SK, Dotti G,et al. Inducible apoptosis as a safety switch for adoptive cell therapy[J]. N Engl J Med,2011,365(18):1673-1683 .


[9] Introna M, Borleri G, Conti E, et al. Repeated infusions of donor-derived cytokine-induced killer cells in patients relapsing after allogeneic stem cell transplantation: a Phase I study[J]. Haematologica,2007, 92(7):952-959 .
[10] Olioso P, Giancola R, Riti M, et al. Immunotherapy with cytokine induced killer cells in solid and hematopoietic tumours: a pilot clinical trial[J]. Hematol Oncol, 2009,27(3):130-139.
[11] Schmidt-Wolf IG, Negrin RS, Kiem HP, et al. Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity[J]. J Exp Med,1991, 174(1):139-149.

[13] Deng Q,Bai X,Xian X,et a1.Revemion of muhidmg resistance by ClK in K562/ADR ceils and its mechanism exploration[J].Chin J Hematoline,2011,32(1):52-56.

[15] Sangiolo D. Cytokine induced kifier cells as promising immunotherapy for solid tumors[J]. J Cancer, 2011,35(2):363-368.
[16] Hui D,Qiang L, Jian W, et al. A randomized,controlled trial of postoperative adjuvant cytokine-induced killer cells immunelherapy after radical resection of hepatocellular carcinoma[J]. Dig Liver Dis, 2009,4l(1):36-41.
[17] Weng DS, Zhou J, Zhou QM, et al. Minimally invasive treatment combined with cytokine-induced kiler cells therapy lower the shortterm recurrence ratea of hepatocellular carcinomas[J].J Immunother,2008,31(1):63-71.
[18] Liu L, Zhang W, Qi X, el al. Randomined study of autologous cytokine-induced killer cell immunotherapy in metastatic renal eareinom[J].Clin Cancer Res, 2012,18(6):1751-179.
[19] Shi M, Zhang B, Tang ZR, et al. Autologous cytokine-induced killer cell therapy in clinical trial phase I is safe in patients with primary hepatocellular carcinoma[J].World J Gastroenterol, 2004,10(8):1146-1151.
[20] Rutella S, Locatelli F, et al. Is there a role for Cytokin-induced killer cells in cancer immunotherapy[J]. Immuno-Therapy, 2012,4(9):867-869.
[21] Hontscha C, Borck Y, Zhou H, et al. Clinical trials on CIK cells: first report of the international registry on CIK cells (IRCC)[J]. J Cancer Res Clin Oncol,2011,137(2):305-310.

国家中医药管理局重点学科建设项目(201232)。
10.3969/j.issn.1002-266X.2015.06.037
R730.5
A
1002-266X(2015)06-0095-03
2014-11-15)
