氢气对氧化损伤结肠腺癌细胞的保护作用及机制
2015-07-01穆怀博盛庆丰吴伟吕志葆
穆怀博,盛庆丰,吴伟,吕志葆
(1上海交通大学附属儿童医院,上海220000;2上海市儿童医院)
氢气对氧化损伤结肠腺癌细胞的保护作用及机制
穆怀博1,2,盛庆丰1,2,吴伟1,2,吕志葆1,2
(1上海交通大学附属儿童医院,上海220000;2上海市儿童医院)
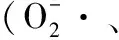
坏死性小肠结肠炎;结肠腺癌;氢气;Nrf2-ARE信号通路;氧化应激反应
氧化应激导致的炎症反应是新生儿坏死性小肠结肠炎(NEC)发病的重要原因[1~6]。研究证实,氢气具有抗氧化和抗炎等作用。本课题组前期研究发现氢气可明显提高肠上皮细胞中内源性抗氧化系统关键的核转录因子Nrf2的表达[7~10],但具体机制不清楚。因结肠腺癌细胞与肠上皮细胞与对氧化应激的反应相似,故我们于2014年1~8月观察了氢气对氧化损伤结肠腺癌细胞的保护作用,间接探讨氢气对氧化损伤肠上皮细胞的保护作用及其机制。
1 材料与方法
1.1 细胞培养 人结直肠腺癌细胞株 Caco-2 及IEC-6购自中国科学院细胞库。以含10%胎牛血清的RPMI 1640培养基,于苯并芘、饱和湿度、含 5% CO2的培养箱中培养,细胞呈单层贴壁生长。取对数生长期的细胞进行实验,细胞密度为 0.5×106~1×106/mL。
1.3 氢气对Caco-2 细胞线粒体膜电位影响的观察 取Caco-2 细胞,分组及处理同1.2。处理 30 min后用线粒体荧光染料染色,激光扫描共聚焦显微镜采集图像和荧光信号,检测线粒体膜电位变化;结果以荧光信号值表示。按试剂盒说明书操作。
1.4 氢气对Caco-2 细胞丙二醛(MDA)和8-羟基鸟嘌呤(8-OH-G)水平的影响的观察 取Caco-2 细胞,分组及处理同1.2。处理 24 h后常规消化、离心、洗涤并收集细胞。按照脂质氧化检测试剂盒 (Abcam 公司)说明书操作,用酶标仪在 532 nm 处测定吸光度值,计算脂质氧化终产物MDA水平;按照核酸氧化 ELISA 检测试剂盒(Abcam公司)步骤操作,检测 DNA氧化产物8-OH-G水平。
1.5 氢气对 Caco-2 细胞凋亡和乳酸脱氢酶(LDH)活性影响的观察 取Caco-2 细胞,分组及处理同1.2。处理 24 h后常规消化、离心、洗涤并收集细胞。按照 Annexin Ⅴ-FITC 凋亡检测试剂盒(Molecular Probes 公司)说明书操作,分别加入 Annexin Ⅴ-FITC 和碘化丙啶染色液,进行流式细胞仪检测(BD 公司),Annexin Ⅴ-FITC 为绿色荧光,碘化丙啶为红色荧光,计算凋亡细胞比例。并在荧光显微镜下观察和采集图像。检测培养液中LDH活性,结果以U/L表示。按LDH细胞毒性检测试剂盒(Abcam 公司)说明书操作。
1.6 氢气对Caco-2 、IEC-6细胞促炎症因子、抗炎症因子、转录因子Nrf2下游靶基因表达影响的观察 取对数生长期Caco-2 、IEC-6细胞,分别分为四组(细胞密度为 0.5× 106~1×106/mL)。对照组用RPMI1640培养基培养,模型组用含10 μg/mL抗霉素A的RPMI1640培养基培养,氢气组(用含 0.6 mmol/L 氢气的RPMI1640培养基培养;观察组用含0.6 mmol/L 氢气和30 μg/mL抗霉素A的RPMI1640培养基培养。处理12 h后,采用RT-PCR法检测各组促炎症因子(IL-6、TNF-α、IL-1β)、抗炎症因子(IL-10)、Nrf2及其下游靶基因血红素氧合酶-1(HO-1)、超氧化物歧化酶(SOD)、连环蛋白(Cat)、谷胱甘肽过氧化物酶(GPx)基因表达。各引物序列根据GenBank中的相应引物序列设计,由上海生工生物工程有限公司合成。结果以相对表达量表示。按试剂盒说明书操作。
2 结果

表1 各组Caco-2 细胞内和·OH比较
注:与模型组相比,*P<0.05。
2.2 Caco-2 细胞线粒体膜电位 观察组为67 890±989,对照组为96 541±1 245,模型组为47 890±768;观察组低于对照组,高于模型组(P均<0.05)。
2.3 Caco-2 细胞MDA和8-OH-G水平 各观察组 Caco-2 细胞内MDA和8-OH-G水平均低于模型组(P均<0.05),与对照组相比差异无统计学意义。见表2。
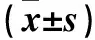
表2 各组Caco-2 细胞内MDA和8-OH-G水平比较
注:与模型组相比,*P<0.05。
2.4 Caco-2 细胞凋亡率和LDH水平 观察组 Caco-2 细胞凋亡率和LDH活性均低于模型组(P均<0.05),与对照组相比差异无统计学意义。见表3。
2.5 Caco-2 、ICE-6 细胞促炎症因子、抗炎症因子、Nrf2及其下游靶基因表达 Caco-2及ICE-6细胞促炎症因子、、抗炎症因子、转录因子Nrf2及其下游靶基因表达分别见表4~7。由表4~7可见,模型组Caco-2、ICE-6细胞促炎症因子水平高于对照组升高(P均<0.05)。观察组Caco-2、ICE-6细胞促炎症因子水平低于较模型组(P均<0.05),高于对照组(P>0.05);模型组抗炎症因子水平高于模型组(P均<0.05),低于对照组(P均>0.05);细胞转录因子Nrf2及其下游靶基因水平高于模型组(P均<0.05)及对照组(P均>0.05)。
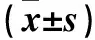
表3 各组Caco-2 细胞凋亡率和LDH水平比较
注:与模型组相比,*P<0.05。
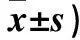
表4 Caco-2细胞各组促炎症因子、抗炎症因子表达比较(n=8,相对表达量,
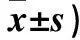
表5 各组Caco-2细胞转录因子Nrf2及其下游靶基因表达比较(n=8,相对表达量,

表6 各组ICE-6细胞促炎症因子、抗炎症因子表达比较(n=8,相对表达量,±s)

表7 各组ICE-6细胞转录因子Nrf2及其下游靶基因表达比较(n=8,相对表达量,±s)
3 讨论
氧化应激是指机体在遭受各种有害刺激时氧化系统和抗氧化系统失衡,从而导致组织损伤[8, 9]。急性氧化应激反应可通过直接或间接损伤DNA引起组织的严重损伤,持续慢性的氧化应激反应亦被认为是多种常见疾病(包括肿瘤)的发病原因之一。氧化损伤细胞的特征性表现为,线粒体内活性氧聚集,氧自由基水平升高;进而膜电位下降,线粒体膜通透性增加,释放细胞因子;细胞因子与Caspase家族结合,进而诱导细胞凋亡[16~18]。

研究发现,转录因子相关因子2(Nrf2)是细胞氧化应激反应中的关键因子,是细胞抗氧化还原的中枢调节者,Nrf2通过与抗氧化反应元件(ARE)相互作用,诱导编码抗氧化蛋白和Ⅱ相解毒酶的表达,在细胞的防御保护中发挥重要作用。本研究观察了氢气对氧化应激损伤细胞 Nrf2-ARE 信号通路的调节作用。Nrf2属于锌指蛋白 (bZIP)Cap 'n' Collar 家族中的一员,可激活多种细胞保护性蛋白的表达[13, 17]。本研究观察组Caco-2细胞和IEC-6细胞受到抗霉素A诱导的氧化损伤时,Nrf2 mRNA和蛋白表达有所上升,这可能是细胞自身的适应性反应,说明细胞已经启动抗氧化损伤的保护机制。研究证实,细胞受到氧化损伤后会引发一系列炎症反应,促炎症因子表达升高。本研究模型组炎症因子水平明显高于对照组,而氢气组明显低于模型组,说明氢气对炎症因子的释放有抑制作用,可抑制细胞内炎症反应的发生。研究证实,Nrf2的下游基因均参与了细胞内清除自由基和炎症反应。本研究观察组及模型组Nrf2及其下游基因表达均升高,而观察组表达明显高于模型组;提示两组细胞Nrf2-ARE通路均被激活,此可能为氢气抗氧化损伤作用的分子生物学基础。
综上所述,氢气能够降低抗霉素A诱导的结肠癌腺细胞内氧化损伤,表现为清除细胞内自由基,修复氧化损伤的线粒体膜电位,降低氧化代谢产物,抑制细胞凋亡,这一保护作用可能是通过调节Nrf2-ARE通路实现的。
[1] Ohsawa I, Ishikawa M, Takahashi K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007,13(6):688-694.
[2] Valko M, Leibfritz D, Moncol J, et al. Free radicals and antioxidants in normal physiological functions and human disease [J]. Int J Biochem Cell Biol,2007,39(1): 44-84.
[3] Steinhubl SR. Why have antioxidants failed in clinical trials[J]. Am J Cardiol,2008,101(10A):14-19.
[4] Dole M, Wilson FR, Fife WP. Hyperbaric hydrogen therapy:a possible treatment for cancer[J]. Science,1975,190(4210):152-154.
[5] Cai J, Kang Z, Liu WW, et al. Hydrogen therapy reduces apoptosis in neonatal hypoxia ischemia rat model [J]. Neurosci Lett, 2008,441(2):167-172.
[6] Cai J, Kang Z, Liu K,et al. Neuro-protective effects of hydrogen saline in neonatal hypoxia-ischemia rat model [J]. Brain Res, 2009,12(56):129-137.
[7] Ji Q, Hui K, Zhang L, et al. The effect of hydrogen richs alineon the brain of rats with transientischemia [J]. J Surg Res, 2011,168(1):95-101.
[8] Mao YF,Zheng XF, Cai JM, et al. Hydrogen-rich saline reduce lung injury induced by intestinal ischemia/reperfusion in rats[J]. Biochem Biophys Res Commun, 2009,38(1):602-605.
[9] Fang Y, Fu XJ, Gu C, et al. Hydrogen-rich saline protects against acute lung injury induced by extensive burn in rat model[J]. J Burn Care Res, 2011, 32(5):82-91.
[10] Kawamura T, Huang CS, Tochiqi IV, et al. Inhaled hydrogen gas therapy for prevention of lung transplant-induced ischemia/reperfusion injury in rats[J]. Transplantation, 2010,90(3):1344-1351.
[11] Furukawa S, Fujita T, Shimabukuro M, et al. Increased oxidative stress in obesity and its impact on metabolic syndrome[J]. J Clin Invest, 2004,114(12):1752-1761.
[12] Kamimura N, Nishimaki K, Ohsawa I, et al. Molecular hydrogen improves obesity and diabetes by induceing hepatic FGF21 and stimulating enery metabolism in db/db mice[J]. Obesity(Silver Sping), 2011,19(7):1396-1403.
[13] Kajiyama S, Hasegawa G, Asano M, et al. Supplementation of hydrogen-rich water improves lipid and glucose tolerance[J]. Nutr Res, 2008,28(3):137-143.
[14] Nakao A, Toyoda Y, Sharma P, et al. Effectiveness of hydrogen rich water on antioxidant status of subjects with potential metabolic syndrome-an open label pilot study[J]. J Clin Biochem Nutr, 2010,46(2):140-149.
[15] Ohsawa I, Nishimaki K, Yamagata K, et al. Consumption of hydrogen water prevents atherosclerosis in apolipoprotein E knockout mice[J]. Biochem Biophys Res Commun, 2008,377(4):1195-1198.
[16] Song G, Tian H, Liu J,et al. H2 inhibits TNF-α-induced lectin-like oxidized LDL receptor-1 expreeeion by inhibiting nuclear factor κB activation in endothelial cells[J]. Biotechnol Lett, 2011,33(9):1715-1722.
[17] Hayashida K, Sano M, Ohsawa I, et al. Inhalation of hydrogen gas reduces infarct size in the rat model of myocardial ischemia-reperfusion injury[J]. Biochem Biophys Res Commun, 2008,373(1):30-35.
[18] Zheng X, Mao Y, Cai J, et al. Hydrogen-rich saline protects against intestinal ischemia/reperfusion injury in rats[J]. Free Radic Res, 2009,43(5):478-484.
Protective effect of hydrogen saline in oxidative stress insulted enterocytes
MUHuai-bo1,SHENGQing-feng,WUWei,LVZhi-bao
(1Children′sHospitalAffiliatedtoShanghaiJiaotongUniversity,Shanghai220000,China)

necrotizing enterocolitis; human colon adenocarcinoma; hydrogen; Nrf2-ARE signaling pathway;oxidative stress
上海市科委引导类重点课题(124119a6500)。
穆怀博(1986-),男,医学硕士,住院医师,研究方向为儿童肿瘤、遗传代谢性和出生缺陷性疾病。E-mail:bloodmmf@126.com
通信者简介:吕志葆(1963-),男,医学博士,教授,主任导师,研究方向为儿童肿瘤、遗传代谢性和出生缺陷性疾病。E-mail:lvzhibao@sohu.com
10.3969/j.issn.1002-266X.2015.06.002
R34
A
1002-266X(2015)06-0004-04
2014-12-05)
