消化道恶性肿瘤患者肿瘤组织长链非编码RNA-HOTAIR高表达与预后关系的Meta分析
2015-07-01黄凯孙陟徐迅张长乐
黄凯,孙陟,徐迅,张长乐
(1安徽医科大学,合肥 230032;2安徽医科大学第一附属医院)
消化道恶性肿瘤患者肿瘤组织长链非编码RNA-HOTAIR高表达与预后关系的Meta分析
黄凯1,孙陟1,徐迅1,张长乐2
(1安徽医科大学,合肥 230032;2安徽医科大学第一附属医院)
目的 评价消化道恶性肿瘤患者肿瘤组织长链非编码RNA HOTAIR高表达与预后的关系。方法 检索PubMed、Web of Science数据库,收集研究HOTAIR表达与消化道恶性肿瘤预后相关性的英文文献。检索策略遵循Cochrane系统评价手册5.02,采取自由词检索。采用STATA12.0软件进行数据分析,采用I2指数量化异质性程度,P<0.05为差异有统计学意义。通过合并纳入研究的风险比(HR)及其95%可信区间(95%CI)评价HOTAIR高表达与消化道恶性肿瘤患者预后的关系。结果 共纳入11篇文献1 080例患者。HOTAIR高表达者死亡率为低表达者的2.25倍(95%CI2.05~3.17),P<0.05。结论 长链非编码RNA-HOTAIR高表达是消化道恶性肿瘤患者不良预后的危险因素。
消化道恶性肿瘤;预后;长链非编码RNA,HOTAIR
人类基因组中仅有不到2%的蛋白编码基因,超过90%的基因转录为非编码RNA(ncRNA)[1]。ncRNA根据核苷酸链的长短分为微小非编码RNA(18~25个核苷酸组成)和长链非编码RNA(超过200个核苷酸组成)两大类。HOTAIR是长链非编码RNA的一种,可通过逆转录的方式调控基因的表达,其是组蛋白修饰复合物的的一部分,可于3′端和5′分别结合组蛋白去甲基化酶复合体1(LSD1)和多梳抑制复合体2(PRC2),最终致使相应的碱基链发生表观遗传学沉默,使抑癌基因的表达受到抑制[2]。HOTAIR首先被发现可通过与PRC2协同作用抑制乳腺癌抑癌基因的转录而致使乳腺癌转移[3],随后又发现其在其他肿瘤组织高表达可能与肿瘤侵袭、转移和不良预后有关现对消化道恶性肿瘤组织HOTAIR表达与患者预后的关系进行Meta分析。
1 资料与方法
1.1 文献检索
1.1.1 检索策略 文献检索由两名研究人员以“HOTAIR、cancer or carcinoma、prognosis or prognostic or outcome、survival”为检索词独立检索,采用自由词检索方式,检索在PubMed和Web of Science上公开发表的有关HOTAIR表达与消化道肿瘤预后相关性研究的英文文献,检索文献发表起始时间为2000年1月1日,截止时间为2014年9月15日。检索策略遵循Cochrane系统评价手册[4]。
1.1.2 文献纳入与排除标准 ①各类型人类消化道肿瘤的研究(包括食管、胃、小肠、结直肠肿瘤);②文献中明确指出HOTAIR定性或定量检测的方法且依据一定标准能判定肿瘤组织HOTAIR高表达或低表达;③涉及HOTAIR表达与术后总生存期,且能直接或间接提取HR值和95%CI的研究;④能获得原文。排除标准:①非消化道肿瘤与HOTAIR关系的研究;②重复发表的文献;③不能从原文献提取相应数据的研究;④动物实验或单个病例报告;⑤非英文文献。
1.2 资料提取 由两位研究者按照独立、有分歧经商讨再做决定的原则提取数据。纳入研究需要提取的数据主要包括:第一作者姓名、文献发表的时间,被研究者的国籍、肿瘤类型、研究样本数、HOTAIR检查方法及R表达水平的判断标准、术后消化道肿瘤患者生存率的统计方法、生存分析、风险比(HR)以及其95%可信区间(95%CI)。
1.3 文献质量评价 因纳入的原始研究均为观察性研究,故由2名独立的研究者依据Newcastle-Ottawa Scale(NOS)评价标准[5]从研究病例的选择、可比性和研究结果测量三个方面对纳入研究进行质量评价,总得分为10分,≥7分为高质量研究。
1.4 敏感性分析 每次剔除一个研究重新进行Meta分析并比较结果。
1.5 发表偏倚分析 采用Begg漏斗图评价。
1.6 统计学方法 采用STATA12.0统计软件。对于原文件未直接给出HR及95%CI而仅仅给出Kaplan-Meier生存曲线的,按照Parmar[6]提出的方法获取所需数据。HOTAIR表达与消化道肿瘤预后的相关性用HR以及95%CI的效应量评价。对纳入文献的研究结果通过Meta分析方法进行合并,绘制森林图。各纳入文献之间的异质性采用χ2检验和I2统计量来验证。P≤0.05、I2≥50%时采用随机效应模型进行数据合并;若P>0.05、I2<50%则采用固定效应模型进行数据合并。为进一步探究被纳入研究之间可能的异质性来源,按照消化道肿瘤类型(食管癌、胃癌、结直肠癌)、纳入患者的国籍、样本数大小、纳入研究的质量分为亚组,进行敏感性分析以验证每个独立研究对总的合并结果的影响。通过Begg's测试以及绘制漏斗图估计发表偏倚。P<0.05为差异有统计学意义。
2 结果
2.1 纳入文献的基本情况 初步检索到130篇相关文献,最后11篇文献[7~17]纳入本研究。研究内容为食道癌4篇[7~10]、胃癌4篇[11~14]、结直肠癌3篇[15~17];其中NOS评分≥7分6篇,<7分5篇。11篇文献共包括1 080例消化道肿瘤患者。主要观察项目为肿瘤组织中HOTAIR表达及其与患者术后总生存期(OS)的关系。按术后肿瘤组织HOTAIR表达检测结果分为HOTAIR高表达与低表达组(各研究的评价标准不同),分析两组总生存期(OS)。11篇文献均能直接或间接获得各组间总生存期的风险比(HR)及其95%可信区间(95%CI)。其中NOS评分≥7分6篇,<7分5篇。纳入文献的基本情况见表1。
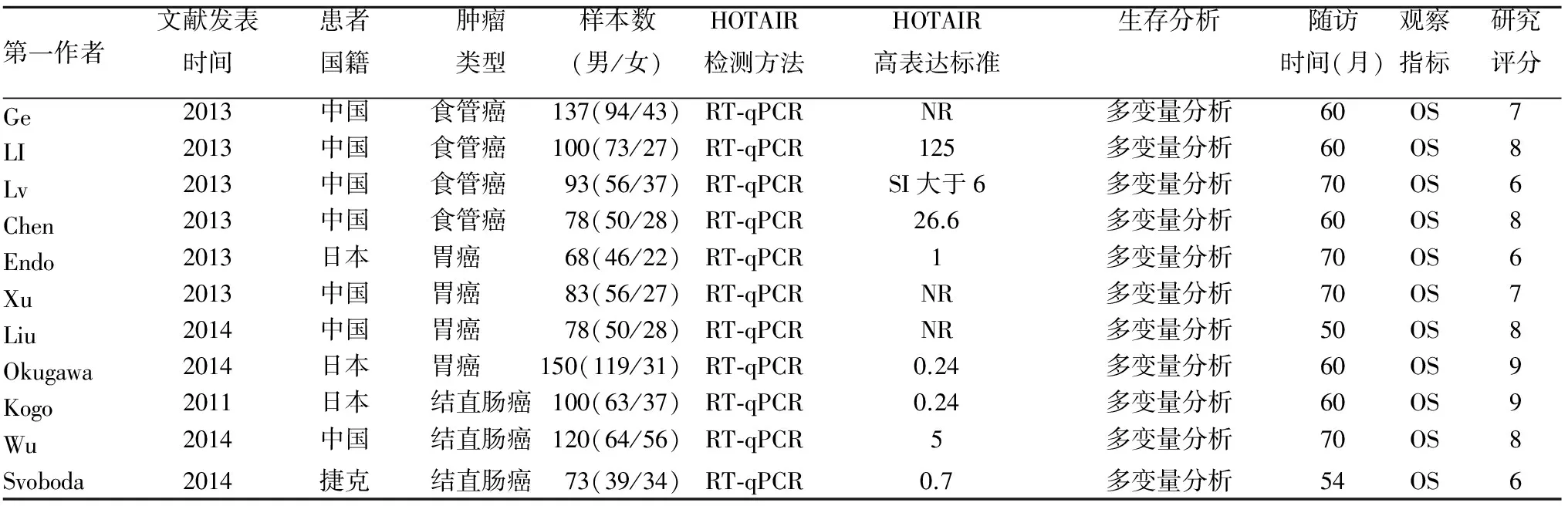
表1 纳入文献的基本情况
2.2 HOTAIR高表达与患者OS的相关性 HOTAIR高表达与患者OS存在相关性(HR为2.25,95%CI2.05~3.17),HOTAIR高表达者死亡的风险为低表达者的2.25倍。见图1。异质性检验I2=35.2%,提示各个研究之间有一定的异质性。

图1 纳入研究的Meta分析森林图
由于各个研究之间存在一定的异质性,因此按照肿瘤类型(食管癌、胃癌或结直肠癌)、纳入研究对象的国籍(中国、日本或捷克)、各研究样本量(≥100或<100)及质量评分(≥7或<7)进行亚组分析。结果在不同亚组中,食管癌亚组OS与HOTAIR存在相关性(HR为2.24,95%CI为1.67~3.01),其组内异质性低(P>0.05)。结直肠癌亚组HOTAIR高表达者预后不良(HR为2.81,95%CI为1.35~5.87),其组内异质性I2=46%大于总合并的异质性。胃癌亚组组内异质性I2=46.7%,亦大于总的合并异质性,该组合并值为HR 4.4,提示胃癌患者的不良预后与HOTAIR的关系较食管癌和结直肠癌更密切。以不同国家为亚组的研究中发现,各亚组合并的I2均小于25%,提示国籍不同可能是合并研究异质性来源的主要原因。样本数≥100亚组的组内异质性小(I2<25%,P=0.525),<100亚组的组内异质性明显(I2=57%,P=0.04)。文献质量≥7分亚组的组内异质性较小(I2<25%,P=0.698),<7分亚组的异质性较大(I2=73.9%,P=0.009)。
2.4 敏感性分析 结果显示每次剔除一个研究,结果并没有明显的改变,说明此Meta分析结果相对稳定。
2.5 发表偏倚 漏斗图图形显示散点不对称分布。Begg秩相关检验显示P=0.020,Egger线性回归法所得P=0.004,提示可能存在一定的发表偏倚。
3 讨论
消化道恶性肿瘤常呈侵袭性生长,具有发现晚、转移早的特点,5年生存率较低。研究证实,长链非编码RNA在肿瘤进展和转移中通过染色体重塑、转录和转录后的加工而发挥生物学作用。不同类型的恶性肿瘤均检测到HOTAIR的明显表达。本研究结果显示,食管癌、胃癌和结肠癌患者癌组织中HOTAIR高表达者预后不良;亚组分析结果亦证实了上述结论。异质性来源分析发现不同国籍各亚组合并的I2值均减小,提示纳入研究者国籍不同可能是合并研究异质性来源的主要原因。另外,在纳入的11项原始研究中,各项研究界定HOTAIR高表达与低表达的标准不同,有些研究甚至未给出具体的标准,也可能造成各研究的异质性。从肿瘤本身的的特征分析,同一肿瘤有不同的病理类型,其预后也有差异,原始文献未能明确提出纳入肿瘤的病理类型,也可能造成研究间的异质性。此外,不同国家的医疗水平不同、患者术后治疗情况均会对患者的OS有影响,这均会引起各个研究间存在异质性。
本研究论文发表偏倚评价的Begg漏斗图图形显示散点不对称分布,Begg秩相关检验所得P=0.020,Egger线性回归法所得P=0.004,提示存在发表偏倚。可能与未纳入可能存在的阴性结果的文献或由于条件限制未能进一步纳入尚未发表的文献或非英文文献有关。
本研究中有一些限制需要指出:①部分研究不能直接从原文献获得资料,我们通过其生存曲线提取HR估计;②不同研究中高和低HOTAIR表达的截断值不同,不能达到统一的标准;③因为常常结果为阴性的实验研究通常不太可能被公开,大部分的纳入研究报告阳性结果;④本次Meta分析仅仅纳入了英文文献,这可能为发表偏倚的原因之一;⑤由于不同病理亚型的肿瘤的预后会有很大的不同,纳入的文献中均未具体指出其研究消化道肿瘤的具体病理亚型,这亦可使HOTAIR与肿瘤不良预后关系大小受到影响。
总之,消化道恶性肿瘤组织中HOTAIR表达上调与患者的不良预后有很大关联。提示HOTAIR可作为一种新的预测因子用于消化道肿瘤预后的判断。患者HOTAIR表达水平可指导术后治疗; HOTAIR可作为肿瘤治疗新药物的靶点。
[1] ENCODE Project Consortium, Birney E, Stamatoyannopoulos JA,et al.Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project[J]. Nature, 2007,447(7146):799-816.
[2] Rinn JL, Kertesz M, Wang JK, et al. Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs[J]. Cell,2007, 129(7):1311-1323.
[3] Gupta RA, Shah N, Wang KC, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J]. Nature, 2010,15,464(7291):1071-1076.
[4] Moher D, Liberati A, Tetzlaff J, et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement[J].BMJ,2009, 339(4):2535.
[5] Yang Z, Zhou L,Wu LM, et al. Overexpression of long non-coding RNA HOTAIR predicts tumor recurrence in hepatocellular carcinoma patients following liver transplantation[J]. Ann Surg Oncol,2011,18(4):1243-1250.
[6] Parmar MK, Torri V, Stewart L, et al. Extracting summary statistics to perform meta-analyses of the published literature for survival endpoints[J]. Stat Med, 1998,17:2815-2834.
[7] Ge XS, Ma HJ, Zheng XH, et al. HOTAIR, a prognostic factor in esophageal squamous cell carcinoma, inhibits WIF-1 expression and activates Wnt pathway[J]. Cancer Sci, 2013,104(12):1675-1682.
[8] Li X, Wu Z, Mei Q, et al. Long non-coding RNA HOTAIR, a driver of malignancy, predicts negative prognosis and exhibits oncogenic activity in oesophageal squamous cell carcinoma[J]. Br J Cancer, 2013,15;109(8):2266-2278.
[9] Lv XB, Lian GY, Wang HR, et al. Long noncoding RNA HOTAIR is a prognostic marker for esophageal squamous cell carcinoma progression and survival[J]. PLoS One, 2013,8(5):63516.
[10] Chen FJ, Sun M, Li SQ, et al. Upregulation of the long non-coding RNA HOTAIR promotes esophageal squamous cell carcinoma metastasis and poor prognosis[J]. Mol Carcinog, 2013,52(11):908-915.
[11] Endo H, Shiroki T, Nakagawa T, et al. Enhanced expression of long non-coding RNA HOTAIR is associated with the development of gastric cancer[J].PLoS One, 2013,8(10):77070.
[12] Xu ZY, Yu QM, Du YA, et al. Knockdown of long non-coding RNA HOTAIR suppresses tumor invasion and reverses epithelial-mesenchymal transition in gastric cancer[J]. Int J Biol Sci, 2013,9(6):587-597.
[13] Liu XH, Sun M, Nie FQ, et al. Lnc RNA HOTAIR functions as a competing endogenous RNA to regulate HER2 expression by sponging miR-331-3p in gastric cancer[J]. Mol Cancer, 2014,28(13):92.
[14] Okugawa Y, Toiyama Y, Hur K, et al. Metastasis-associated long non-coding RNA drives gastric cancer development and promotes peritoneal metastasis[J].Carcinogenesis, 2014,35(12):2731-2739.
[15] Kogo R, Shimamura T, Mimori K,et al. Long noncoding RNA HOTAIR regulates polycomb-dependent chromatin modification and is associated with poor prognosis in colorectal cancers[J]. Cancer Res, 2011,71(20):6320-6326.
[16] Wu ZH, Wang XL, Tang HM, et al. Long non-coding RNA HOTAIR is a powerful predictor of metastasis and poor prognosis and is associated with epithelial-mesenchymal transition in colon cancer[J]. Oncol Rep, 2014,32(1):395-402.
[17] Svoboda M, Slyskova J, Schneiderova M, et al. HOTAIR long non-coding RNA is a negative prognostic factor not only in primary tumors, but also in the blood of colorectal cancer patients[J]. Carcinogenesis, 2014,35(3):1510-1515.
[18] Tsai MC, Manor O, Wan Y, et al. Long noncoding RNA as modular scaffold of histone modification complexes[J]. Science,2010,329(6850):689-693.
[19] Mac Donald BT, Tamai K, He X. Wnt / beta-catenin signaling: components,mechanisms, and diseases[J]. Dev Cell, 2009,17(1):9-26.
[20] Niinuma T, Suzuki H, Nojima M, et al. Upregulation of miR-196a and HOTAIR drive malignant character in gastrointestinal stromal tumors[J]. Cancer Res,2012,72(3):1126-1136.
张长乐
10.3969/j.issn.1002-266X.2015.06.017
R735
B
1002-266X(2015)06-0046-04
2014-08-15)
