急性高原反应大鼠模型的建立及多指标综合评价
2015-06-28王驰晏沐阳段晋燕陈静雯黄杰关旭向代军姜辉王成彬
王驰,晏沐阳,段晋燕,陈静雯,黄杰,关旭,向代军,姜辉,王成彬
急性高原反应大鼠模型的建立及多指标综合评价
王驰,晏沐阳,段晋燕,陈静雯,黄杰,关旭,向代军,姜辉,王成彬
目的建立大鼠急性高原反应模型,探讨动物模型的建立条件与各综合评价指标。方法采用国产低气压舱模拟高原环境,70只雄性Wistar大鼠在常压常氧环境(正常对照组)和低压舱模拟海拔5000m、6000m分别放置12、24、48h,每组10只,观察大鼠在舱内的行为。Morris水迷宫实验检测大鼠空间记忆能力,腹主动脉取血检测动脉血氧分压,观察大鼠肺、脑组织病理学变化并测定肺组织与脑组织湿/干重比值。结果大鼠在低气压舱内活动减少甚至死亡,大鼠动脉血氧分压明显低于正常对照组。Morris水迷宫空间探索实验中,与正常对照组相比,低气压舱模拟急性高原反应分别在海拔5000m维持24h后与海拔6000m维持12h后的大鼠寻找平台潜伏期延长、目标象限停留时间缩短、穿越平台次数减少(P<0.05)。肺、脑组织在低压舱模拟两个海拔处理48h后均出现病理学变化,大鼠肺组织、脑组织湿/干重比值均增加。结论采用低压舱干预复制大鼠急性高原病模型,可出现不同指标的异常,且时间点不同。可采用多个不同指标对此模型进行综合评价,从而为高原反应动物实验提供依据和判定方法。
急性高原病;模型,动物;水迷宫
平原人群短时间内进入海拔3000m以上地区时,因无法在短时间内适应高原低氧环境而出现一系列非特异性症状[1],进而发展为急性高原病[2]。海拔3000~5000m地区急性高原病发病率在某些地区可能高达50%[3],可进一步发展为高原肺水肿、高原脑水肿等致命性疾病,对高原地区经济发展、部队进驻高原地区执行紧急任务和医疗救治造成严重影响[4]。目前,极少有以志愿者作为受试对象进入低氧环境来模拟急性高原病的试验研究[5-6],动物模型是急性高原病研究的主要手段,早在20世纪40年代就有学者观察大鼠在低压低氧环境下的生理情况、体重、血流量的变化[7-9]。但对于急性高原病动物模型复制所采用的缺氧方法、时间和海拔高度等尚不统一,5000~8000m的海拔高度多见于复制大鼠急性高原病模型,极限高度可达9000m[10-11]。
高原地区的调查研究表明,在急进高原人群中最常见的症状是头痛[12],提示急性高原病早期脑功能的改变可能在组织损伤或血清学指标变化前就已经出现。海马更易受到低氧的影响,在低氧时表现出学习记忆能力的下降[13]。水迷宫作为最常见的反应学习记忆能力行为学实验,可以用来评价低气压舱处理后大鼠脑功能的改变[14-15]。本研究旨在探索海拔高度与低氧处理时间对大鼠各项指标的影响,为选择最适海拔和低氧处理时间进行急性高原病模型复制、在平原地区进行急性高原病预防治疗的分子机制研究奠定基础。
1 材料与方法
1.1 实验动物与分组 SPF级Wistar大鼠70只,雄性,体重220±10g(军事医学科学院实验动物中心,动物合格证号:SCXK-(军)2012-0004)。大鼠饲养于动物中心清洁房中,温度21~24℃,湿度50%~60%,昼夜12h节律,自由进食饮水。自由饲养3d后随机分为7组,每组10只。正常对照组(NC group)在低气压舱外常压常氧环境处理;低氧处理组分为5000m和6000m两个海拔高度,于12、24、48h时间点给予低压干预(5000m/12h组、5000m/24h组、5000m/48h组、6000m/12h组、6000m/24h组、6000m/48h组)。
1.2 实验仪器和设备 低压低氧治疗舱/实验动物舱(烟台冰轮高压氧舱有限公司,设备编号:10-UWC800-02);Morris水迷宫图像自动采集处理系统(北京Xeye科技有限公司);电子天平(上海精密科学仪器有限公司,编号400607045105);电热恒温鼓风干燥箱;全自动血气分析仪(Roche,cobas-b-221)。
1.3 低气压舱模拟高原急性缺氧大鼠模型的复制
采用低气压舱进行不同海拔与时间的低氧处理,每组10只。将大鼠放入低气压舱,密闭舱门,利用真空泵将舱内空气部分抽出模拟高原低压低氧环境,以2m/s速度减压,模拟上升至海拔5000m或6000m,每隔4~6h给予新鲜空气流通(换气过程中保证舱内压力稳定),氧舱维持温度22~24℃。期间大鼠自由饮食饮水,按照实验分组完成预定缺氧时间后,调节进气阀门,以2m/s速度降至海拔4000m,进行下一步实验。实验结束后,以2m/s速度降至正常海拔高度。观察各组大鼠在此期间的行为、呼吸频率、活动量。
1.4 空间记忆功能测试 Morris水迷宫检测系统由一个直径160cm、高60cm的水池和图像采集分析系统两部分组成。水池平均划分为4个象限,象限池壁圆弧中点为可选的动物入水点,图像采集分析系统记录动物游泳轨迹数据。
1.4.1 定位航行实验 所有大鼠在氧舱外常压常氧环境下进行为期5d的定位导航实验,每天于固定时间段训练4次。将平台置于某一象限,从池壁4个起始点的任一点将大鼠面向池壁放入水池,由录像记录系统记录大鼠找到平台的时间(逃避潜伏期)和游泳路径图。规定每次的实验时间为120s,如果大鼠在120s内未能找到平台,则将其引导至平台,在平台上停留10s以上,两次训练时间间隔在60s以上。以大鼠4次训练潜伏期的平均值作为大鼠当日的学习成绩。
1.4.2 空间探索实验 撤除原平台,将平台所在象限的对侧象限作为大鼠的入水点,所有大鼠必须为同一入水点,记录大鼠在60s内跨越平台的次数、目标象限内停留时间和寻找平台潜伏期。NC组大鼠在进行完5d的定位航行实验后24h在常压常氧环境下进行水迷宫探索实验,记录逃避潜伏期、目标象限停留时间和穿越平台次数。各低压低氧处理组大鼠在经不同海拔和低氧处理相应时间后,在海拔4000m的安全环境下,进行水迷宫探索实验,记录各组大鼠的上述指标,与NC组进行对比。
1.5 血气测定 各组大鼠在水迷宫探索实验结束后,从舱内取出,按照1ml/kg剂量立即给予腹腔注射10%水合氯醛麻醉,大鼠取仰卧位,暴露腹腔后分离出腹主动脉,抽取腹主动脉血约1ml,放入肝素抗凝管,30min内进行血气分析。
1.6 大鼠肺、脑组织取材 剥离脑组织,观察脑组织大体病理改变。切取右侧脑组织标本,4%多聚甲醛固定24h、石蜡包埋,4μm切片,裱于清洁载玻片上,常规脱蜡、复水、PBS洗涤后进行HE染色。大鼠麻醉后仰卧位,打开胸腔观察肺组织大体病理改变,取左侧肺组织固定、包埋,制作切片及HE染色其余步骤同上。
1.7 肺、脑组织湿/干重测定 取剩余左脑组织,准确称重后,放入恒温烘干箱100℃烘烤24h至恒重后,称取脑干重(精确到0.01g)。取右侧肺组织准确称重后,放入恒温烘干箱烘烤方法同上,称取肺干重。计算脑、肺组织湿/干重比值。
1.8 统计学处理 采用SPSS 17.0统计软件进行数据统计。符合正态分布和方差齐的定量资料用表示,采用析因设计方差分析,比较模拟海拔和低氧处理的时间两个因素对大鼠水迷宫逃避潜伏期、目标象限停留时间、穿越平台次数、血气和肺、脑组织干湿重是否有交互作用;采用单因素方差分析比较多个样本均数,组间进一步两两比较采用SNK-q检验;采用t检验进行两样本均数的比较。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠基本情况 正常组大鼠的活动、呼吸全程无明显变化,不同海拔模拟组均出现呼吸节律的变化,还可见呼吸暂停,活动减少、行动迟缓、饮食饮水减少。在海拔5000m/48h组、6000m/24h组和6000m/48h组分别出现1只、2只和3只大鼠死亡。
2.2 空间记忆功能测试
2.2.1 水迷宫定位航行实验 在Morris水迷宫定位航行试验中,大鼠寻找隐藏平台的逃避潜伏期随训练天数增加逐渐下降,表明大鼠在训练过程中的空间学习记忆能力是正常的(图1)。
2.2.2 水迷宫空间探索实验 两因素析因分析海拔和低氧处理时间两个因素之间有交互作用(P<0.05),则固定其中一个因素(海拔或低氧处理时间),分析另一个因素的单独效应(表1)。与NC组相比,5000m/12h组大鼠的逃避潜伏期、目标象限停留时间和穿越平台次数均无明显变化(P>0.05),其他5组大鼠的逃避潜伏期延长(P<0.05),目标象限停留时间缩短(P<0.05),穿越平台次数减少(P<0.05)。5000m/24h组和5000m/48h组间3项指标差异有统计学意义(P<0.05)。6000m/12h、6000m/24h和6000m/48h组间的大鼠水迷宫各项指标差异有统计学意义(P<0.05)。6000m/12h组与5000m/12h组比较,水迷宫各项指标差异有统计学意义(P<0.05)。而5000m/24h组和6000m/24h组、5000m/48h组和6000m/48h组比较,水迷宫各项指标差异无统计学意义(P>0.05)。图2为各组大鼠Morris水迷宫探索实验代表性运动轨迹图,用于分析逃避潜伏期、目标象限停留时间和穿越平台次数3个指标,NC组大鼠运动轨迹集中在平台周围,5000m/12h组变化不明显,其余5组均可见在平台周围的轨迹减少。结果表明,大鼠寻找平台的能力在低氧处理后下降,与上述指标结果一致。
2.3 肺、脑组织病理学表现 与NC组相比,脑组织在低氧处理后未观察到大体形态改变。光镜下观察显示,NC组脑组织结构正常,细胞形态结构完好,5000m/12h、5000m/24h组、6000m/12h组和6000m/24h组大鼠脑组织均未见明显异常,5000m/48h组与6000m/48h组可见脑组织神经元细胞水肿,神经元数量减少,细胞和血管周围间隙增大(图3)。低氧处理后大鼠肺组织与NC组相比无大体形态变化,光镜下可见NC组肺组织形态结构完整,肺泡腔中未见渗出液,肺泡壁光滑。5000m/12h组、5000m/24h组、6000m/12h组和6000m/24h组大鼠肺组织未见明显异常,5000m/48h组与6000m/48h组可见大鼠肺间隔增宽、肺泡壁增厚,可见炎细胞浸润,肺泡结构破坏(图4)。
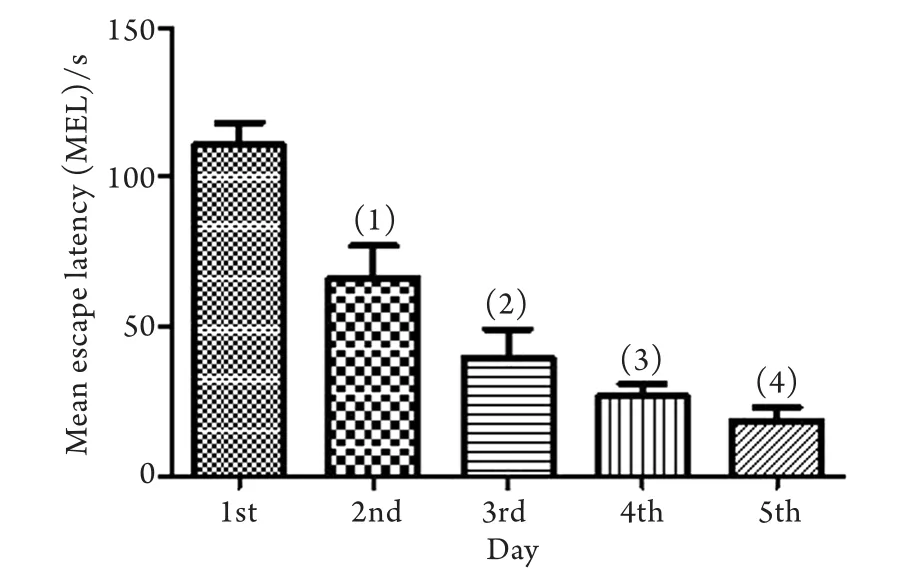
图1 大鼠训练期间逃避潜伏期变化Fig.1 Changes of escape latency during training course(1)P<0.05 compared with 1st day; (2)P<0.05 compared with 2nd day; (3)P<0.05 compared with 3rd day; (4)P<0.05 compared with 4th day
表1 各组大鼠Morris水迷宫探索实验逃避潜伏期、目标象限停留时间和穿越平台次数的比较(±s,n=7)Tab. 1 Comparison of escape latency, time spent in target quadrant and frequency of crossing platform among rats of seven groups (x±s, n=7)
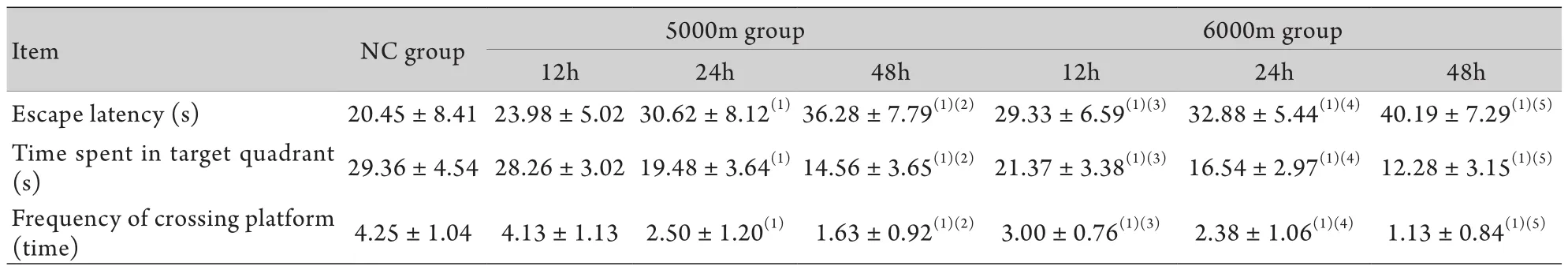
表1 各组大鼠Morris水迷宫探索实验逃避潜伏期、目标象限停留时间和穿越平台次数的比较(±s,n=7)Tab. 1 Comparison of escape latency, time spent in target quadrant and frequency of crossing platform among rats of seven groups (x±s, n=7)
(1)P<0.05 compared with NC group; (2)P<0.05 compared with 5000m/24h group; (3)P<0.05 compared with 5000m/12h group; (4)P<0.05 compared with 6000m/12h group; (5)P<0.05 compared with 6000m/24h group
Item NC group 5000m group 6000m group 12h 24h 48h 12h 24h 48h Escape latency (s) 20.45±8.41 23.98±5.02 30.62±8.12(1)36.28±7.79(1)(2)29.33±6.59(1)(3)32.88±5.44(1)(4)40.19±7.29(1)(5)Time spent in target quadrant (s) 29.36±4.54 28.26±3.02 19.48±3.64(1)14.56±3.65(1)(2)21.37±3.38(1)(3)16.54±2.97(1)(4)12.28±3.15(1)(5)Frequency of crossing platform (time) 4.25±1.04 4.13±1.13 2.50±1.20(1) 1.63±0.92(1)(2) 3.00±0.76(1)(3) 2.38±1.06(1)(4) 1.13±0.84(1)(5)

图2 各组大鼠Morris水迷宫探索实验代表性运动轨迹图Fig. 2 Representative tack sheet showing memory test of NC group and hypobaric hypoxia groupsA. Normal control group; B. 5000m/12h group; C. 5000m/24h group; D. 5000m/48h group; E. 6000m/12h group; F. 6000m/24h group; G. 6000m/48h group
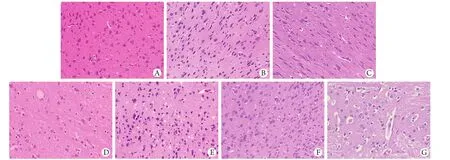
图3 各组大鼠脑组织病理观察(HE×400)Fig. 3 Histopathology observation of cerebrum tissues in rats of seven groups (HE×400)A. Normal structure of normal cerebrum in control group; B. No clear change of cerebrum in 5000m/12h group; C. No clear change of cerebrum in 5000m/24h group; D. Pathological changes of cerebrum in 5000m/48h group, enlarged perivascular space, edematous brain neurons and fewer number of neurons can be observed; E. No clear change of cerebrum in 6000m/12h group; F. No clear change of cerebrum in 6000m/24h group; G. Similar changes of cerebrum in 6000m/48h group compared with that in 5000m/48h

图4 各组大鼠肺组织病理观察(HE×200)Fig. 4 Histopathology observation of lung tissues in rats of seven groups (HE×200)A. Normal structure of alveoli in normal control group, with distinct alveolar space and no exudation in the interstitial space; B. No clear changes of alveoli in 5000m/12h group; C.No clear changes of alveoli in 5000m/24h group; D. Pathological changes of alveoli in 5000m/48h group, with hyperemic alveolar wall, hyperplastic alveolar epithelium and inflammatory cells infiltration; E. No clear changes of alveoli in 6000m/12h group; F. No clear changes of alveoli in 6000m/24h group; G. Pathological changes of alveoli in 6000m/48h group, similar to that in 5000m/48h group
2.4 动脉血气的变化 与NC组比较,6个低压干预组大鼠动脉血气下降(P<0.05,表2),5000m/12h组、5000m/24h组和5000m/48h组间大鼠血气差异有统计学意义(P<0.05),随着低氧时间延长血气逐渐下降,海拔6000m处理的3组大鼠血气变化趋势与5000m处理相同,即随时间延长而下降(P<0.05)。低氧处理12、24h的两个海拔组之间动脉血气差异有统计学意义,表现为6000m/12h组血气低于5000m/12h组,6000m/24h组低于5000m/24h组(P<0.05),而6000m/48h组与5000m/48h组大鼠的动脉血气之间差异无统计学意义(P>0.05)。
2.5 肺、脑组织湿/干重测定 与NC组相比,5000m/12h组、5000m/24h组、6000m/12h组和6000m/24h组大鼠肺、脑组织湿/干重差异无统计学意义(P>0.05)。5000m/48h和6000m/48h组大鼠肺、脑组织湿/干重均显著增加(P<0.05),且后者高于前者(P<0.05,表2)。
表2 各组大鼠肺组织、脑组织湿/干重和动脉血气指标PaO2比较(±s,n=7)Tab. 2 Comparison of arterial blood gas PaO2, cerebral wet/dry ratio and lung wet/dry ratio in rats of seven groups (±s,n=7)

表2 各组大鼠肺组织、脑组织湿/干重和动脉血气指标PaO2比较(±s,n=7)Tab. 2 Comparison of arterial blood gas PaO2, cerebral wet/dry ratio and lung wet/dry ratio in rats of seven groups (±s,n=7)
(1)P<0.05 compared with NC group; (2)P<0.05 compared with 5000m/12h group; (3)P<0.05 compared with 5000m/24h group; (4)P<0.05 compared with 6000m/12h group; (5)P<0.05 compared with 6000m/24h group; (6)P<0.05 compared with 5000m/48h group
Item NC group 5000m group 6000m group 12h 24h 48h 12h 24h 48h PaO2(mmHg) 86.08±5.81 74.37±9.87(1)68.72±10.14(1)(2)60.41±11.43(1)(3)72.49±8.33(1)(2)65.29±9.14(1)(3)(4)59.28±10.52(1)(5)Wet/dry ratio (cerebrum)4.04±0.46 4.18±0.52 4.36±0.68 5.09±0.41(1) 4.22±0.34 4.38±0.37 5.28±0.39(1)(6)Wet/dry ratio (lung) 3.82±0.48 3.89±0.57 3.98±0.36 5.31±0.51(1) 3.94±0.62 4.19±0.45 5.68±0.31(1)(6)
3 讨 论
急进高原引起的高海拔缺氧使机体出现组织代谢障碍和各系统功能紊乱。研究高原急性缺氧对机体损伤的机制及相应的防治措施是当前高原医学面临的迫切问题。开展高原医学研究,需要解决的首要问题是急性高原病动物模型的复制。目前,对人群急性高原病的诊断采用路易斯湖评分标准或国内急性高原病诊断标准[16-18],主要根据高原低氧环境下出现的一系列症状,进行量化评分来诊断急性高原病。但动物模型复制后,因为无法像人一样对动物进行症状的评分量化,因此需要选择其他指标进行动物急性高原病模型成功与否的判断。
以往研究对急性高原病动物模型采用病理切片观察来判断模型复制效果或用药治疗效果,但组织学出现改变通常晚于体内发生的代谢改变,因而近几年有选择血清或组织中的酶(例如乳酸脱氢酶、ATP酶等)或其他代谢物(例如乳酸、MDA、SOD 等)表达变化作为急性高原病模型复制成功与否的判断[10],但目前对急性高原病动物模型复制成功与否的评价和模拟高原的条件尚无统一标准。
大脑对高原低氧非常敏感,Morris水迷宫实验能反映大鼠空间学习记忆能力,是记忆量化的良好指标,其中空间探索实验用于测试动物空间记忆的能力。已有文献显示低气压舱处理大鼠后可导致大鼠寻找平台的逃避潜伏期缩短、目标象限停留时间缩短和跨越平台次数的减少,提示低氧环境下记忆能力降低[19-21]。本研究采用低气压舱模拟不同海拔高度并维持不同的低氧时间,水迷宫实验结果显示,在模拟海拔高度5000m低氧处理12h后大鼠的空间记忆能力与常氧对照组无明显差异,提示大脑记忆功能未出现下降,说明在此处理条件下尚未出现急性高原反应,可能是处理时间过短,动物未出现低氧反应,但仍需要增大样本量进一步探索。模拟海拔高度5000m维持24h后和模拟海拔高度6000m维持12h后,大鼠水迷宫的探索实验与常氧对照组均出现明显差异,表现为逃避潜伏期延长、目标象限停留时间缩短和穿越平台次数下降,但脑组织在6000m低氧处理12h后尚未见明显形态学改变,可能为组织形态的变化晚于记忆能力的变化,提示水迷宫反应大脑功能的下降比组织形态更为敏感。
动脉血氧分压可作为评价机体缺氧状态的指标,在低氧处理后12h已经出现变化,表现为低于NC组,且随着低氧处理时间的延长,氧分压下降更明显,可在低氧早期对大鼠的低氧情况进行评价。
病理切片在低氧处理12、24h组无论是海拔5000m还是6000m都未见明显异常改变,在低氧处理48h后出现脑、肺组织水肿和肺组织炎性浸润的病理改变。同样在低氧处理48h后出现湿/干重增加且差异有统计学意义。
综上所述,对于急性高原病大鼠模型复制的评价指标,水迷宫实验较病理切片和组织湿/干重比值敏感,在模拟海拔6000m低氧处理12h已经出现大脑记忆能力的下降,但该实验耗时长且实验造价高;组织病理切片和湿/干重在模拟高原环境短时间(24h)后均无明显改变,出现变化的时间在48h以后。而动脉血气分析在低氧处理早期(12h)即出现下降。对于急性高原病模型条件的探索,由于模拟海拔5000m处理12h因为脑功能和组织学均未出现变化;而模拟海拔5000m处理24h后和海拔6000m处理12h后均可认为出现脑记忆能力下降,且根据已有实验数据(未列出)在模拟海拔6000m,大鼠的水迷宫实验结果存在个体差异(部分水迷宫提示空间记忆能力变化不明显,部分出现记忆能力下降),提示水迷宫作为检测中枢神经系统功能尤其是记忆能力的一个敏感指标,反映了不同大鼠对低氧敏感性的差异,为进一步研究急性高原病个体差异的动物模型提供依据。
实验所用的低气压舱为经医用高压氧舱改造后的高低压两用舱,低压装填模拟高原可达10 000m。本实验过程中,实验人员经过渡仓进入实验舱内,在低气压模拟高原环境下直接开展Morris水迷宫探索实验进行模型动物记忆能力的检测。减少因干预条件变化带来的影响,提供了更为准确的数据结果。
本研究针对急性高原病模型复制过程中大鼠病理组织形态、大脑空间记忆能力、动脉血气以及肺、脑组织干湿重进行检测,根据查阅的文献选择2个海拔(5000m和6000m)和3个检测时间点(12、24、48h)作为模拟条件,发现不同指标在不同时间和海拔出现的变化有差异并对各个方法的优点劣势进行评价,对高原病防治的分子生物学研究构建正确的动物模型有重要意义。
[1]Li M, Gao XB, Yu J,et al. Current situation and progression of objective auxiliary diagnosis for acute mountain sickness[J]. Med J Chin PLA, 2013, 38(9): 777-780. [李明, 高旭滨, 余洁, 等. 急性高原反应客观辅助诊断的现状及展望[J]. 解放军医学杂志, 2013, 38(9): 777-780.]
[2]Luks AM, McIntosh SE, Grissom CK,et al. Wilderness medical sacidty practice guidelines for the prevention and treatment of acute altitude illness: 2014 update[J]. Wilderness Environ Med, 2014, 25(Suppl 4): S4-S14.
[3]Netzer N, Strohl K, Faulhaber M,et al. Hypoxia-related altitude illness[J]. J Travel Med, 2013, 20(4): 247-255.
[4]Wu TY, Li SZ, Hou SK. "Rescue the rescuers", how may it be prevented?—A special challenge in high altitude medicine during the Yushu Earthquake[J]. Negative, 2014, 5(2): 1-9. [吴天一, 李素芝, 候世科.“救援救援者”, 如何不再现?—玉树地震对高原医学的一个特殊挑战[J]. 医学争鸣, 2014, 5(2): 1-9.]
[5]MacInnis MJ, Carter EA, Koehle MS,et al. Exhaled nitric oxide is associated with acute mountain sickness susceptibility during exposure to normobaric hypoxia[J]. Respir Physiol Neurobiol, 2012, 180(1): 40-44.
[6]Colleen GJ, Andrew WS, Ryan CH,et al. Exploratory proteomic analysis of hypobaric hypoxia and acute mountain sickness in humans[J]. J Appl Physiol, 2014, 116(7): 937-944.
[7]Blood FR, Damour FE. Physiology of the rat at high altitudes[J]. Fed Proc, 1946, 5(1): 9.
[8]Reissmann K. Investigations on the mechanism of changes in the blood during high altitude adaptation in parabiotic rats[J]. Q Res Rep, 1948, 60(2): 8.
[9]Altland PD. Effects of discontinuous exposure to 25,000 ft simulated altitude on the body weight and reproductive system of immature rats[J]. Anat Rec, 1946, 96(4): 523.
[10] Ma HP, Wu JH, Gao RM,et al. Establishment of an animal model for acute mountain sickness with a decompression chamber[J]. Pharm J Chin PLA, 2013, 29(4): 301-304. [马慧萍, 吴金华, 高荣敏等. 低压氧舱模拟急性高原缺氧动物模型建立的初探[J]. 解放军药学学报, 2013, 29(4): 301-304.]
[11] Kanika J, Geetha S, Rajendra P,et al. Upregulation of cytoprotective defense mechanisms and hypoxia- responsive proteins imparts tolerance to acute hypobaric hypoxia[J]. High Alt Med Biol, 2013, 14(1): 65-77.
[12] Javier V O, Eduardo G, Casimiro J,et al. Human behaviour and development under high-altitude conditions[J]. Dev Sci, 2006, 9(4): 400-410.
[13] Charles VV, Michael TW. Morris water maze: procedures for assessing spatialand related forms of learning and memory[J]. Nat Protoc, 2006, 1(2): 848-858.
[14] Barbara SH, Micheal JS, David IW,et al. Hypobaric hypoxia impairs spatial memory in an elevation- dependent fashion[J]. Behavioral and Neural Biology, 1994, 62(3): 244-252.
[15] Vorhees CV, Williams MT. Value of water mazes for assessing spatial and egocentric learning and memory in rodent basic research and regulatory studies[J]. Neurotoxicol Teratol, 2014, 45(9): 75-90.
[16] Burtscher M, Wille M, Menz V,et al. Symptom progression in acute mountain sickness during a 12-hour exposure to normobaric hypoxia equivalent to 4500m[J]. High Alt Med Biol, 2014, 15(4): 446-451.
[17] Ren YS, Fu ZM , Shen WM,et al. Incidence of high altitude illnesses among unacclimatized persons who acutely ascended to Tibet[J]. High Alt Med Biol, 2010, 11(1): 39-42.
[18] Chen GZ, Qin J, Yu J,et al. Incidence of acute mountain sickness in young adults at 3200 meters: comparison of the Lake Louise Scoring and Chinese Scoring Systems[J]. Genet Mol Res, 2013, 12(4): 6790-6801.
[19] Jain V, Baitharu I, Prasad O,et al. Enriched environment prevents hypobaric hypoxia induced memory impairment and neurodegeneration: role of BDNF/PI3K/GSK3b pathway coupled with CREB activation[J]. PLoS One, 2013, 8(5): 1-11.
[20] Hota SK, Barhwal K, Baitharu I,et al. Bacopa monniera leaf extract ameliorates hypobaric hypoxia induced spatial memory impairment[J]. Neurobiol Dis, 2009, 34(1): 23-39.
[21] Zhang YC, Li YM, Jia YY,et al. Influence of simulated high attitude anoxia on rats learning and memory and pathological changes of brain tissue[J]. Med J Nat Def Forces Southwest Chin, 2014, 24(4): 432-435. [张艳超, 李运明, 贾玉英等, 模拟高原缺氧对大鼠学习记忆的影响及脑组织病理改变[J]. 西南国防医药, 2014, 24(4): 432-435.]
Reproduction of a rat model of acute high-altitude sickness and evaluation of its related indexes
WANG Chi1, YAN Mu-yang2, DUAN Jin-yan1, CHEN Jing-wen2, HUANG Jie1, GUAN Xu2, XIANG Dai-jun1, JIANG Hui2, WANG Cheng-bin11Department of Clinical Laboratory,2Department of Hyperbaric Chamber, General Hospital of PLA, Beijing 100853, China
*< class="emphasis_italic">Corresponding authors. WANG Cheng-bin, E-mail: wangcb301@126.com; JKANG Hui, E-mail: jm7111@163.com
s. WANG Cheng-bin, E-mail: wangcb301@126.com; JKANG Hui, E-mail: jm7111@163.com
ObjectiveTo reproduce a rat model of acute mountain sickness by using a hypobaric chamber to simulate the plateau environment, and to study the related physiological parameters.MethodsA total of 70 male Wistar rats were randomly divided into normal control (NC) group, and 6 hypobaric hypoxia groups (10 each) in which rats were housed in a hypobaric chamber and exposed to the enviroment simulating high altitude of 5000m and 6000m for 12h, 24h and 48h respectively. Memory Morris water maze test was conducted to evaluate the changes in working memory of rats in space. Histological changes in lung and brain tissue were observed. Blood from abdominal aorta was collected to analyze the parameters of blood gas. The histopathological changes in lung and cerebrum were observed, and their wet/dry ratios were calculated.ResultsReduction in activity or even death was found in hypobaric hypoxia groups, and arterial PaO2was significantly decreased in all rats of hypobaric hypoxia groups. Compared with NC group, rats exposed to a simulated altitude of 5000m for longer than 24h and 6000m for longer than 12h exhibited longer latency period in finding the hidden platform, shorter expedition time for target quadrant, and less frequency of platform crossing in the Morris water maze test (P<0.05). After exposure to simulated altitudes of both 5000m and 6000m for 48h, pathological changes were observed in lung and cerebrum, and wet/dry ratio of lung and brain was significantly increased compared with that of NC group.ConclusionIndexes of rat model of acute mountain sickness by using a hypobaric chamber show different changes at respective time points. Therefore the changes in multiple physiological indexes of mountain sickness can be assessed by using this animal model.
acute mountain sickness; models; animal; water maze
R339.54;R322.35
A
0577-7402(2015)09-0716-06
10.11855/j.issn.0577-7402.2015.09.06
2015-05-05
2015-07-30)
(责任编辑:李恩江)
王驰,硕士研究生。主要从事急性高原病发病机制及药物防治研究
100853 北京 解放军总院临床检验科(王驰、段晋燕、向代军、王成彬);100853 北京 解放军总医院康复医学中心高压氧科(晏沐阳、陈静雯、黄杰、关旭、姜辉)
王成彬,E-mail:wangcb301@126.com;姜辉,E-mail:jm7111@163.com
