AKT抑制剂对慢粒急变期K562细胞中Wnt/β-catenin信号通路的影响及其效应观察
2015-06-28刘张玲胡晶黄峥兰李会刘毅冯文莉
刘张玲,胡晶,黄峥兰,李会,刘毅,冯文莉
AKT抑制剂对慢粒急变期K562细胞中Wnt/β-catenin信号通路的影响及其效应观察
刘张玲,胡晶,黄峥兰,李会,刘毅,冯文莉
目的探讨PI3K-AKT信号通路靶向抑制剂AKTi Ⅳ对慢性粒细胞白血病(CML)急变期细胞K562的影响及其对Wnt/β-catenin信号通路的调控作用。方法取处于对数生长期的K562细胞,分别加入0、2.5、5、10μmol/L 的AKTi Ⅳ进行处理,采用MTT法检测其对细胞增殖的影响,甲基纤维素克隆形成实验检测细胞的克隆形成能力,Western blotting检测K562细胞中pAKT(Thr308)、pGSK-3β(Ser9)蛋白表达情况,荧光定量PCR和Western blotting检测β-catenin及其下游靶基因c-myc、cyclin D1 mRNA和蛋白表达情况。结果AKTi Ⅳ作用6、10、16h后,K562细胞的增殖能力以及克隆形成能力明显受抑,且作用10h时抑制效果最好。2.5、5、10μmol/L AKTi Ⅳ处理K562细胞10h后,PI3KAKT通路明显受到抑制,pAKT(Thr308)蛋白表达依次减少。5μmol/L AKTi Ⅳ作用K562细胞10h后,pGSK-3β(Ser9)及β-catenin蛋白表达明显减少,而β-catenin mRNA表达水平无明显改变。5μmol/L AKTi Ⅳ作用K562细胞10h后,β-catenin下游靶基因c-myc、cyclin D1的mRNA和蛋白表达水平均明显降低。结论AKTi Ⅳ可抑制慢粒急变期K562细胞的增殖和克隆形成能力,其机制可能是通过抑制Wnt/β-catenin信号通路阻断细胞的生长信号转导。
白血病,髓系,慢性,BCR-ABL阳性;β连环素;Wnt信号通路;K562细胞
慢性粒细胞白血病(chronic myeloid leukemia,CML)是起源于造血干细胞的恶性增殖性疾病,以t(9;22)(q34;q11)形成的BCR/ABL融合基因为发病特征,该基因编码的BCR/ABL融合蛋白具有高酪氨酸激酶活性[1],能激活细胞内多条信号通路,使白血病细胞恶性增殖、凋亡受阻[2-3],其中PI3K-AKT、JAK-STAT5、MAPK-ERK、RAS-RAF等为最重要的信号通路,在CML中异常活化,与CML的发生发展密切相关[4]。CML在临床上分为慢性期、加速期和急变期,绝大部分CML患者最终进入急变期,且预后不良。因此,探明慢粒急变的具体分子机制具有重要意义。β连环素(β-catenin)是Wnt信号通路的关键调控因子,参与造血细胞的发育及成熟,决定造血细胞的自我更新及分化[5]。研究显示,β-catenin在慢粒急变期患者体内的表达量随bcr/abl基因的扩增而增高,抑制β-catenin表达能够降低慢粒的耐药性并延缓其进入急变期[6-7]。但慢粒急变期细胞中BCR/ABL调控β-catenin的具体分子机制目前尚不清楚。本研究拟探讨PI3K-AKT信号通路靶向抑制剂AKTi Ⅳ对慢粒急变期细胞K562的作用,以明确PI3K-AKT信号通路对慢粒急变期的影响及其对Wnt/β-catenin通路的调控作用。
1 材料与方法
1.1 细胞和试剂 K562细胞由本实验室保存,用含有10%胎牛血清(Gibco,USA)的RPMI 1640培养液常规培养,置于37℃、5%CO2、饱和湿度培养箱中培养。AKTi Ⅳ、总AKT、pAKT(Thr308)、pGSK-3β(Ser9)、总GSK-3β和β-catenin抗体购自美国CST公司,荧光定量PCR试剂盒购自TaKaRa公司,c-myc、cyclin D1抗体购自Origene公司,β-actin抗体、辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗购自Santa Cruz公司。MTT试剂、甲基纤维素、二甲基亚砜购自Sigma公司。
1.2 MTT法检测AKTi Ⅳ对K562细胞增殖能力的影响 取对数生长期的K562细胞,按5×103个/孔密度接种于96孔培养板,分别给予0(PBS处理组)、2.5、5、10μmol/L的AKTi Ⅳ处理,同时设试剂对照组以减少试剂本身吸光度值对实验的影响。每组设5个复孔。分别培养6、10、16h后,加入50μl 2mg/ml MTT溶液,避光培养4h,2000r/min离心10min,吸弃上清,每孔加入100μl二甲基亚砜,摇匀溶解后,在490nm处测量各孔吸光度(A)值,并按以下公式计算细胞增殖抑制率。细胞增殖抑制率=[1-(药物处理组A值-试剂对照组A值)/(PBS处理组A值-试剂对照组A值)]。
1.3 克隆形成实验检测AKTi Ⅳ对K562细胞克隆形成能力的影响 收集处于对数生长期的K562细胞,分别加入0、2.5、5、10μmol/L的AKTi Ⅳ处理10h,处理后的K562细胞加入含0.9%甲基纤维素的24孔培养板中培养(500个/孔),每组设3个平行孔,培养10d后计数克隆数,50个细胞以上定义为一个集落,比较各组克隆形成数的差异。
1.4 荧光定量PCR检测β-catenin、c-myc、cyclin D1 mRNA的表达 收集对数生长期的K562细胞,用5μmol/L AKTi Ⅳ处理10h后,常规提取总RNA,反转录成cDNA,以其为模板进行荧光定量PCR检测。引物序列见表1。反应条件为:95℃预变性30s;95℃变性10s,退火20s(β-catenin 54℃,c-myc 和cyclin D1 51℃),72℃延伸30s,共39个循环。65~95℃记录融解曲线,获得初始循环数(Ct)值,以2-ΔΔCt法计算β-catenin、c-myc、cyclin D1 mRNA的相对表达水平。试验重复3次。
1.5 Western blotting法检测蛋白水平的表达 采用0、2.5、5、10μmol/L AKTi Ⅳ处理K562细胞10h后,提取细胞总蛋白测定其浓度,经8% SDSPAGE胶电泳分离、转膜,分别孵育总AKT、pAKT(Thr308)、pGSK-3β(Ser9)、总GSK-3β和β-catenin抗体,抗体以1:1000稀释,4℃孵育6~8h,洗膜后,室温孵育IgG-HRP二抗1h,采用ECL化学发光法检测目的蛋白表达情况。采用Quantity One软件对Western blotting条带进行定量分析。
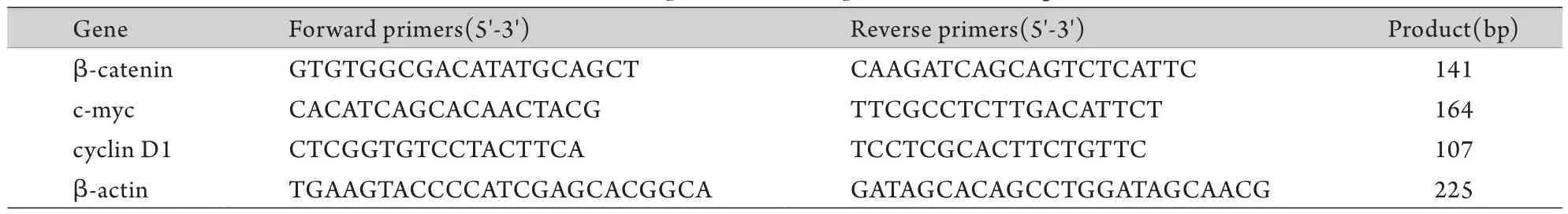
表1 扩增基因引物序列Tab. 1 The sequence of PCR primers for each gene
1.6 统计学处理 采用SPSS 17.0软件进行统计分析,组间比较采用单因素方差分析(One-Way ANOVA),进一步两两比较采用SNK-q法。P<0.05为差异有统计学意义。
2 结 果
2.1 AKTi Ⅳ对K562细胞增殖能力的影响 MTT法检测结果显示,2.5、5、10μmol/L AKTi Ⅳ对K562细胞生长均有抑制作用,处理后6h即出现明显的抑制作用,10h时抑制作用最强,16h后抑制效果减弱,表明PI3K-AKT靶向抑制剂处理K562细胞10h时抑制作用最强(图1),药物处理组与PBS处理组之间的差异有统计学意义(P<0.05)。
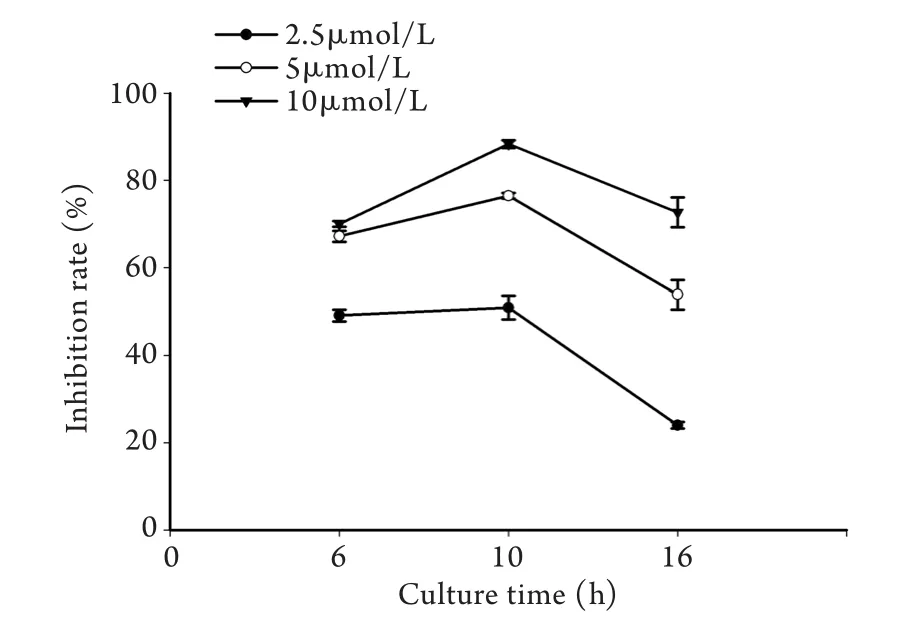
图1 不同浓度AKTi Ⅳ处理K562细胞6、10、16h后对细胞增殖的影响Fig. 1 K562 cells growth treated with different concentrations of AKTi Ⅳ for 6, 10, 16 hours (MTT assay)
2.2 AKTi Ⅳ对K562细胞克隆形成能力的影响 克隆形成实验结果显示,2.5、5、10μmol/L AKTi Ⅳ处理10h后,K562细胞克隆形成数分别为258±20、164±13、81±16个/孔,与PBS处理组(325±30个/孔)比较明显减少,差异均有统计学意义(P<0.05,图2)。
2.3 AKTi Ⅳ对PI3K-AKT信号通路的抑制作用 Western blotting结果显示,用2.5、5、10μmol/L AKTi Ⅳ处理K562细胞10h后,PI3K-AKT信号通路被抑制,pAKT(Thr308)蛋白表达明显减少,与PBS处理组比较差异均有统计学意义(P<0.05,图3)。选择AKTi Ⅳ的最佳作用浓度5μmol/L处理K562细胞进行后续实验。
2.4 AKTi Ⅳ对β-catenin mRNA和蛋白及pGSK-3β(Ser9)蛋白表达的影响 荧光定量PCR和Western blotting结果显示,经5μmol/L AKTi Ⅳ处理10h后,K562细胞中β-catenin mRNA表达水平无明显改变,与PBS处理组比较差异无统计学意义(P>0.05),而β-catenin、pGSK-3β(Ser9)蛋白表达水平明显降低(P<0.05,图4)。

图2 AKTi Ⅳ对K562细胞克隆形成能力的影响Fig. 2 Effect of AKTi Ⅳ on the colony forming ability of K562 cells
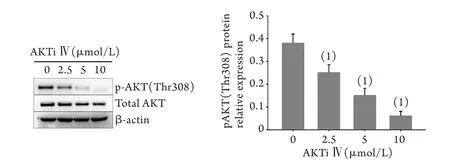
图3 AKTi Ⅳ处理后K562细胞中pAKT(Thr308)和总AKT的蛋白表达变化Fig. 3 The protein levels of pAKT(Thr308) and total AKT in AKTi Ⅳ treated K562 cells (1)P<0.05 compared with 0μmol/L (PBS group)
2.5 AKTi Ⅳ对β-catenin下游靶基因c-myc、cyclin D1 mRNA和蛋白表达的影响 荧光定量PCR和Western blotting结果显示,经5μmol/L AKTi Ⅳ处理10h后,K562细胞中c-myc、cyclin D1 mRNA和蛋白表达水平均明显下降,与PBS处理组比较差异有统计学意义(P<0.05,图5)。
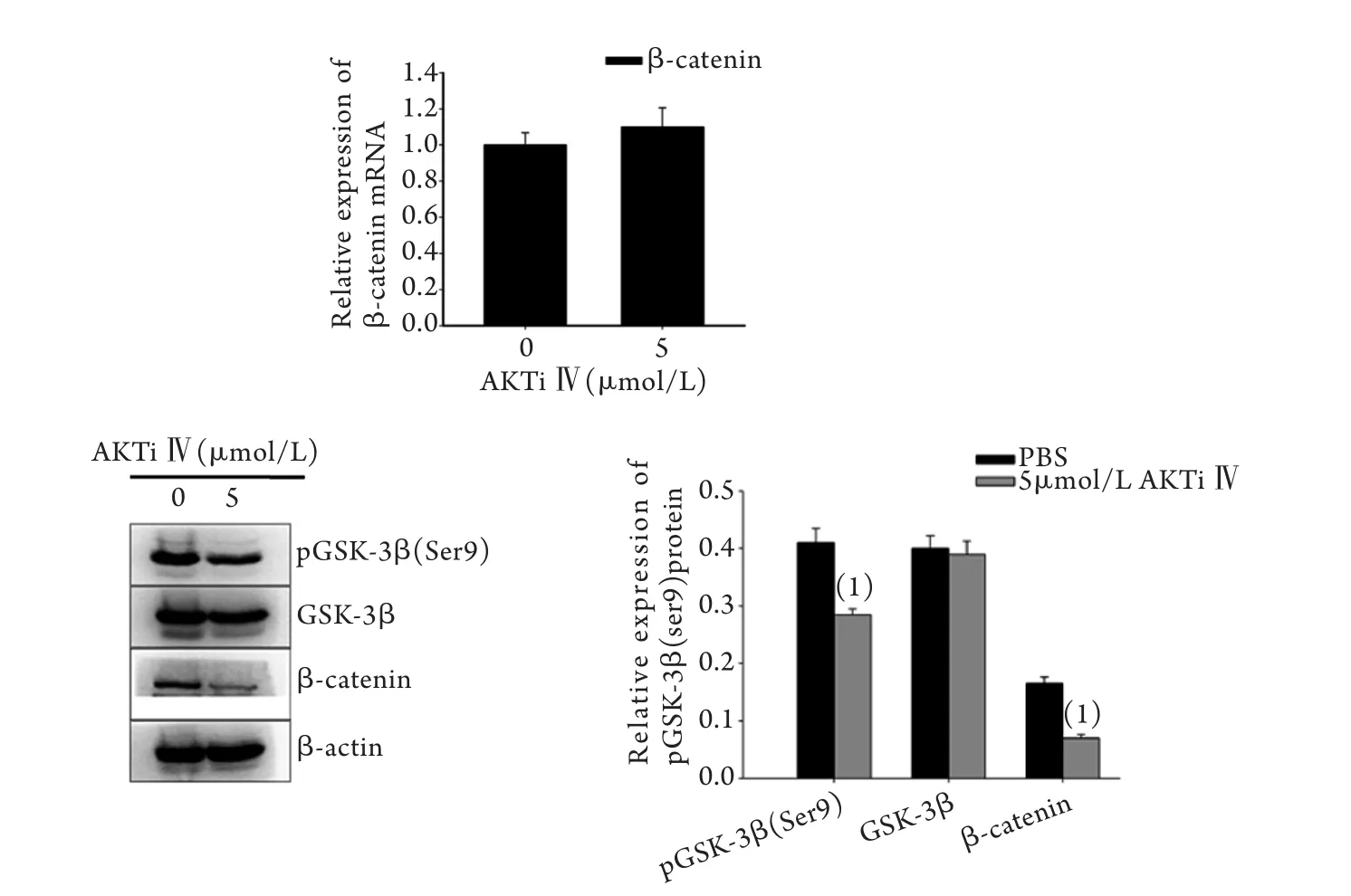
图4 AKTi Ⅳ处理后K562细胞中β-catenin mRNA和蛋白及pGSK-3β(Ser9)蛋白表达的变化Fig. 4 Influence of AKTi Ⅳ on the expressions of β-catenin mRNA and protein and pGSK-3β(Ser9) protein in K562 cells (1)P<0.05 compared with 0μmol/L (PBS group)
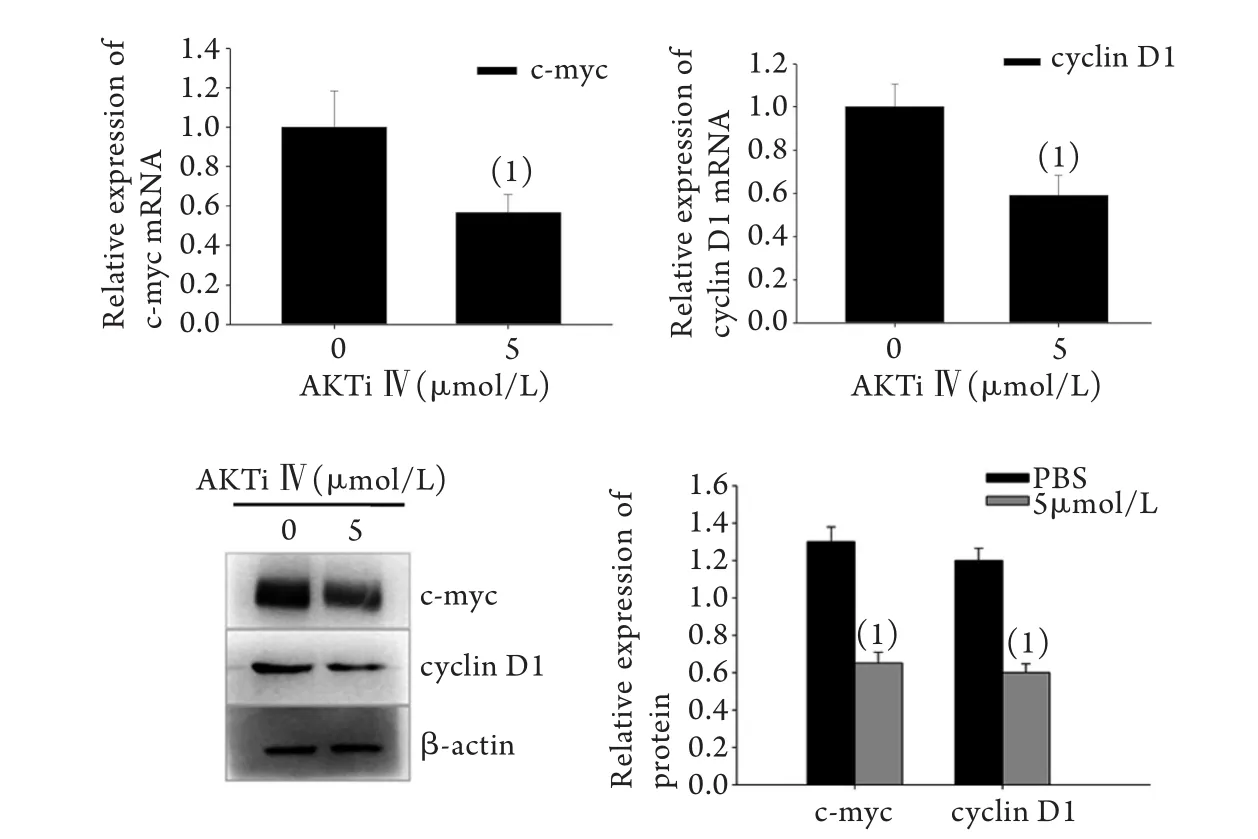
图5 AKTi Ⅳ处理后K562细胞中c-myc、cyclin D1 mRNA和蛋白表达的变化Fig. 5 The mRNA and protein levels of c-myc and cyclin D1 in K562 cells pre-treated with AKTi Ⅳ(1)P<0.05 compared with 0μmol/L (PBS group)
3 讨 论
Wnt/β-catenin信号通路激活发生于各种类型的白血病中,是白血病细胞恶性增殖及凋亡受阻的一个重要原因,对于白血病细胞的恶性转化具有重要的调控作用[8]。β-catenin是该通路的关键调控因子[9],它在蛋白水平上受Wnt信号蛋白的调控。通常情况下,β-catenin与轴蛋白(AXIN1)、酪蛋白激酶1(CK1)、糖原合成激酶-3β(GSK-3β)、大肠腺瘤息肉(APC)蛋白结合形成复合物,促进GSK-3β 对β-catenin的磷酸化,使β-catenin在胞质中发生蛋白酶体依赖的降解,最终使β-catenin在细胞质内的游离量保持在较低水平[10]。当细胞癌变或者受到刺激时,Wnt信号通路的相关蛋白无法使β-catenin被磷酸化而降解[11],导致胞质中的β-catenin大量积累并转位入核,与转录因子LEF/TCF-4结合,激活c-myc、cyclin D1、纤维连接蛋白(fibronectin)等下游效应分子的转录,使细胞发生恶性转化[12-14]。既往对β-catenin的研究主要集中在BCR/ABL本身与β-catenin的直接或者间接作用,并未从信号转导的角度探讨BCR/ABL下游信号通路对β-catenin的作用。
PI3K-AKT信号通路是BCR/ABL下游的关键信号通路之一,其持续激活贯穿于CML病程的各个时期[15]。该通路的重要成分AKT可以通过磷酸化GSK-3β第9位的丝氨酸而使GSK-3β失活,失活的GSK-3β无法使胞质中的β-catenin被磷酸化而降解,从而使β-catenin入核增加,激活下游基因的转录[16]。已有研究证实PI3K-AKT信号通路与β-catenin之间存在一定联系[17-19]。Han等[17]研究发现,通过PI3KAKT信号通路调控β-catenin的转录可抑制胶质瘤细胞U251和LN229的生长与增殖。另有研究发现,PI3K-AKT信号通路可通过调控β-catenin/GSK-3β的活性而调节ZEB1基因的转录活性,进而影响膀胱癌细胞的侵袭和转移能力[18]。Milward等[19]报道丙型肝炎病毒(HCV)的NS5A蛋白可通过激活PI3K-AKT通路而致GSK-3β失活,从而激活β-catenin,导致肝癌的发生。因此,我们推测在CML中PI3K-AKT信号通路可能以GSK-3β为连接桥梁调节Wnt/β-catenin信号通路,从而影响细胞的增殖与存活。
本研究采用PI3K-AKT信号通路的靶向抑制剂AKTi Ⅳ处理慢粒急变期细胞K562,观察其对慢粒细胞增殖以及克隆形成能力的影响,同时检测其对β-catenin及其下游靶基因表达水平的影响。结果显示,AKTi Ⅳ可抑制K562细胞的增殖及克隆形成能力,其原因考虑与抑制β-catenin蛋白的表达有关,但本研究中β-catenin mRNA的表达水平无明显改变,提示AKT抑制剂从翻译水平而非转录水平调控β-catenin的生物学活性。同时,AKT抑制剂处理细胞后,GSK-3β的磷酸化水平降低,使活化的GSK-3β对β-catenin的磷酸化降解能力增强,从而使β-catenin蛋白表达下降,表明AKT抑制剂可通过抑制AKT的磷酸化而增强GSK-3β的活性,从而降低β-catenin蛋白的表达。此外,经AKTi Ⅳ处理后,Wnt/β-catenin/GSK-3β通路的下游靶分子c-myc、cyclin D1 mRNA和蛋白表达量均明显降低,进一步说明了在慢粒中PI3K-AKT信号通路对Wnt/β-catenin通路的抑制作用。
综上所述,本研究从信号转导通路角度在慢粒急变期细胞中证实PI3K-AKT信号通路的靶向抑制剂AKTi Ⅳ能够通过活化GSK-3β而抑制Wnt/ β-catenin信号通路的活性,进而抑制细胞的增殖和克隆形成,为进一步研究CML急变的具体分子机制提供了新思路。
[1]Xiao H, Wang HX, Tao K,et al. Location of CTP-OD1-HA and CTP-OD2-HA fusion peptide in K562 cells and its interaction with BCR-ABL protein[J]. Med J Chin PLA, 2013, 38(11): 896-899. [肖恒, 王海霞, 陶崑, 等. CTP-OD1-HA和CTP-OD2-HA融合肽在K562细胞中的定位及其与BCR-ABL蛋白的相互作用[J]. 解放军医学杂志, 2013, 38(11): 896-899.]
[2]Quintás-Cardama A, Cortes J. Molecular biology of BCR-ABL1-positive chronic myeloid leukemia[J]. Blood, 2009, 113(8): 1619-1630.
[3]Li X, Zhang B, Ma J,et al. Influence of Akt inhibitor MK2206 in proliferation and apoptosis of tongue squamous cell carcinoma TCA-8113 cells and its mechanisms[J]. J Jilin Univ (Med Ed), 2014, 40(3): 616-620. [李翔, 张斌, 马竟, 等. Akt抑制剂MK2206对舌鳞癌TCA-8113细胞增殖和凋亡的影响及其作用机制[J]. 吉林大学学报(医学版), 2014, 40(3): 616-620.]
[4]Steelman LS, Pohnert SC, Shelton JG,et al. JAK//STAT, Raf// MEK//ERK, PI3K/Akt and BCR-ABL in cell cycle progression and leukemogenesis[J]. Leukemia, 2004, 18(2): 189-218.
[5]Reya T, Duncan AW, Ailles L,et al. A role for Wnt signalling in self-renewal of haematopoietic stem cells[J]. Nature, 2003, 423(6938): 409-414.
[6]Jamieson CHM, Ailles LE, Dylla SJ,et al. Granulocytemacrophage progenitors as candidate leukemic stem cells in blast-crisis CML[J]. N Engl J Med, 2004, 351(7): 657-667.
[7]Heidel FH, Bullinger L, Feng Z,et al. Genetic and pharmacologic inhibition of β-catenin targets imatinib-resistant leukemia stem cells in CML[J]. Cell stem cell, 2012, 10(4): 412-424.
[8]Fung TK, Leung AY, So CWE. The Wnt/β-catenin pathway as a potential target for drug resistant leukemic stem cells[M]// Stem cells and cancer stem cells. Hayat MA, Ed. Berlin: Springer, 2013. 163-172.
[9]Li SS, Sun Y, Ding H,et al. β-catenin expressions in different subtypes of breast cancer and its clinical significance[J]. J Shandong Univ (Health Sci), 2013, 51(3): 107-110, 112. [李珊珊, 孙颖, 丁涣, 等. β-catenin在不同亚型乳腺癌中的表达及其临床意义[J]. 山东大学学报(医学版), 2013, 51(3): 107-110, 112.]
[10] MacDonald BT, Tamai K, He X. Wnt/β-catenin signaling: components, mechanisms, and diseases[J]. Dev Cell, 2009, 17(1): 9-26.
[11] Zhang GH, Liu JW, Su LS,et al. Effect of aspirin on expression of SOX7 and Wnt/β-catenin signaling pathway in human ovarian cancer tissue and SKOV 3 cells[J]. J Zhengzhou Univ (Med Sci), 2015, 50(2): 240-243. [张根豪, 刘俊文, 苏利沙, 等. 阿司匹林对人卵巢癌组织和SKOV3细胞SOX7表达和Wnt/β-catenin信号通路的影响[J]. 郑州大学学报(医学版), 2015, 50(2): 240-243.]
[12] He TC, Sparks AB, Rago C,et al. Identification of c-MYC as a target of the APC pathway[J]. Science, 1998, 281(5382): 1509-1512.
[13] Tetsu O, McCormick F. β-catenin regulates expression of cyclin D1 in colon carcinoma cells[J]. Nature, 1999, 398(6726): 422-426.
[14] Qin BB, Li YQ, Li XL,et al. Expressions of key molecules of Wnt/β-catenin signal pathway in NK/T-cell lymphoma tissue and their significances[J]. J Jilin Univ (Med Ed), 2015, 4(2): 230-234, 438. [秦贝贝, 李亚青, 李小丽, 等. Wnt/β-catenin通路关键分子在NK/T细胞淋巴瘤组织中的表达及其临床意义[J]. 吉林大学学报(医学版), 2015, 41(2): 230-234, 438.]
[15] Calabretta B, Perrotti D. The biology of CML blast crisis[J]. Blood, 2004, 103(11): 4010-4022.
[16] McCubrey JA, Steelman LS, Bertrand FE,et al. Multifaceted roles of GSK-3 and Wnt/beta-catenin in hematopoiesis and leukemogenesis: opportunities for therapeutic intervention[J]. Leukemia, 2014, 28(1): 15-33.
[17] Han L, Yang Y, Yue X,et al. Inactivation of PI3K/AKT signalinginhibits glioma cell growth through modulation of β-cateninmediated transcription[J]. Brain Res, 2010, 1366: 9-17.
[18] Wu K, Fan J, Zhang L,et al. PI3K/Akt to GSK3β/β-catenin signaling cascade coordinates cell colonization for bladder cancer bone metastasis through regulating ZEB1 transcription[J]. Cell Signal, 2012, 24(12): 2273-2282.
[19] Milward A, Mankouri J, Harris M. Hepatitis C virus NS5A protein interacts with beta-catenin and stimulates its transcriptional activity in a phosphoinositide-3 kinase-dependent fashion[J]. J Gen Virol, 2010, 91(Pt2): 373-381.
Influence of AKT inhibitor on Wnt/β-catenin pathway in chronic myeloid leukemia K562 cells
LIU Zhang-ling, HU Jing, HUANG Zheng-lan, LI Hui, LIU Yi, FENG Wen-li*
Key Laboratory of Medical Diagnostics of Ministry of Education, Faculty of Laboratory Medicine, Chongqing Medical University, Chongqing 400016, China
*< class="emphasis_italic">Corresponding author, E-mail: fengwlcqmu@sina.com
, E-mail: fengwlcqmu@sina.com
This work was supported by Natural Science Foundation of Chongqing Science and Technology Commission (cstc2012jjA10013)
ObjectiveTo investigate the impact of PI3K-AKT pathway inhibitor (AKTi Ⅳ) on the acute crisis of chronic myeloid leukemia (CML) and its regulatory effect on PI3K-AKT pathway in Wnt/β-catenin signal pathway.MethodsK562 cells were cultured to logarithmic growth phase, and they were treated with 0, 2.5, 5, 10μmol/L AKTi Ⅳ respectively. Cell growth was determined with MTT test. The ability of cell colonization was assessed by colony-forming assay. The protein expression of pAKT (Thr308) and pGSK-3β(Ser9) was determined by Western blotting. The protein expression and mRNA levels of β-catenin and its down-stream targets c-myc and cyclin D1 were analyzed by Western blotting and realtime fluorescence quantitative polymerse chain reaction (Q-PCR), respectively.ResultsCell growth and colony-forming ability of K562 cells were inhibited significantly after treatment with AKTi Ⅳ for 6, 10, 16h, and the best exposure time for K562 cells was 10h. PI3K-AKT pathway was inhibited obviously and the protein level of pAKT (Thr308) was lowered apparently after 2.5, 5, 10μmol/L AKTi Ⅳ treatment. When K562 cells were treated by 5μmol/L AKTi Ⅳ for 10h, pGSK-3β (Ser9) and β-catenin protein levels were lowered significantly, while the mRNA of β-catenin was not affected. The mRNA and protein levels of c-myc and cyclin D1 in the downstream of β-catenin were also decreased obviously after treatment with 5μmol/L AKTi Ⅳ for 10h.ConclusionAKTi Ⅳ can inhibit the proliferation and colony-forming ability of K562 cells in critical stage of CML. The mechanism may be related to down-regulation of expression of Wnt/β-catenin pathway by blocking the signal transduction of cell growth.
leukemia, myelogenous, chronic, BCR-ABL positive; β-catenin; Wnt signaling pathway; K562 cells
R733.722
A
0577-7402(2015)09-0710-06
10.11855/j.issn.0577-7402.2015.09.05
2015-01-15;
2015-06-28)
(责任编辑:李恩江)
重庆市科委自然科学基金项目(cstc2012jjA10013)
刘张玲,硕士研究生。主要从事白血病发病机制及基因治疗方面的研究
400016 重庆 重庆医科大学检验医学院临床检验诊断学教育部重点实验室(刘张玲、胡晶、黄峥兰、李会、刘毅、冯文莉)
冯文莉,E-mail:fengwlcqmu@sina.com
