唑吡坦预防急性高原反应随机双盲安慰剂对照研究
2015-06-28黄永涛覃军高旭滨陈国柱郑程荣杨杰黄岚
黄永涛,覃军,高旭滨,陈国柱,郑程荣,杨杰,黄岚
唑吡坦预防急性高原反应随机双盲安慰剂对照研究
黄永涛,覃军,高旭滨,陈国柱,郑程荣,杨杰,黄岚
目的观察急性高原暴露后唑吡坦预防急性高原反应(AMS)的效果。方法采用高原现场随机双盲对照的研究方法,将40名受试者随机分为唑吡坦组与安慰剂组,分别在平原与高原采集一般资料、血压、心率、血氧饱和度、匹兹堡睡眠质量指数评分、AMS评分及体能测试结果。结果急性高原暴露后,唑吡坦组匹兹堡睡眠质量指数评分明显低于安慰剂组(P=0.047)。唑吡坦组6min步行距离明显大于安慰剂组(P=0.009)。不同时间点唑吡坦组AMS发病率均明显低于安慰剂组(P值分别为0.019、0.014、0.025、0.026),其中唑吡坦组各时间点的重度AMS发病率均低于安慰剂组(P值分别为0.047、0.044、0.031和0.020)。急性高原暴露20h后,唑吡坦组虚弱、疲劳、眩晕症状明显轻于安慰剂组(P<0.05)。急性高原暴露后两组心率、血压、氧饱和度、体力活动能力、左右手握力无明显差异(P>0.05)。结论唑吡坦能减轻AMS症状,降低AMS发病率,可望成为预防AMS的新选择。
唑吡坦;急性高原反应;高原;睡眠障碍
目前用于预防急性高原反应(acute mountain sickness,AMS)的药物种类繁多,美国FDA推荐使用的唯一预防AMS的药物是乙酰唑胺,但有研究表明,快速进入高原时,乙酰唑胺与阿司匹林和安慰剂相比,并未能显著降低AMS的发生率[1]。此外,地塞米松虽也能有效预防AMS,但不良反应较大,使其应用受到限制[2]。高原睡眠障碍既是AMS主要临床表现之一,也是影响AMS发生与发展的独立因素[3]。非苯二氮类药物唑吡坦半衰期短、安全性好[4],既往小样本研究发现唑吡坦能有效改善高原睡眠障碍并有益于维持体力、降低AMS评分[5]。本研究采用高原现场随机、对照、双盲临床研究方法,观察唑吡坦在改善高原睡眠障碍、促进人体习服、减轻AMS症状等方面的效果。
1 资料与方法
1.1 研究对象 按照纳入排除标准纳入40名受试者。纳入标准:①年龄18~32岁;②平原无睡眠障碍;③受试者签署知情同意书。排除标准:①近期有服用安眠药物史;②依从性差;③药物过敏;④鼾症;⑤既往有长期高原暴露史;⑥有精神、神经系统疾病及其他夹杂症者。本研究通过第三军医大学新桥医院医学伦理委员会批准。所有受试者志愿参与本研究并签署知情同意书。
1.2 受试者分组及服药方法 采用随机、双盲、对照临床研究方法,将40名受试者按随机数字法分为唑吡坦组与安慰剂组。用药方法:唑吡坦(杭州赛诺菲民生制药有限公司生产)10mg/次,1次/d,睡前口服。安慰剂由第三军医大学药理学院制作,并经第三军医大学辐照中心辐照消毒处理,服用方法同唑吡坦。药品由第三方编号、分装,并标明服药时间、剂量、方法。在急进高原前1晚开始服药,连续服用7d(图1)。
1.3 急进高原具体行程及数据采集 研究对象于2013年7月3日开始乘坐汽车驶向高原,于7月4日进入海拔2500m以上高原地区,最终历时120h至海拔3900m。平原数据包括受试者年龄、身高、体重、体重指数(body mass index,BMI)、心率(heart rate,HR)、血压(blood pressure,BP)、血氧饱和度(oxygen saturation,SpO2)、匹兹堡睡眠质量指数(pittsburgh sleep quality index,PSQI)评分和体能测试(physical fitness test),出发前2d采集。高原数据包括HR、BP、SpO2、PSQI评分、体能测试、AMS评分。其中PSQI评分在服药结束后采集,AMS评分在不同海拔高度多次采集(图1)。实际完成39名,1名因个人原因失访。
1.4 HR、BP、SpO2的检测 受试者静息时取坐位,采用美国NONIN9500指夹式脉搏血氧仪测量SpO2,采用日本OMRON HEM6200手腕式电子血压计测量HR、BP,重复测量3次取平均值。
1.5 体能测试 6min步行试验按照2002年美国胸腔学会6min步行试验指南[6](ATS2002)的具体步骤实施。按照中国人民解放军总后勤部士兵体能测量和评价(GJB1337-92)标准[7],采用二级台阶负荷试验测定体力活动能力(physical work capacity170,PWC170)。根据《中国国民体质测定标准手册》推荐的方法[8],采用手部电子握力计测左右手最大握力。
1.6 睡眠质量与AMS评分 急性高原暴露后第7天行PSQI评分[9],PSQI总分>7提示有睡眠障碍。AMS评分采用路易斯湖标准(LLS)[10]。
1.7 统计学处理 采用SPSS 17.0统计软件包进行统计分析。计数资料以百分率表示,两组间的比较采用χ2检验,计量资料以表示,两组间的比较采用独立样本t检验。P<0.05为差异有统计学意义。
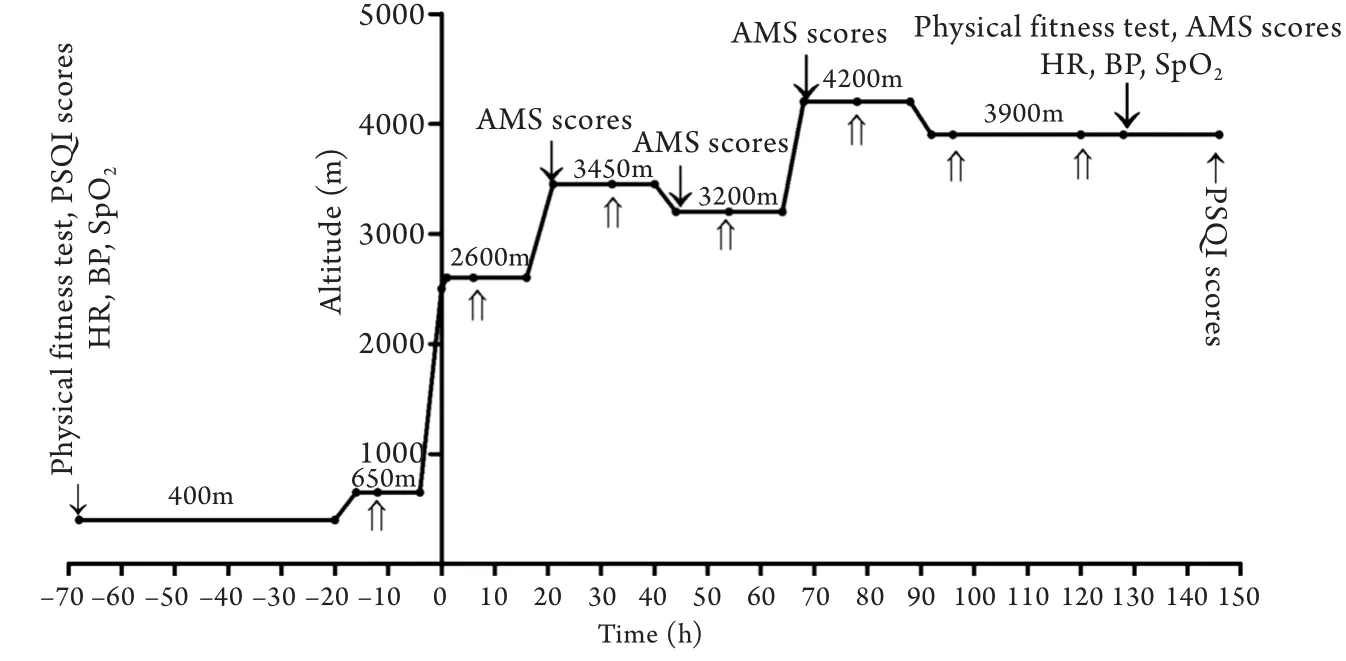
图1 急进高原具体行程与服药、数据采集时间点Fig. 1 Ascent profile, medication and examinations in plain and plateauThe X axis 0 point (2500m) was defined as the earliest time of high-altitude exposure; The double arrow shows the time of oral drug; The single arrow shows the data acquisition time
2 结 果
2.1 平原资料 唑吡坦组与安慰剂组在平原的各项指标(年龄、身高、体重、BMI、HR、BP、SpO2、PSQI评分和体能)差异均无统计学意义(P>0.05,表1)。
2.2 急性高原暴露128h后各项指标比较 急性高原暴露后两组间HR、BP、SPO2差异无统计学意义(P>0.05),安慰剂组PSQI评分明显高于唑吡坦组(P<0.05),唑吡坦组6min步行距离(six-minutes walk distance,6MWD)明显高于安慰剂组(P<0.05),左右手握力及PWC170差异无统计学意义(P>0.05,表2)。
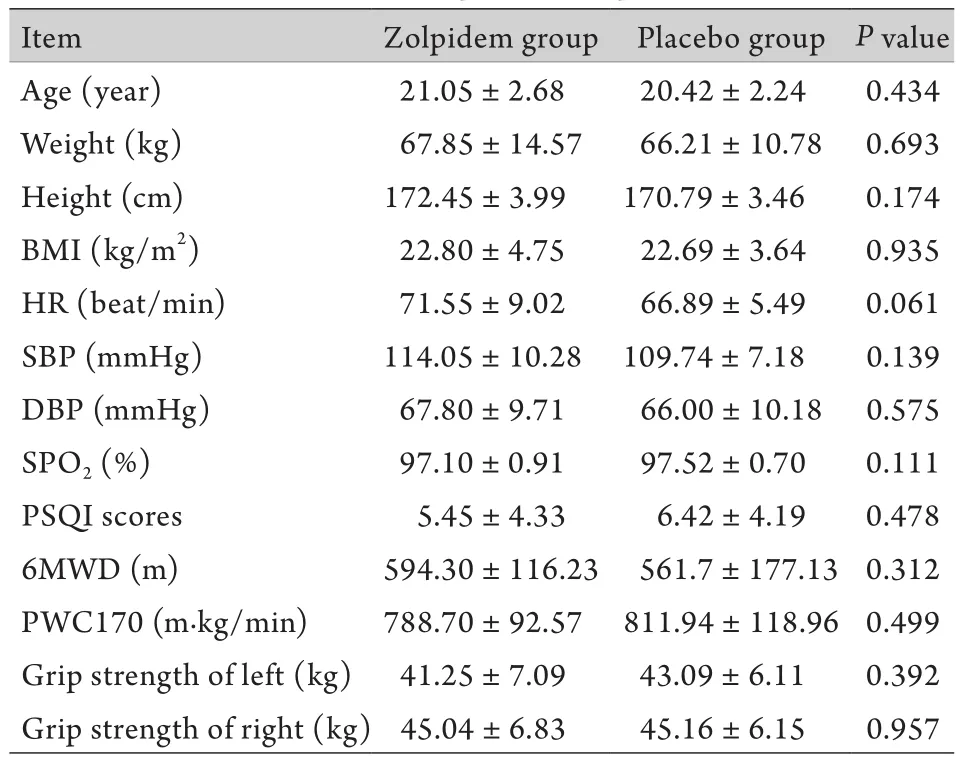
表1 受试对象平原资料的比较Tab.1 The comparison of plain data

表2 急性高原暴露128h后两组间HR、BP、SpO2、PSQI总分及体能的比较Tab. 2 Comparison of HR, BP, SpO2, PSQI scores and physical fitness test between two test groups after 128h of acute high-altitude exposure
2.3 急性高原暴露后两组间AMS评分的比较 急性高原暴露后20、44、68、128h,唑吡坦组总体AMS发病率分别为15%、10%、25%和30%,安慰剂组总体AMS发病率分别为52.6%、47.4%、63.2% 和68.4%,两组间差异有统计学意义(P值分别为0.019、0.014、0.025和0.026)。在高原暴露20h和128h后,唑吡坦组重度AMS发病率均为0%,而安慰剂组发病率分别为15.8%和26.3%,两组间差异有统计学意义(P值分别为0.047和0.020)。在高原暴露44、68h后,唑吡坦组重度AMS发病率分别为5%和10%,安慰剂组分别为31.6%和42.1%,两组间差异有统计学意义(P值分别为0.044和0.031)。
2.4 急性高原暴露20h后两组间AMS症状的比较急性高原暴露20h后,唑吡坦组除睡眠障碍外AMS各症状发生例数分别为头痛(6/20)、胃肠道症状(8/20)、疲劳和虚弱(0/20)、眩晕(6/20);安慰剂组发生例数分别为头痛(12/19)、胃肠道症状(12/19)、疲劳和虚弱(8/19)、眩晕(13/19),其发生率比较见图2。
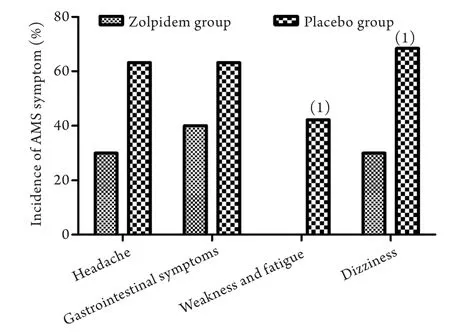
图2 急性高原暴露20h后两组间AMS症状发生率的比较Fig.2 Comparison of the symptoms of AMS between two groups after 20h of acute high-altitude exposure (1)P<0.05 compared with zolpidem group
3 讨 论
急进高原后睡眠障碍是AMS主要症状之一,具体表现为入睡困难或睡眠连续性遭破坏,醒来后自觉身体疲惫,严重影响急进高原人群的身心健康和作业能力。同时,急进高原睡眠障碍也是AMS的危险因素,可引起疲劳、日间作业能力下降,促进AMS的发生与发展[11]。高原睡眠障碍是AMS的继发改变还是诱因目前尚不确定,MacInnis等[12]运用验证性因素分析方法对路易斯湖问卷(LLSQ)的5个因素进行研究,发现睡眠障碍有较低的因子负荷而其他4个症状有很强的因子负荷,表明LLSQ中睡眠障碍较其他4个症状具有很弱的相关性,因此提出了高原睡眠障碍是否能从AMS症状中独立出来的观点。头痛是LLS标准诊断AMS的必要指标,Bian等[13]对急性高原暴露后高海拔头痛危险因素的研究发现,失眠是高海拔头痛的独立危险因素,推测改善睡眠能预防高海拔头痛的发生、减轻AMS的症状。Beaumont 等[5]研究发现每晚口服唑吡坦10mg能安全有效改善高原睡眠障碍、保存体力、降低AMS评分。此观点与本研究唑吡坦显著降低PSQI评分、有效改善睡眠质量的结论相符。可见,高原睡眠障碍不仅是AMS的症状,也可能是其独立因素,导致人体生理机能下降,促进AMS的发生发展。因此,改善高原睡眠障碍可能在预防AMS中起到重要作用。
AMS是一种自限性疾病,随着人体逐渐习服,大部分人群AMS症状会消失,但适应能力差的个体需要更长的时间习服。研究表明良好的睡眠对体力、脑力的恢复具有重要意义,有利于人体快速适应高原环境,而睡眠紊乱可能导致认知功能障碍、日间作业能力下降以及焦虑、抑郁等不良情绪的产生,从而延缓了人体习服[14]。6min步行试验结果直接反映了人体的体力储备,其步行距离越长,表示受试者体力储备越好;PWC170反映了机体工作能力,尤其是耐力水平和心肺功能;握力主要反映受试者爆发力。本研究体能测试只发现唑吡坦组6min步行距离明显高于安慰剂组,表明唑吡坦对体能的影响主要是增加了人体的体力储备,而对耐力及爆发力影响不大。说明唑吡坦通过改善高原睡眠质量,有助于急进高原人群体力恢复,有利于人体快速适应高原环境。体力的改善只是人体习服的一方面,焦虑、抑郁、恐惧等不良心理情绪的出现也是对环境不适应的重要表现。本课题组先前的研究发现高原表现为焦虑的个体较非焦虑个体会出现更为严重的躯体不适以及更加严重的睡眠紊乱,而睡眠障碍的个体更易出现焦虑情绪[15]。Gao等[16]对移居高原人群心理调查发现,睡眠障碍是导致心理和认知功能损害的主要因素之一。表明改善睡眠能减轻焦虑、抑郁、恐惧等不良心理情绪。此外,HR、BP、SpO2的变化也能反应个体对高原环境的适应能力[17],虽有研究表明]唑吡坦在高原使用能改善夜间SpO2[18],但本研究两组间HR、BP、SpO2差异无统计学意义,此结论与文献报道不一致的原因有:①HR、BP、SpO2都是动态指标,不同时间检测会出现不同的结果;②因条件限制,本研究未能监测夜间HR、BP、SpO2。因此,改善睡眠可以从诸多方面促进人体习服。
AMS症状一般在急进高原后数小时到数天内出现,尤其是在急进高原的48h内。本研究发现,急性高原暴露一周内,两组AMS发病趋势相同,即海拔越高AMS发病率越高,并且由高原低海拔急进到高原更高海拔时,两组AMS发病率均升高,这符合AMS发病规律,同时,在相同的时间点和海拔高度,唑吡坦组AMS发病率均低于安慰剂组AMS发病率,表明唑吡坦能有效降低AMS发病率。研究还发现,唑吡坦组在高原暴露20h和128h未出现重度AMS,而安慰剂组在相同高原暴露条件下重度AMS发病率分别为15.8%和26.3%,明显高于唑吡坦组;在高原暴露44h和68h,唑吡坦组重度AMS发病率也明显低于安慰剂组,表明唑吡坦能减轻AMS症状。既往也有研究发现唑吡坦能降低AMS发病率[5],但并未引起人们对唑吡坦预防AMS的关注,高原睡眠障碍是AMS评分标准之一,到底是唑吡坦仅仅只改善睡眠障碍的症状降低了AMS评分,还是唑吡坦通过改善睡眠促进人体习服进而降低了AMS的发病率,仍存在争议。本研究对急性高原暴露20h后两组间除睡眠障碍外的AMS各症状进行分析,发现安慰剂组头痛、胃肠道症状、疲劳虚弱、眩晕发生率都要高于唑吡坦组,尤其是在疲劳、虚弱症状上,唑吡坦组无人出现而安慰剂组42.1%的人群出现,眩晕症状唑吡坦组也明显低于安慰剂组,表明唑吡坦不仅仅改善了睡眠,也减轻了AMS其他症状。可见,改善高原睡眠质量,有利于减轻AMS症状,降低AMS发病率。
综上所述,唑吡坦可能通过改善高原睡眠障碍,保存了体力,减轻了高原环境引起的焦虑、抑郁、恐惧等不良心理情绪,缓解了高原反应引起的一系列症状,加快了人体适应高原环境,降低了AMS的发病率,发挥了预防AMS的作用,可望成为预防AMS新的选择。但本研究纳入对象均为男性青年,且在平原均无睡眠障碍,还需对不同年龄和性别的人群及在平原有睡眠障碍人群进行进一步的研究,扩大其实际应用范围。
[1]Kayser B, Hulsebosch R, Bosch F. Low-dose acetylsalicylic acid analog and acetazolamide for prevention of acute mountain sickness[J]. High Alt Med Biol, 2008, 9(1): 15-23.
[2]Luks AM, McIntosh SE, Grissom CK,et al. Wilderness Medical Society consensus guidelines for the prevention and treatment of acute altitude illness[J]. Wilderness Environ Med, 2010, 21(2): 146-155.
[3]Li FX, Ji FY. Research progress in the pathogenesis of acute mountain sickness[J]. Med J Chin PLA, 2011, 36(4): 413-415.[李福祥, 戢福云. 急性高山病发病机制的研究进展[J]. 解放军医学杂志, 2011, 36(4): 413-415.]
[4]Jouanin JC, Dussault C, Van Beers P,et al. Short half-life hypnotics preserve physical fitness and altitude tolerance during military mountainous training[J]. Mil Med Sep, 2009, 174(9): 964-970.
[5]Beaumont M, Batejat D, Pierard C,et al. Zaleplon and zolpidem objectively alleviate sleep disturbances in mountaineers at a 3613 meteraltitude[J]. Sleep, 2007, 30(11): 1527-1533.
[6]ATS Statement: guidelines for the six-miute walk test[J]. Am J Respir Crit Care Med, 2002, 166(2): 111-117.
[7]The general logistics department of the Chinese people's liberation army. Measurement and evaluation of physical fitness for soldier[S]. GJB1337-92.1992. [中国人民解放军总后勤部.士兵体能的测量和评价[S]. GJB1337-92.1992. ]
[8]General Administration of Sport. National physical fitness evaluation standard[M]. Beijing: People's Education Press, 2003.[国家体育总局. 国民体质测定标准手册[M]. 北京: 人民体育出版社, 2003.]
[9]Buysse DJ, Reynolds CF, Monk TH,et al. The Pittsburgh Sleep Quality Index: a new instrument for psychiatric practice and research[J]. Psychiatry Res, 1989, 28(3): 193-213.
[10] Roach RC, Bartsch P, Hackett PH,et al. The Lake Louise acute mountain sickness scoring system[M]//Sutton JR, Houston CS, Coates G,et al. Hypoxia and Molecular Medicine. Burlington, VT: Queen City Press, 1993. 272-274.
[11] Ken Zafren. Prevention of high altitude illness[J]. Travel Med Infect Dis, 2014, 12(1): 29-39.
[12] MacInnis, Shawnda C, Michael S,et al. Is poor sleep quality at high altitude separate from acute mountain sickness? Factor structure and internal consistency of the Lake Louise Score Questionnaire[J]. High Alt Med Biol, 2013, 14(3): 334-337.
[13] Bian SZ, Zhang JH, Huang L,et al. Risk factors for high-altitude headache upon acute high-altitude exposure at 3700m in young Chinese men: a cohort study[J]. J Headache Pain, 2013, 14(1): 35.
[14] Hagewoud R, Havekes R, Novati A,et al. Sleep deprivation impairs spatial working memory and reduces hippocampal AMPA receptor phosphorylation[J]. J Sleep Res, 2010, 19(2): 280-288.
[15] Dong JQ, Qin J, Huang L,et al. Anxiety correlates with somatic symptoms and sleep status at high altitudes[J]. Physiology & Behavior, 2013, 112(1): 23-31.
[16] Gao YX, Li P, Gao YQ,et al. Psychological and cognitive impairment of long-term migrators to high altitudes and the relationship to physiological and biochemical changes[J]. Eur J Neurol, 2014, 7(12): 1111-12507.
[17] Zheng SJ, Qin J, Huang L,et al. Changes in heart rate,blood pressure and arterial oxygen saturation among healthy young men on 4400 meters plateau after a month of acclimatization at 3600 meters, and their relationship with acute mountain sickness[J]. Mil Med Sci, 2013, 37(5): 325-328. [郑双锦, 覃军,黄岚, 等. 健康青年男性高原习服后进入更高海拔心率、血压和血氧饱和度变化规律及与急性高原病的关系[J]. 军事医学, 2013, 37(5): 325-328. ]
[18] Maurice B, Denise B, Christophe P,et al. Effects of zolpidem and zaleplon on sleep, respiratory patterns and performance at a simulated altitude of 4,000m[J]. Neuropsychobiol, 2004, 49(1): 154-162.
Oral zolpidem prevents acute mountain sickness: a randomized double-blind placebo controlled study
HUANG Yong-tao, QIN Jun*, GAO Xu-bin, CHEN Guo-zhu, ZHENG Cheng-rong, YANG Jie, HUANG Lan
Institute of Cardiovascular Diseases of PLA, Xinqiao Hospital, Department of Cardiology, Third Military Medical University, Chongqing 400037, China
*< class="emphasis_italic">Corresponding author, E-mail: qinjunxq@126.com
, E-mail: qinjunxq@126.com
This work was supported by the Special Health Research Project of Ministry of Health of China (201002012)
ObjectiveTo study the prophylactic effect of zolpidem on acute mountain sickness (AMS) after acute highaltitude exposure.MethodsA randomized double-blind placebo controlled trial was performed on the plateau. Forty subjects were randomly divided into zolpidem group and placebo group. The general clinical data, heart rate, blood pressure, oxygen saturation, the Pittsburgh Sleep Quality Index (PSQI) scores, AMS scores and physical fitness test of the both groups were collected and assessed on plain and plateau, respectively.ResultsThe PSQI scores were obviously lower and the six-minute walk distance was significantly longer in zolpidem group than those in placebo group (P=0.047 andP=0.009, respectively) after acute high-altitude exposure. AMS incidence was significantly lower in zolpidem group than in placebo group at different time points (P=0.019, 0.014, 0.025 and 0.026, respectively), and the incidence of severe AMS was also significantly lower in zolpidem group than in placebo group at different time points (P=0.047, 0.044, 0.031 and 0.020, respectively). The symptoms of dizziness, weakness and fatigue were significantly lighter in zolpidem group than in placebo group after acute exposure to high-altitude exposure for 20 hours (P<0.05). No significant difference was found in the general physiological findings including, heart rate, blood pressure, oxygen saturation, physical capacity, and the power of hand grip between the 2 groups after acute high-altitude exposure (P>0.05).ConclusionZolpidem may alleviate AMS symptoms and reduce the incidence of AMS, so it may be promising as a new choice for the prevention of AMS.
zolpidem, high-altitude, acute mountain sickness, sleep disorders
R339.54;R186.4;R821.52
A
0577-7402(2015)09-0733-05
10.11855/j.issn.0577-7402.2015.09.09
2015-01-22;
2015-07-22)
(责任编辑:李恩江)
国家卫生部卫生行业科研专项基金(201002012)
黄永涛,硕士研究生。主要从事心血管病及急性高原病预防方面的研究
400037 重庆 第三军医大学新桥医院心血管内科,全军心血管病研究所(黄永涛、覃军、高旭滨、陈国柱、郑程荣、杨杰、黄岚)
覃军,E-mail:qinjunxq@126.com
