脂质聚集指数与成年女性高尿酸血症的相关性研究
2015-06-28桂灵升李蓉杨蕾段凤仪李岱龚莉琳张素华
桂灵升,李蓉,杨蕾,段凤仪,李岱,龚莉琳,张素华
脂质聚集指数与成年女性高尿酸血症的相关性研究
桂灵升,李蓉,杨蕾,段凤仪,李岱,龚莉琳,张素华
目的探讨脂质聚集指数(LAP)与女性高尿酸血症的关系。方法本研究为横断面研究。共纳入2006年3-9月重庆市珞璜社区成年女性174例,均为体检人群。测量所有研究对象的身高、体重、腰围(WC)、血压、尿酸(UA)、血糖、胰岛素、血脂,计算体重指数(BMI),胰岛素抵抗指数(HOMA-IR)和LAP。根据尿酸水平分为正常组及高尿酸症组,采用独立样本的t检验进行比较。根据LAP水平四分位水平分为4组,组间比较采用单因素方差分析。采用Pearson相关分析和多元线性逐步回归分析研究UA和其他变量之间的关系。采用logistic回归分析LAP最高四分位数研究对象高尿酸血症发生风险的比值比(OR)。采用ROC曲线分析各指标对高尿酸血症的预测能力。结果与尿酸正常者相比,高尿酸血症者年龄、WC、TG、空腹胰岛素(FINS)、HOMA-IR和LAP明显增高(P<0.05)。根据研究对象LAP水平四分位数分组进行比较,年龄、WC、BMI、收缩压(SBP)、舒张压(DBP)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FPG)、餐后2h血糖(2h-PPG)、FINS、HOMA-IR和UA随LAP增高明显增高(P<0.05),而高密度脂蛋白胆固醇(HDL-C) 明显降低(P<0.05)。Pearson相关性分析显示,UA与年龄、WC、BMI、SBP、DBP、TG、TC、LDL-C、FPG、2h-PPG及LAP呈正相关(P<0.05),与HDL-C呈负相关(P<0.05)。以UA为因变量的多因素分析结果显示,LAP、SBP和HDL-C进入筛选模型(LAP:标准回归系数=0.306,P=0.010;SBP:标准回归系数=0.189,P<0.001;HDL-C:标准回归系数=–0.185,P=0.014)。Logistic回归分析结果显示,研究对象LAP在上四分位(LAP≥20.2)者比LAP在下四分位者(LAP<20.2)发生高尿酸血症的风险增加2.02倍(OR=2.02,95%CI 0.30~5.91,P=0.045)。ROC曲线分析显示,LAP曲线下面积(0.86±0.06,95%CI 0.75~0.98)。结论在成年女性中LAP是一个与高尿酸血症发生密切相关的脂质聚集指标。
尿酸;高尿酸血症;脂质聚积指数;代谢综合征X;高血压
尿酸是嘌呤的代谢产物,内源性或外源性代谢异常可使体内尿酸水平升高而发生高尿酸血症。高尿酸血症是痛风发生最重要的原因,在许多代谢性疾病的发生发展中也起到重要的作用,其中包括代谢综合征[1]。有研究表明,尿酸升高与代谢综合征发生的密切联系在女性人群较男性人群中更为显著[2]。高尿酸血症的发病原因目前仍不清楚,在男性人群中其诱发的风险因素包括肥胖、高嘌呤食物摄入、过量饮酒及某些特定药物的使用等。而影响女性尿酸代谢的各种内分泌因素相比男性更加复杂,初次月经及绝经时间对女性高尿酸血症的发生都有一定影响[3]。因此,探索女性血尿酸升高的风险因素对防治女性高尿酸血症及代谢综合征具有重要的临床意义。
一般来说,高尿酸血症定义为血清尿酸(UA)浓度大于416μmol/L(成年男性)和356μmol/L(成年女性)[4]。高尿酸血症与肥胖特别是中心性肥胖密切相关[5]。研究发现,高尿酸血症的发病率随体重指数(BMI)的增加而增加,随体重减轻其发病率也减少[4,6]。男性患者中高尿酸血症与BMI、腰围(WC)有关[6]。然而,BMI和WC不能综合反映机体的肥胖和代谢异常程度。通过身高和体重计算而来的BMI不能很好地反映体内脂肪的含量和分布情况。WC是反映中心性肥胖的有效指标,但它不具备对机体皮下脂肪和内脏脂肪的区分作用,而后者与高尿酸血症的联系更加紧密。
由于女性内分泌代谢因素的复杂性,WC及BMI不能很好地反映其高尿酸代谢的异常。脂质聚集指数(LAP)最初由Kahn[7](NHANES Ⅲ)定义并提出。它结合WC、甘油三酯(TG),能更好地反映中心性肥胖脂质的积聚。研究发现,LAP是一个与代谢综合征、糖尿病密切相关的代谢指标,其关联程度超过BMI[8]。本研究旨在观察LAP与女性高尿酸血症之间的联系,探讨相较于BMI和WC等指标,LAP与高尿酸血症的关系是否更明显。
1 资料和方法
1.1 研究对象 本研究为横断面流行病学研究。受试者为年龄20~80岁女性,采用简单随机抽样的方法从2006年3-9月重庆市珞璜社区体检人群中招募。本研究经重庆医科大学附属第一医院伦理委员会批准,所有受试者入选前都签署知情同意书。排除标准:①受试者正在使用可导致血尿酸水平增加或减少的某些特定药物;②受试者饮酒超过20g酒精/d;③正接受降脂治疗;④合并急慢性感染性疾病;⑤肿瘤患者;⑥肾功能不全。最终共有174例女性受试者纳入。根据中国原发性痛风诊治指南,定义正常血清UA的上限为356μmol/L[9]。
1.2 指标测定及定义 所有研究对象测量了身高、体重、WC、血压、UA、血糖、胰岛素、血脂,计算了BMI(BMI=体重/身高2),胰岛素抵抗指数(HOMA-IR)=空腹胰岛素(FINS)×空腹血糖(FPG)/22.5,LAP=(WC-58)×TG[7]。WC测量的位置为髂嵴顶点与肋骨最下缘中点。血压测量采用水银血压计测定坐位左胳膊血压两次的平均值。血标本采集选用夜间禁食次日7:00到9:00采集的静脉血。口服75g葡萄糖进行葡萄糖耐量试验,己糖激酶法测量血糖(Olympus Diagnostics,Tokyo,Japan),化学发光法测定血清FINS(Roche Diagnostics,Mannheim Germany)。酶法测定血脂(Wako Diagnostics,Tokyo,Japan)。酶比色法测定血清UA水平(Roche Diagnostics,Mannheim Germany)。定义女性腹型肥胖为WC≥80cm[10]。根据中国成人血脂紊乱防治指南标准定义各种血脂异常[11]。
1.3 统计学处理 采用统计软件SPSS 11.5(SPSS,Inc.,Chicago,IL,USA)进行分析。正态分布数据表示为,偏态分布数据表示为M(Q1-Q3)并通过log转换(基于10)后进行分析。两组连续变量之间的比较采用独立样本的t检验。多组连续变量间的比较采用单因素方差分析进行统计。采用Pearson相关分析和多元线性逐步回归分析研究UA和其他变量之间的关系。Logistic回归分析用于统计LAP最高四分位数研究对象高尿酸血症发生风险的比值比(OR)。ROC曲线分析各指标对高尿酸血症的预测能力。P<0.05为差异有统计学意义。
2 结 果
2.1 人群一般特征 174例女性受试者的年龄43.4±10.6岁,60岁以上占9.2%,60岁以下占90.8%。本研究中高尿酸血症(UA>356μmol/L)的检出率为6.3%,高血压(高血压病史或SBP≥140mmHg 或DBP≥90mmHg)的检出率为12.6%,糖尿病[糖尿病病史或空腹血糖(FPG)≥7.0mmol/L或餐后2h血糖(2h-PPG)≥11.1mmol/L]的检出率为5.2%,腹型肥胖(WC≥80cm)的检出率为14.9%。受试者中14.9%有高甘油三酯血症(TG≥1.70mmol/L),30.5%有高胆固醇血症(TC≥5.18mmol/L),5.0%有低密度脂蛋白胆固醇(LDL-C)增高(LDL-C≥3.37mmol/L),17.8%有高密度脂蛋白胆固醇(HDL-C)降低(HDL-C <1.3mmol/L)。根据UA值的大小分组:正常组(UA <356μmol/L),高尿酸血症组(UA≥356μmol/L)。高尿酸血症组年龄分布在47.8±14.6岁。与正常组相比,高尿酸血症组的年龄、WC、TG、FINS、HOMA-IR和LAP均明显增高(P<0.05);而BMI、SBP、DBP、TC、HDL-C、LDL-C、FPG、2h-PPG在两组间差异无统计学意义(P>0.05)。研究对象的基本临床和生化特征见表1。
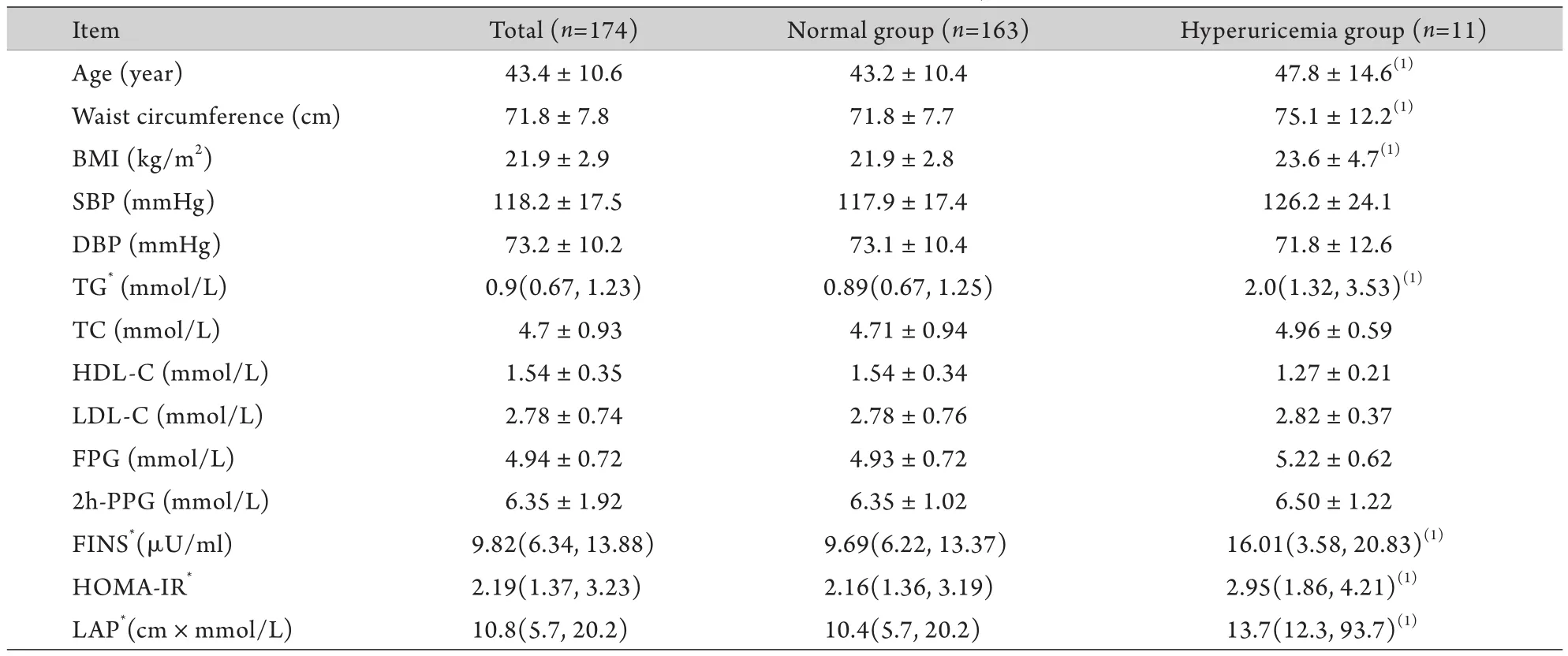
表1 研究对象一般特征Tab.1 General characteristics of subjects
根据L AP四分位数将研究对象分为4组。Q1:LAP<5.7cm×mmol/L;Q2:LAP(5.7~10.8) cm×mmol/L;Q3:LAP(10.8~20.2)cm×mmol/L和Q4:LAP>20.2cm×mmol/L对4组的年龄、WC、BMI、SBP、DBP、TG、TC、HDL-C、LDL-C、FPG、2h-PPG、FINS和HOMA-IR进行比较,表2结果显示,年龄、WC、BMI、SBP、DBP、TG、TC、LDL-C、FPG、2h-PPG、FINS、HOMA-IR和UA随LAP的增高而明显增高(P<0.05),而HDL-C随LAP增高而明显降低(P<0.05)。
2.2 UA与各变量的相关性 Pearson相关性分析结果显示,UA与年龄、WC、BMI、SBP、DBP、TG、TC、LDL-C、FPG、2h-PPG及LAP呈正相关,与HDL-C呈负相关(P<0.05)。此外FINS、HOMA-IR与UA的相关性差异无统计学意义(P>0.05,表3)。
2.3 多元线性逐步回归分析 取血清UA作为因变量行多元线性回归分析。根据Pearson相关性分析结果,取年龄、WC、BMI、SBP、DBP、TG、TC、LDL-C、FPG、2h-PPG、HDL-C及LAP作为自变量。结果显示:LAP、SBP和HDL-C进入回归模型(LAP:标准回归系数=0.306,P=0.010;SBP:标准回归系数=0.189,P<0.001;HDL-C:标准回归系数=–0.185,P=0.014),表明校正年龄等其他混杂因素后,LAP、SBP和HDL-C对UA的变化具有影响。
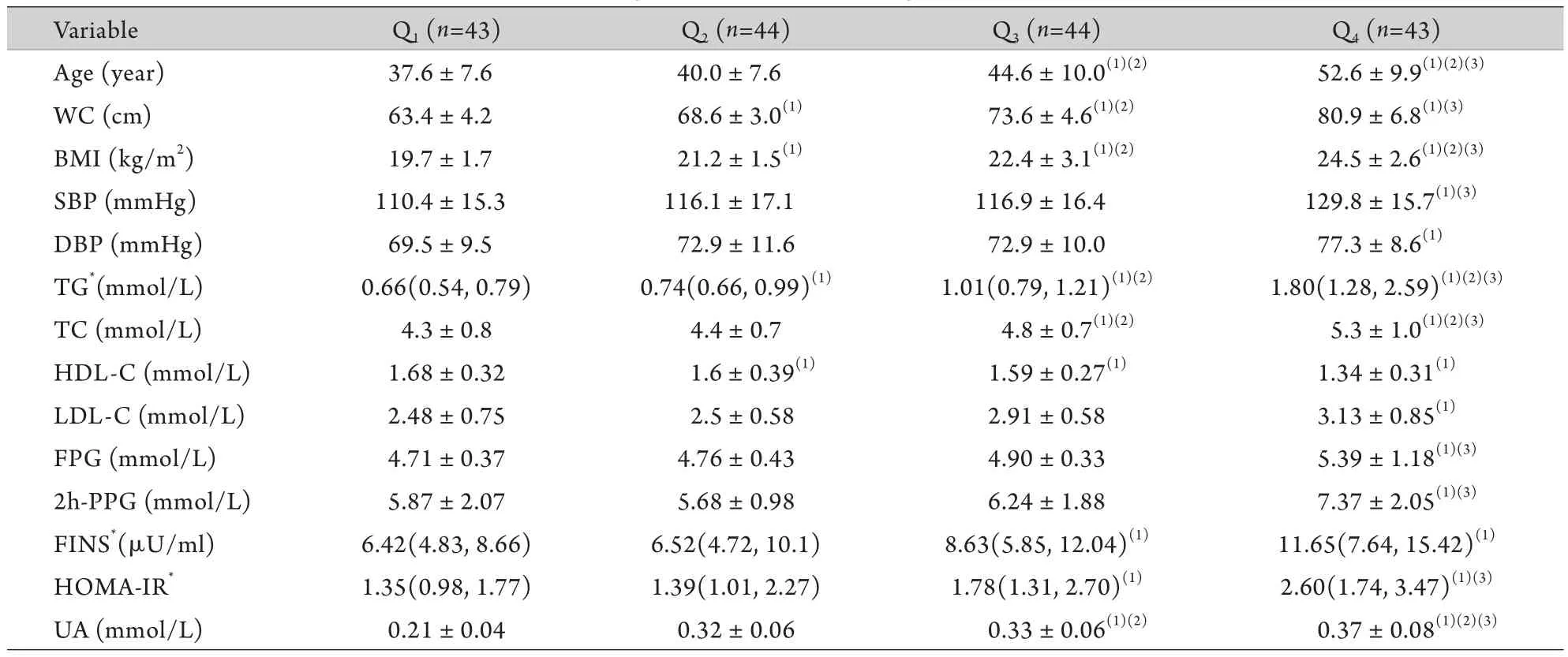
表2 LAP四分位数间的变量比较Tab.2 Comparison of variables in quartiles of LAP
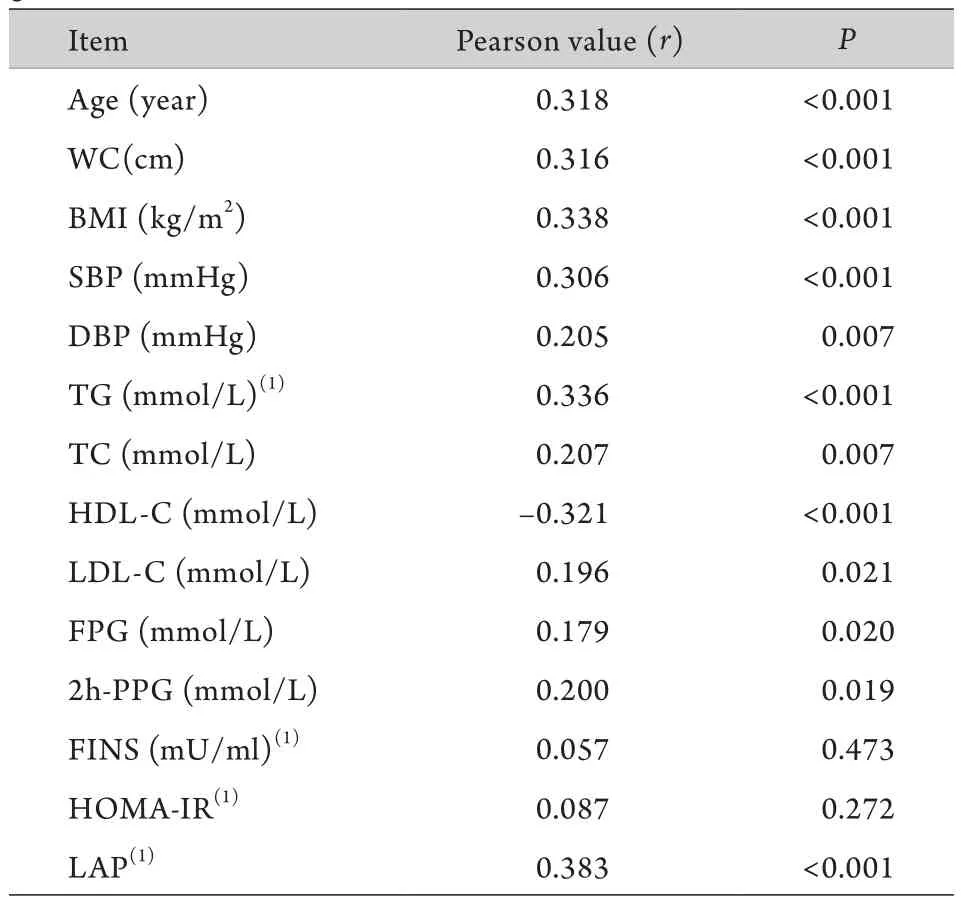
表3 UA与各变量的相关性Tab.3 Correlation between UA and different variables by gender differences
2.4 Logistic回归分析 运用logistic回归分析LAP上四分位数(LAP≥20.2)研究对象相比LAP下四分位数(LAP<20.2)研究对象发生高尿酸血症风险的比值比。结果显示,LAP上四分位者发生高尿酸血症风险是其他人的9.25倍(OR=9.25,95%CI 1.39~10.50,P<0.001)。校正年龄、WC、BMI、SBP、DBP、TG、TC、HDL-C、FINS、HOMA-IR这些混杂影响因素后,其风险比值比仍有2.02倍(OR=2.02,95%CI 0.30~5.91,P=0.045)。
2.5 R O C曲线分析 根据L A P的公式和多元线性回归分析结果,运用R O C曲线观察L A P、W C、B M I、TG和S B P对高尿酸血症的预测能力。结果显示:各指标的R O C曲线下面积(AUC)分别为:WC(0.55±0.17,95%CI 0.22~0.88),BMI(0.60±0.17,95%CI 0.28~0.92),SBP(0.60±0.13,95%CI 0.34~0.86),L A P(0.8 6±0.0 6,9 5%C I 0.7 5~0.9 8),TG(0.74±0.04,95%CI 0.56~0.92),该结果提示LAP较WC、BMI、TG、SBP对高尿酸血症有更好的预测作用。
3 讨 论
人体尿酸水平存在明显的性别差异,在年轻个体中女性尿酸水平往往较男性低,但随着年龄的增长,这种差异变得越来越小,特别是绝经后女性的尿酸水平与男性相比并无明显差异[12]。本研究中女性高尿酸血症的患病率为6.3%,而既往研究显示重庆地区女性高尿酸血症的患病率约为12.7%,存在这样的差异可能与调查人群的年龄分布有关,本研究的研究对象年龄43.4±10.6(平均年龄43)岁。有Meta分析研究显示中国西部地区40~50岁年龄段女性高尿酸血症的患病率约为7.5%[13]。近年来,人们对高尿酸血症的认识不再局限于其可以引起痛风,越来越多的研究显示,它与高血压、动脉粥样硬化、心血管疾病、慢性肾病等同样存在密切的联系[14]。尿酸升高可以使血管系统产生氧化应激[15],刺激血管平滑肌增殖,导致高血压、纤维化和肾损害等功能紊乱[16]。此外,高尿酸血症与代谢综合征各种代谢异常(腹型肥胖,血脂、血糖异常等)的密切关系也受到人们的关注,并且这种联系在女性人群中更为明显[2]。肥胖人群较正常体重人群更易患高尿酸血症,因此反映肥胖的各项指标可作为高尿酸血症的重要风险因素,有助于临床更及时的关注血尿酸的异常。
我们的研究同样发现肥胖指标BMI、WC与高尿酸血症有密切的关系,但LAP与高尿酸血症的关系更为明显。多元线性回归分析结果显示,LAP相较BMI、WC对UA的影响更明显。Logistic回归分析结果显示,在校正各种混杂影响因素后高LAP研究对象比低LAP者发生高尿酸血症的风险更高。此外,ROC曲线分析也提示LAP对高尿酸血症有更好的预测作用。BMI和WC是反映肥胖的较好指标,但它们都存在一定的不足。BMI只能反映体重的增加,WC虽然可以反映腹型肥胖,但不能很好地反映脂肪在内脏积聚。研究显示高甘油三酯血症通常伴随着TG在肌肉和肝脏的沉积,可以更好地反映内脏脂肪的积聚[17]。LAP结合WC、TG两项指标可以很好地反映中心性肥胖的脂质聚集。LAP与高尿酸血症存在明显的关系,一方面是因为WC与胰岛素抵抗关系密切,胰岛素抵抗和瘦素水平增加可以减少肾脏对尿酸的排泄而升高血清中尿酸的浓度[18],另一方面是因为肝脏中TG的合成与嘌呤的从头合成途径密切相关,从而促进尿酸的形成并产生高尿酸[19]。
我们的研究结果也显示SBP是高尿酸血症发生的一个重要危险因素。但高血压与高尿酸血症之间的因果关系并不清楚,一些研究显示高尿酸可能会导致高血压,而另外也有研究显示高血压是高尿酸血症发生的危险因素。既往有研究表明未治疗的高血压患者25%~60%伴随着尿酸的升高[20]。高血压导致高尿酸发生的潜在机制可能是高血压增加了肾血管阻力减少肾脏血流,增加了尿酸的重吸收[21]。另一方面,各种研究也显示高尿酸血症独立于其他危险因素,可以增加高血压5年发病的相对风险[22]。尿酸升高导致血压升高的潜在机制可能与肾脏微血管损伤、内皮功能紊乱及肾素-血管紧张素系统激活有关[23]。此外,既往研究提示HDL-C与血尿酸水平呈负相关关系[4],本研究也观察到同样的结果,提示HDL-C对高尿酸血症很可能是一个保护性因素。
既往各种研究提示LAP是评估心血管疾病和糖尿病风险的有效指标。Kahn[24]的研究发现,LAP对代谢综合征的识别作用超过BMI和WC,对心血管风险和糖尿病的识别作用超过BMI。在多囊卵巢综合征患者中LAP与HOMA-IR呈明显正相关,但LAP 比BMI和WC更能预测胰岛素抵抗的发生[25],而在非糖尿病正常人群中LAP也是认识胰岛素抵抗的有力指标[26]。此外,随访一个为期6年的前瞻性研究也发现LAP较BMI对糖尿病有更好的预测作用[8]。本研究则发现,在成年女性中LAP与高尿酸血症也存在密切的关系,其相关性超过BMI和WC。
[1]Billiet L,Doaty S,Katz JD,et al. Review of hyperuricemia as new marker for metabolic syndrome[J]. ISRN Rheumatol,2014,doi: 10.1155/2014/852954.
[2]C h i o u W K,Wa n g M H,Hu a n g D H,e t a l. T h e relationship between serum uric acid level and metabolic syndrome:differences by sex and age in Taiwanese[J]. J Epidemiol,2010,20(3): 219-224.
[3]Stöckl D,Döring A,Thorand B,et al. Reproductive factors and serum uric acid levels in females from the general population: the KORA F4 study[J]. PLoS One,2012,7(3): e32668.
[4]Jin M,Yang F,Yang I,et al. Uric acid,hyperuricemia and vascular diseases[J]. Front Biosci (Landmark Ed),2012,17: 656-669.
[5]Ma HY,Zhu MC,Quan SZ,et al. Analysis of risk factors related with hyperuricemia in aviators[J]. Med J Chin PLA,2012,37(1): 73-75. [马红雨,朱美财,全首祯,等. 飞行员高尿酸血症调查及危险因素分析[J]. 解放军医学杂志,2012,37(1): 73-75.]
[6]Choi HK,Atkinson K,Karlson EW,et al. Obesity,weight change,hypertension,diuretic use,and risk of gout in men: the health professionals follow-up study[J]. Arch Intern Med,2005,165(7): 742-748.
[7]Kahn HS. The "lipid accumulation product" performs better than the body mass index for recognizing cardiovascular risk: a population-based comparison[J]. BMC Cardiovasc Disord,2005,5: 26.
[8]Bozorgmanesh M,Hadaegh F,Azizi F. Diabetes prediction,lipid accumulation product,and adiposity measures; 6-year followup:Tehran lipid and glucose study[J]. Lipids Health Dis,2010,doi: 10.1186/1476-511X-9-45.
[9]Chinese Rheumatology Association. Chinese guidelines ondiagnosis and treatment of Primary gout[J]. Chin J Rheumatol,2011,15(6): 410-413. [中国风湿病学学会. 中国原发性痛风诊治指南[J]. 中华风湿病学杂志,2011,15(6): 410-413.]
[10] Alberti KG,Zimmet P,Shaw J,et al. The metabolic syndrome --a new worldwide definition[J]. Lancet,2005,366(9491): 1059-1062.
[11] Joint committee for Developing Chinese guidelines on Prevention and Treatment of Dyslipidemia in Adults. Chinese guidelines on prevention and treatment of dyslipidemia in adults[J]. Chin J Cardiol,2007,35(5): 390-419.[中国成人血脂异常防治指南制订联合委员会. 中国成人血脂异常防治指南[J]. 中华心血管病杂志,2007,35(5): 390-419.]
[12] Hak AE,Choi HK. Menopause,postmenopausal hormone use and serum uric acid levels in US women--the Third National Health and Nutrition Examination Survey[J]. Arthritis Res Ther,2008,10(5): R116.
[13] Liu B,Wang T,Zhao HN,et al. The prevalence of hyperuricemia in China: a meta-analysis[J]. BMC Public Health,2011,11: 832.
[14] Liu JL,Teng JF. Relations between stability of carotid atherosclerosis plaques and blood C-reactive protein and uric acid levels in cerebral infarction patients[J]. J Zhengzhou Univ(Med Sci),2010,45(4): 609-612. [刘金玲,滕军放. 脑梗死患者颈动脉粥样硬化斑块稳定性与血C-反应蛋白、尿酸水平的关系[J]. 郑州大学学报(医学版),2010,45(4): 609-612.]
[15] Corry DB,Eslami P,Yamamoto K,et al. Uric acid stimulates vascular smooth muscle cell proliferation and oxidative stressviathe vascular renin-angiotensin system[J]. J Hypertens,2008,26(2): 269-275.
[16] Mazzali M,Hughes J,Kim YG,et al. Elevated uric acid increases blood pressure in the rat by a novel crystal-independent mechanism[J]. Hypertension,2001,38(5): 1101-1106.
[17] Després JP,Cartier A,Cōté M,et al. The concept of cardiometabolic risk: Bridging the fields of diabetology and cardiology[J]. Ann Med,2008,40(7): 514-523.
[18] Choi HK,Atkinson K,Karlson EW,et al. Obesity,weight change,hypertension,diuretic use,and risk of gout in men: the health professionals follow-up study[J]. Arch Intern Med,2005,165(7): 742-748.
[19] de Oliveira EP,Burini RC. High plasma uric acid concentration: causes and consequences[J]. Diabetol Metab Syndr,2012,4: 12.
[20] Feig DI,Kang DH,Johnson RJ. Uric acid and cardiovascular risk[J]. N Engl J Med,2008,359(17): 1811-1821.
[21] Messerli FH,Frohlich ED,Dreslinski GR,et al. Serum uric acid in essential hypertension: an indicator of renal vascular involvement[J]. Ann Intern Med,1980,93(6): 817-821.
[22] Perlstein TS,Gumieniak O,Williams GH,et al. Uric acid and the development of hypertension: the Normative Aging Study[J]. Hypertension,2006,48(6): 1031-1036.
[23] Sánchez-Lozada LG,Tapia E,López-Molina R,et al. Effects of acute and chronic L-arginine treatment in experimental hyperuricemia[J]. Am J Physiol Renal Physiol,2007,292(4): F1238-F1244.
[24] Kahn HS. The lipid accumulation product is better than BMI for identifying diabetes: a population-based comparison[J]. Diabetes Care,2006,29(1): 151-153.
[25] Wiltgen D,Benedetto IG,Mastella LS,et al. Lipid accumulation product index: a reliable marker of cardiovascular risk in polycystic ovary syndrome[J]. Hum Reprod,2009,24(7): 1726-1731.
[26] Xia C,Li R,Zhang S,et al. Lipid accumulation product is a powerful index for recognizing insulin resistance in non-diabetic individuals[J]. Eur J Clin Nutr,2012,66(9): 1035-1038.
Correlation between lipid accumulation index and hyperuricemia in adult females
GUI Ling-sheng,LI Rong*,YANG Lei,DUAN Feng-yi,LI Dai,GONG Li-lin,ZhANG Su-hua
Department of Endocrinology,First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
*< class="emphasis_italic">Corresponding author,E-mail: rong.li.cq@gmail.com
,E-mail: rong.li.cq@gmail.com
This work was supported by the National Natural Science Foundation of China (81200588),the Natural Science Fund Project of Chongqing Science and Technology Committee (09BB5076),and the National Key Clinical Specialties Construction Program of China (2011)
ObjectiveTo explore the relationship between lipid accumulation index (LAI) and hyperuricemia in females.MethodsOne hundred and seventy-four adult females were included in the cross-sectional study from Mar. to Sep. 2006 through a simple random sampling from a group of population subjected to routine physical examination in the Luohuang Community of Chongqing municipality. The anthropometric measurements,blood pressure (BP),uric acid (UA),lipid profile,glucose and insulin levels were measured. Lipid accumulation product (LAP),body mass index (BMI) and the homeostasis model assessment of insulin resistance (HOMA-IR) were calculated. Subjects were divided into normal group and hyperuricemia group based on their UA levels,and an independent-samplesttest was performed for comparison between the two groups; one-factor analysis of variance was performed for multiple comparisons. The Student-Newman-Keuls test was performed for homogeneity of variance. The relationship between UA and other variables was analyzed by Pearson correlation analysis and multiple linear stepwise regression analysis. Logistic regression analysis was used to determine the odds ratio of hyperuricemia in the highest quartile of LAP level. The analysis of the areas under the receiver operating characteristic (ROC) curves was performed to identify the predictive ability of relevantvariables to hyperuricemia.ResultsCompared with normal group,the age,waist circumference (WC),triglyceride (TG),fasting insulin (FINS),HOMA-IR and LAP were higher in hyperuricemia group (P<0.05). The age,and levels of WC,BMI,systolic blood pressure (SBP),diastolic blood pressure (DBP),TG,total cholesterol (TC),low-density lipoprotein cholesterol (LDL-C),fasting glucose (FPG),2-hour postprandial glucose (2h-PPG),FINS,HOMA-IR and UA were higher as LAP increased (P<0.05),whereas the level of high-density lipoprotein cholesterol (HDL-C) lowered as LAP increased (P<0.05). Pearson correlation analysis showed that,UA was positively correlated with age,WC,BMI,SBP,DBP,TG,TC,LDL-C,FPG,2h-PPG and LAP (P<0.05),and negatively with HDL-C (P<0.05). The multiple linear stepwise regression analysis showed that LAP,SBP and HDL-C fit a regression model (LAP: standardized coefficients=0.306,P=0.010; SBP: standardized coefficients=0.189,P<0.001; HDL-C: standardized coefficients= –0.185,P=0.014). Logistic regression analysis demonstrated that the risk of hyperuricemia in the subjects who had the LAP level in the upper quartile (LAP≥20.2) was 2.02 times higher than those in the lower quartiles (OR=2.02; 95%CI 0.30-5.91;P=0.045). LAP showed a high predictive accuracy with an area under the ROC curve of 0.86 (0.86±0.06,95%CI 0.75-0.98).ConclusionLAP is an index reflecting central lipid accumulation that closely associates with hyperuricemia in adult females.
uric acid; hyperuricemia; lipid accumulation index; metabolic syndrome X; hypertension
R589.7
A
0577-7402(2015)12-0993-06
10.11855/j.issn.0577-7402.2015.12.11
2015-01-22;
2015-07-12)
(责任编辑:张小利)
国家自然科学基金(81200588);重庆市科学技术委员会自然科学基金(09BB5076);国家临床重点专科建设项目(2011)
桂灵升,硕士研究生。主要从事肥胖及内分泌代谢疾病的研究
400016 重庆 重庆医科大学附属第一医院内分泌科(桂灵升、李蓉、杨蕾、段凤仪、李岱、龚莉琳、张素华)
李蓉,E-mail:rong.li.cq@gmail.com
