西咪替丁对0.7Gy照射小鼠嗜多染红细胞微核的保护作用
2015-06-28张俊玲何颖王庆蓉李娜蒋定文侯登勇刘玉明陈伟刘琼李珂娴宗杰李佳媚沈先荣
张俊玲,何颖,王庆蓉,李娜,蒋定文,侯登勇,刘玉明,陈伟,刘琼,李珂娴,宗杰,李佳媚,沈先荣
论 著
西咪替丁对0.7Gy照射小鼠嗜多染红细胞微核的保护作用
张俊玲,何颖,王庆蓉,李娜,蒋定文,侯登勇,刘玉明,陈伟,刘琼,李珂娴,宗杰,李佳媚,沈先荣
目的选择辐射敏感指标(骨髓嗜多染红细胞微核率)评价西咪替丁对单次低剂量照射小鼠的损伤防护作用。方法健康雄性C57BL/6小鼠48只,随机分为正常对照组、模型对照组、200mg/kg WR2721组(阳性药组)及7.5、15、30mg/kg西咪替丁组(n=8)。西咪替丁组于照射前2h腹腔注射给药1次,阳性药组照射前连续腹腔注射给药2d,每日1次。单次照射剂量为0.7Gy,剂量率为5.83mGy/min。照射后24h检测小鼠外周血象,血清和肝脏中的SOD活力与MDA含量,骨髓DNA含量和骨髓嗜多染红细胞微核率。结果与正常对照组比较,照后24h小鼠外周血白细胞显著降低(P<0.01),嗜多染红细胞微核率显著升高(P<0.01),除15mg/kg西咪替丁组外,其余各组小鼠骨髓DNA含量显著降低(P<0.01,P<0.05)。照后24h各组小鼠SOD活性和MDA含量无明显变化。与模型对照组比较,西咪替丁各剂量组外周血白细胞和骨髓DNA含量均无明显变化;7.5mg/kg西咪替丁组嗜多染红细胞微核率为0.027‰,明显低于模型对照组(P<0.01),且剂量减低系数(DRF)值达到3.338。结论西咪替丁对0.7Gy单次低剂量照射小鼠嗜多染红细胞微核有较好的保护作用。
西咪替丁;辐射,电离;嗜多染红细胞;微核试验
与大剂量照射事件或事故的发生相比,受到低水平辐射暴露的人群更多、概率更大,除受到天然本底辐射外,人们还可能因频繁的飞行活动、医学检查、不适当的居住环境,以及职业照射、空间活动等方式或途径受到低剂量电离辐射暴露[1]。低剂量辐射暴露虽不足以引起临床可观察到的急性放射损伤表现,但如不及时采取有效的监测、危害评价以及防护措施,也会通过远后效应的形式对健康造成危害。
西咪替丁(cimetidine,CMTD)是第一个临床应用的H2受体拮抗剂,主要用于治疗胃及十二直肠溃疡、上消化道出血等疾病。近年来,随着药理学研究的进展,发现西咪替丁具有许多不同于其他H2受体拮抗剂的新用途,如预防脑出血并发应激性溃疡出血,预防输血反应,治疗皮肤瘙痒症和过敏性紫癜,治疗水痘、带状疱疹及疱疹性口炎,治疗氯氮平所致流涎、小儿秋季腹泻、流行性腮腺炎、肿瘤、痤疮和妇女多毛症等[2-5]。此外,Ghorbani 等[6]研究发现,H2受体拮抗剂可有效减轻体外辐照对淋巴细胞的诱变作用。Mozdarani等[7]研究发现,与法莫替丁相比,西咪替丁对受照小鼠具有更好的辐射保护效果,其机制可能与西咪替丁具有免疫调节作用,可减轻小鼠骨髓和淋巴组织损伤有关。Kabodanian Ardestani等[8]报道,西咪替丁和雷尼替丁可减轻亚致死剂量γ射线照射引发的生物膜损伤。Mozdarani等[9]报道,西咪替丁对低剂量快中子及高传能线密度(linear energy transfer,LET)辐射导致的骨髓细胞诱裂效应具有保护作用。本研究选用辐射敏感的评价指标,评价西咪替丁腹腔注射对0.7Gy单次低剂量电离辐射损伤的保护作用,为将其开发为新型抗辐射药物奠定基础。
1 材料与方法
1.1 材料 SOD试剂盒和MDA试剂盒购自南京建成生物有限公司;759紫外可见光分光光度计购自上海奥普勒仪器有限公司,MEK-5216K型血细胞分析仪购自日本Nihon Kohoden公司,酶标仪购自美国Thermo Electron公司,流式细胞仪购自Beckman公司。C57BL/6雄性小鼠(体重20±2g,6~8周龄)购自上海思莱克实验动物有限公司(动物质量合格证号:2008001641038)。固定液:30μl/ml SDS溶液、1%戊二醛和0.05mol/L Sorensen溶液;溶液A:Triton-100、1.0mol/L HCl和NaCl;溶液B:0.1mol/L枸橼酸钠溶液、0.2mol/L磷酸氢二钠溶液、NaCl、EDTA-Na2和1mg/mL吖啶橙。
1.2 动物处理及取材 48只C57BL/6随机分为6组:空白对照组、模型对照组、200mg/kg WR2721组(阳性药组)、7.5mg/kg西咪替丁组、15mg/kg西咪替丁组、30mg/kg西咪替丁组,每组8只。西咪替丁组于照射前2h腹腔注射给药1次,阳性药组于照前连续2d腹腔注射,每天1次,200mg/(kg.d)。除空白对照组外,其余各组动物在末次给药2h后,于海军医学研究所辐照中心进行60Co γ射线单次照射,剂量率为5.83mGy/min,照射剂量为0.7Gy。照射后24h,小鼠眼眶静脉取血,用于外周血细胞计数和血清分离。解剖分离肝脏右叶用于SOD活性和MDA含量测定。解剖分离左右股骨,分别用于骨髓DNA含量测定和骨髓嗜多染红细胞微核率测定。
1.3 外周血细胞计数 取眼眶静脉血20μl,用血细胞分析仪检测外周血红细胞(RBC)、血细胞比容(HCT)、红细胞平均体积(MCV)、血小板(PLT)、白细胞(WBC)、血红蛋白(Hb)。
1.4 血清SOD活性和MDA含量检测 取眼眶静脉血,室温放置4h后,600×g离心10min,取上清。采用试剂盒检测血清SOD活性和MDA含量,具体操作按说明书进行。
1.5 肝脏SOD活性和MDA含量检测 取肝脏右叶,准确称量100mg,放入含900µl生理盐水的1.5ml 的EP管内匀浆,4℃条件下600×g离心10min,取上清。采用试剂盒检测肝脏SOD活性和MDA含量,具体操作按说明书进行。
1.6 骨髓DNA含量检测 用注射器吸取5mmol/L CaCl2溶液10ml,用其将左股骨骨髓全部冲入离心管中;4℃冰箱静置30min,600×g离心10min,弃上清;沉淀物中加入0.2ml/L HClO4溶液8ml,充分混合,90℃加热15min;冷却后600×g离心10min,取上清;将上清稀释3倍后,在260nm处测定吸光度值。
1.7 骨髓嗜多染红细胞微核率检测 用400μl小牛血清将右股骨骨髓冲入1.5ml EP管中;吸取0.2ml细胞悬液,与5ml固定液混合固定5min;300×g离心5min,弃上清;沉淀加入(0.06mol/L Sorensen缓冲液:A液:B液=4:8:32,pH7.2)混合液1ml,于冰上暗处染色30min。另制空白管,加入1ml固定液和0.2ml细胞悬液,不染色;300×g离心5min,弃上清,各测定管加入0.06mol/L Sorensen缓冲液(pH6.8)0.5ml重悬细胞,空白管加1×PBS 0.5ml重悬细胞。采用流式细胞仪检测嗜多染红细胞微核率。
1.8 统计学处理 采用SPSS 17.0软件进行统计分析,计量资料以表示,组间比较采用方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 西咪替丁对低剂量辐照后小鼠外周血象的影响 与空白对照组比较,0.7Gy辐照后小鼠WBC显著降低(P<0.01),RBC呈下降趋势,但差异无统计学意义(P>0.05)。与模型对照组比较,西咪替丁各剂量组WBC、PLT和RBC等指标均无明显变化(表1)。
2.2 西咪替丁对低剂量辐照后小鼠抗氧化系统的影响 与空白对照组比较,0.7Gy辐照后24h,各组小鼠血清和肝脏SOD活力及MDA含量均无显著变化(表2)。
表1 西咪替丁对低剂量辐照小鼠外周血象的影响(±s,n=8)Tab. 1 Effect of cimetidine (CMTD) on blood cell counts of low-dose irradiated mice (±s,n=8)

表1 西咪替丁对低剂量辐照小鼠外周血象的影响(±s,n=8)Tab. 1 Effect of cimetidine (CMTD) on blood cell counts of low-dose irradiated mice (±s,n=8)
(1)P<0.05,(2)P<0.01 compared with normal control group
Group WBC(×109/L) RBC(×1012/L) MCV(fL) PLT(×109/L) HCT(%) Hb(g/L) Normal control 4.85±1.71 10.26±0.46 44.38±0.52 940.63±133.95 45.75±2.22 134.88±8.63 Model control 1.63±0.40(2) 9.79±0.47 44.63±0.52 1030.86±117.15 45.61±6.13 126.88±6.73 200mg/kg WR2721 1.30±0.19(2) 9.35±0.51 44.13±0.35 999.63±73.39 41.68±2.79 128.88±4.16 7.5mg/kg CMTD 1.60±0.36(2) 9.79±0.33 44.63±0.52 978.00±69.73 43.70±1.65 128.38±5.55 15mg/kg CMTD 1.68±0.30(2) 9.74±0.33 44.50±0.53 1056.25±44.08(1) 43.39±1.40 127.38±6.21 30mg/kg CMTD 1.24±0.28(2) 9.39±0.40 44.00±0.76 1073.38±184.19 41.35±1.67 122.00±3.21
表2 西咪替丁对低剂量辐照小鼠血清及肝脏SOD活力和MDA含量的影响(±s,n=8)Tab. 2 Effect of cimetidine on SOD activity and MDA content in serum and liver of low-dose irradiated mice (±s,n=8)
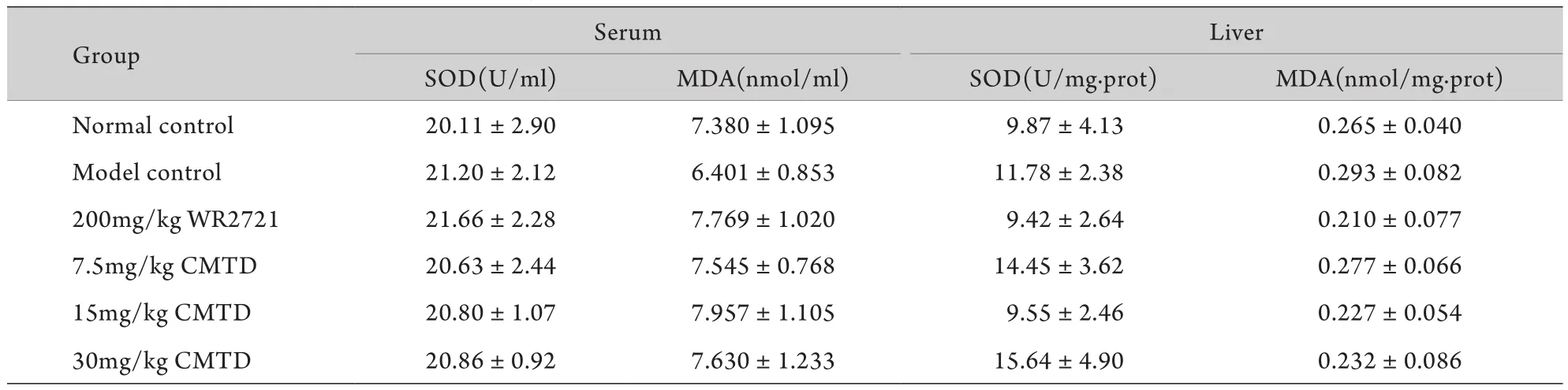
表2 西咪替丁对低剂量辐照小鼠血清及肝脏SOD活力和MDA含量的影响(±s,n=8)Tab. 2 Effect of cimetidine on SOD activity and MDA content in serum and liver of low-dose irradiated mice (±s,n=8)
Group Serum Liver SOD(U/ml) MDA(nmol/ml) SOD(U/mg.prot) MDA(nmol/mg.prot) Normal control 20.11±2.90 7.380±1.095 9.87±4.13 0.265±0.040 Model control 21.20±2.12 6.401±0.853 11.78±2.38 0.293±0.082 200mg/kg WR2721 21.66±2.28 7.769±1.020 9.42±2.64 0.210±0.077 7.5mg/kg CMTD 20.63±2.44 7.545±0.768 14.45±3.62 0.277±0.066 15mg/kg CMTD 20.80±1.07 7.957±1.105 9.55±2.46 0.227±0.054 30mg/kg CMTD 20.86±0.92 7.630±1.233 15.64±4.90 0.232±0.086
2.3 西咪替丁对低剂量辐照后小鼠骨髓DNA含量的影响 与空白对照组比较,0.7Gy辐照后24h,除15mg/kg西咪替丁组外,其余各组小鼠骨髓DNA含量均显著降低(P<0.05,P<0.01);与模型对照组比较,西咪替丁各剂量组小鼠骨髓DNA含量均无显著变化(P>0.05,图1)。
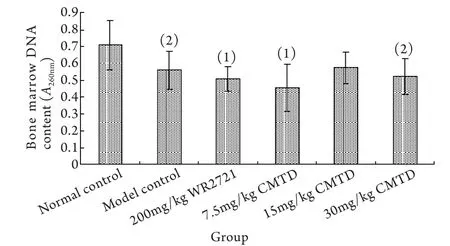
图1 西咪替丁对低剂量辐照小鼠骨髓DNA含量的影响(±s,n=8)Fig. 1 Effect of cimetidine on the content of bone marrow DNA of low-dose irradiated mice (±s,n=8)(1)P<0.05,(2)P<0.01 compared with normal control group
2.4 西咪替丁对低剂量辐照后小鼠骨髓嗜多染红细胞微核率的影响 与空白对照组比较,0.7Gy辐照后24h,模型对照组小鼠骨髓嗜多染红细胞微核率(fMPE)和成熟红细胞微核率(fNCE)均显著升高(P<0.01);与模型对照组比较,200mg/kg WR2721 组fMPE、fNCE和fMPE/fNCE均显著下降(P<0.05,P<0.01),7.5mg/kg西咪替丁组小鼠fMPE和fNCE显著下降(P<0.01),表明7.5mg/kg西咪替丁能够降低低剂量电离辐射导致的骨髓嗜多染红细胞微核率升高,剂量减低系数(dose reduction factor,DRF)值达到3.338(表3,图2)。
3 讨 论
低剂量电离辐射防护药物的研究较少,目前临床使用的辐射防护药主要是一些含硫的化合物,主要针对的是急性放射损伤[10],虽然有一定的保护作用,但存在一些副作用。西咪替丁是用于治疗胃及十二直肠溃疡等疾病的市售药物,多年的临床应用表明其安全可靠,无明显毒副作用。近年来,有研究报道西咪替丁对电离辐射损伤有较好的保护作用,其机制可能与抗氧化和提高免疫力有关。Ching等[11]在研究H2受体拮抗剂作为羟自由基清除剂的作用时发现,西咪替丁对羟自由基有较好的清除效果,表明其抗氧化效果较好。本研究检测结果显示,0.7Gy单次照射对小鼠血清和肝脏SOD活力和MDA含量无明显影响,提示若要观察西咪替丁对低剂量电离辐射的保护作用,需适当加大照射剂量造成氧化系统损伤,再观察西咪替丁的抗氧化作用。
表3 西咪替丁对低剂量辐照小鼠骨髓红细胞微核率的影响(±s,n=8)Tab. 3 Effect of cimetidine on fMPE of low-dose irradiated mice (±s,n=8)

表3 西咪替丁对低剂量辐照小鼠骨髓红细胞微核率的影响(±s,n=8)Tab. 3 Effect of cimetidine on fMPE of low-dose irradiated mice (±s,n=8)
fMPE. Frequencies of micronucleated polychromatic erythrocytes; fNCE. Frequencies of normochromatic erythrocytes. DRF. Dose reduction factor. (1)P<0.05,(2)P<0.01 compared with normal control group; (3)P<0.05,(4)P<0.01 compared with model control
Group fMPE (‰) fNCE (‰) fMPE/fNCE DRF Normal control 0.003±0.0011 0.003±0.0014 0.921±0.312 Model control 0.089±0.0170(2) 0.039±0.0111(2) 2.255±0.710(2)200mg/kg WR2721 0.015±0.0016(2)(4) 0.015±0.0033(2)(4) 1.018±0.229(3) 5.906 7.5mg/kg CMTD 0.027±0.0106(2)(4) 0.015±0.0085(2)(4) 1.758±0.168(1) 3.338 15mg/kg CMTD 0.057±0.0095(2) 0.025±0.0066(2) 2.297±0.584(2) 1.550 30mg/kg CMTD 0.060±0.0162(2) 0.022±0.0109(2) 2.765±0.518(2) 1.473
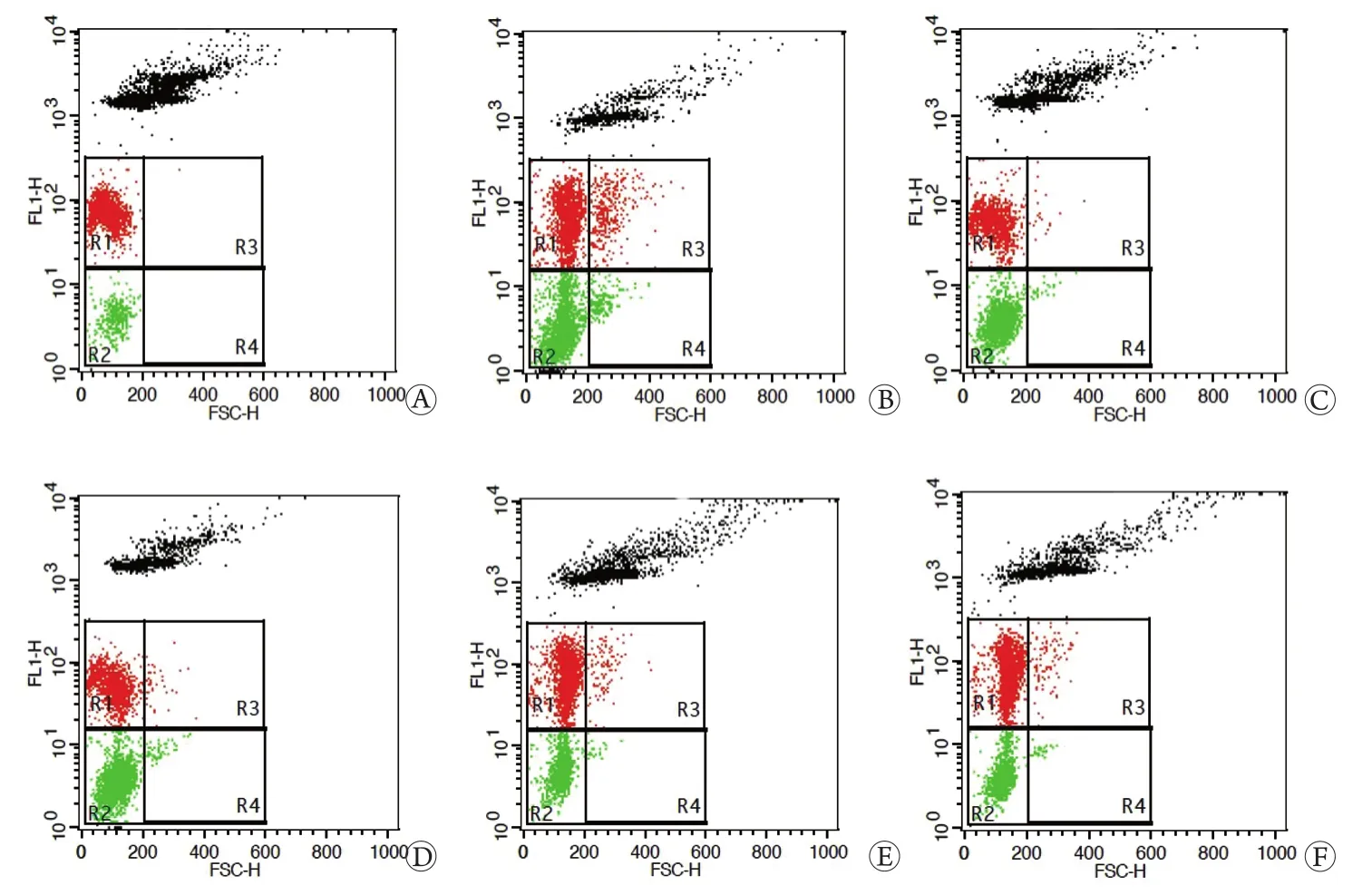
图2 小鼠骨髓红细胞微核率流式细胞检测图Fig. 2 FACS of fMPEs in the miceA. Normal control group; B. Model control group; C. 200mg/kg WR2721 group; D. 7.5mg/kg cimetidine group; E. 15mg/kg cimetidine group; F. 30mg/kg cimetidine group
造血系统是辐射的敏感靶点。国内外研究表明电离辐射可引起外周血象的显著下降。蒋定文等[12]在研究低剂量率裂变中子长期照射对大鼠外周血细胞的影响时发现,0.3Gy、0.4Gy和0.5Gy累积照射后小鼠的白细胞数显著降低。侯登勇等[13]在研究低剂量率60Co γ射线对SD大鼠的损伤生物效应时发现,0.5Gy累积照射后白细胞显著降低。本研究也发现0.7Gy60Co γ射线单次照射后24h,小鼠白细胞显著降低,表明外周血白细胞对辐射高度敏感,在单次照射小于1.0Gy后24h即可产生显著变化,可用作低剂量电离辐射损伤效应和低剂量电离辐射损伤防护药物的评价指标之一。骨髓DNA含量反映了骨髓有核细胞的数量。陈幸华等[14]检测了5.0Gy照射后小鼠骨髓DNA含量的变化,结果表明,照后3d小鼠骨髓DNA含量显著降低,7d时含量有所升高,但仍明显低于照射前。郑秀龙等[15]研究发现,0.7Gy60Co γ射线照射后家兔造血组织的DNA含量明显降低,且与剂量呈依赖关系。王珏等[16]研究发现小鼠骨髓DNA合成率随照射剂量的增高呈指数型下降。本研究发现,0.7Gy60Co γ射线单次照射后24h,小鼠骨髓DNA含量显著降低,表明骨髓DNA含量也可作为低剂量电离辐射损伤的评价指标,15mg/kg西咪替丁组小鼠骨髓DNA含量与模型对照组比较明显上升,与空白对照组相比已无显著差异,提示西咪替丁对照射后小鼠骨髓有核细胞的损伤有一定保护作用。
DNA断裂是辐射损伤的重要机制[17],未得到修复的DNA碎片可游离到细胞核外的区域并被吉姆萨染液着色,这种DNA片段被称为微核。Mozdarani等[18]研究发现西咪替丁可降低中子照射后小鼠骨髓细胞的微核率。Kojima等[19]报道西咪替丁可降低5Gy X射线照射后人外周血淋巴细胞的微核率。本研究采用吖啶橙染色分析骨髓嗜多染红细胞的微核率,结果显示,0.7Gy剂量照射后小鼠骨髓嗜多染红细胞微核率显著升高,表明受照小鼠骨髓DNA受到了损伤,而7.5mg/kg西咪替丁组小鼠骨髓嗜多染红细胞微核率显著降低,由照射后0.089‰降至0.027‰,DRF值达到3.338,表明西咪替丁可有效减轻低剂量电离辐射对小鼠骨髓细胞的损伤。
综上所述,外周血白细胞、骨髓DNA含量和骨髓嗜多染红细胞微核率可作为低剂量电离辐射损伤及其防护药物评价的指标。西咪替丁对0.7Gy单次低剂量照射小鼠外周血白细胞无明显保护作用,但对受照小鼠的骨髓细胞有一定的保护作用,能够显著降低低剂量电离辐射后骨髓嗜多染红细胞的微核率,促进低剂量电离辐射所致DNA断裂的修复,但其具体分子机制待于进一步研究。
[1]Chistiakov DA,Voronova NV,Chistiakov PA. Genetic variations in DNA repair genes,radiosensitivity to cancer and susceptibility to acute tissue reactions in radiotherapy-treated cancer patients[J]. Acta Oncol,2008,47(5): 809-824.
[2]Zhao JS,Feng CP,Wang SC. Clinical observation of cimetidine prevention of cerebral hemorrhage complicated stress ulcer bleeding[J]. Clin Med,2000,20(5): 57-58.[赵家松,冯翠平,王书成. 西米替丁预防脑出血并发应激性溃疡出血的临床观察[J]. 临床医学,2000,20(5): 57-58.]
[3]Zheng SL,Zhang LM. Cimetidine investigate treatment efficacy and mechanism of mumps[J]. Chin Foreign Med Treat,2009,(33): 75.[郑淑玲,张莉梅. 西米替丁治疗流行性腮腺炎的疗效观察及机理探讨[J]. 中外医疗,2009,(33): 75.]
[4]Li ZZ. New clinical researches on cimetidine[J]. Med Forum,2014,18(10): 1330-1331.[李宗臻. 西米替丁临床应用新进展[J]. 基层医学论坛,2014,18(10): 1330-1331.]
[5]Mou HG,Tan YX,Gao P,et al. Clinical study of acne vulgaris compound cimetidine topical treatment cream[J]. Chin J Lepr Skin Dis,2005,21(11): 879-880.[牟华光,谭艳霞,高鹏,等. 复方甲氰咪胍乳膏外用治疗寻常性痤疮的临床研究[J]. 中国麻风皮肤病杂志,2005,21(11): 879-880.]
[6]Ghorbani M,Mozdarani H.In vitroradioprotective effects of histamine H2receptor antagonists against gamma-rays induced chromosomal aberrations in human lymphocytes[J]. Iran J Radiat Res,2003,1(2): 99-104.
[7]Mozdarani H,Salimi M,Froughizadeh M. Effect of cimetidine and famotidine on survival of lethally gamma irradiated mice[J]. Iran J Radiat Res,2008,5(4): 187-194.
[8]Kabodanian Ardestani S,Mahmood Janlow M,Kariminia A,et al. Effect of cimetidime and ranitidine on lipid profile and lipid peroxidation in γ-irradiated mice[J]. Acta Medica Iranica,2004,42(3): 198-204.
[9]Mozdarani H,Gharbali A. Radioprotective effects of cimetidine in mouse bone marrow cells exposed to gamma-rays as assayed by the micronucleus test[J]. Int J Radiat Biol,1993,64(2): 189-194.
[10] Jia C,Zhang LZ,Xing S,et al. Protective effect of α-tocopherol succinate against early hematopoietic injury in mice with acute radiation sickness[J]. Med J Chin PLA,2014,39(4): 333-337.[贾超,张刘珍,邢爽,等. α-生育酚琥珀酸酯对急性放射病小鼠早期造血损伤的防护作用观察[J]. 解放军医学杂志,2014,39(4): 333-337.]
[11] Ching TL,Haenen GR,Bast A. Cimetidine and other H2receptor antagonists as powerful hydroxyl radical scavengers[J]. Chem Biol Interact,1993,86(2): 119-127.
[12] Jiang DW,Lei CX,Shen XR,et al. Effects of long-term,low dose rate fission neutron irradiation on the peripheral hematological cells in rat[J]. Chin J Radiol Health,2008,17(1): 12.[蒋定文,雷呈祥,沈先荣,等. 低剂量率裂变中子长期照射对大鼠外周血细胞的影响[J]. 中国辐射卫生,2008,17(1): 12.]
[13] Hou DY,Shen XR,He Y,et al. Effect of low-dose rate60Co γ-ray ionizing radiation on SD Rats[J]. Chin J Radiol Health,2012,21(1): 11-12.[侯登勇,沈先荣,何颖,等. 低剂量率60Co γ射线对SD大鼠的损伤生物效应研究[J]. 中国辐射卫生,2012,21(1): 11-12.]
[14] Chen XH,Luo CJ,Guo ZH,et al. Changes of cell cycle and DNA content in bone marrow stromal cells after radiation injury in mice[J]. Acta Acad Med Mil Tertiae,1996,18(3): 209-210.[陈幸华,罗成基,郭朝华,等. 5.0Gy放射损伤对小鼠早期骨髓造血基质细胞周期及其DNA含量的影响[J]. 第三军医大学学报,1996,18(3): 209-210.]
[15] Zheng XL,Wu DL,Liu QN,et al. Changes in the DNA of hematopoietic tissue of animals after ionizing radiation[J]. Acad J Second Mil Med Univ,1981,(4): 317-320.[郑秀龙,吴德林,刘巧年,等. 电离辐射后动物造血组织内DNA的变化[J]. 第二军医大学学报,1981,(4): 317-320.]
[16] Wang J,Zhang SY,Wang BQ,et al. The effect of neutron-γ ray irradiation effect on mouse bone marrow mixed DNA synthesis[J]. Bullet Acad Mil Med Sci,1982,(2): 133-137.[王珏,张水英,王宝勤,等. 中子-γ射线混合照射对小鼠骨髓DNA合成的影响[J]. 军事医学科学院院刊,1982,(2): 133-137.]
[17] He Y,Shen XR,Jiang DW,et al. Protective effects ofSipunculus nuduspolysaccharides against combined injury of low-dose irradiation,carbon monoxide,benzene and noise in rat[J]. Med J Chin PLA,2012,37(10): 994-997. [何颖,沈先荣,蒋定文,等.方格星虫多糖对低剂量电离辐射、一氧化碳、苯和噪声复合损伤大鼠的保护作用观察[J]. 解放军医学杂志,2012,37(10): 994-997.]
[18] Mozdarani H,Khoshbin-Khoshnazar AR.In vivoprotection by cimetidine against fast neutron-induced micronuclei in mouse bone marrow cells[J]. Cancer Lett,1998,124(1): 65-71.
[19] Kojjma Y,Kondo T,Zhao QL. Protective effects of cimetidine on radiation-induced micronuclei and apoptosis in human peripheral blood lymphocytes[J]. Free Radic Res,2002,36(3): 255-63.
Protective effects of cimetidine on micronucleated polychromatic erythrocytes in mice irradiated with 0.7Gy
ZHANG Jun-ling,HE Ying,WANG Qing-rong,LI Na,JIANG Ding-wen,HOU Deng-yong,LIU Yu-ming,CHEN Wei,LIU Qiong,LI Ke-xian,ZONG Jie,LI Jia-mei,SHEN Xian-rong*
Department of Protection Medicine,Naval Medical Research Institute,Shanghai 200433,China
*< class="emphasis_italic">Corresponding author,E-mail: xianrong_sh@163.com
,E-mail: xianrong_sh@163.com
This work was supported by the Major Projects of National Science and Technology (2004ZX09J14103-07B)
ObjectiveTo study the radioprotective effect of cimetidine on single low-dose irradiated mice with radiosensitive detection indexes.MethodsForty-eight healthy male C57BL/6 mice were randomly divided into normal control group,model control group,positive group (200mg/kg WR2721) and cimetidine groups (7.5mg/kg,15mg/kg and 30mg/kg). The mice were given intraperitoneal injection of cimetidine 2h before irradiation in cimetidine groups and WR2721 before irradiation once a day for two days in positive group. All the mice except those in normal control group were irradiated with 0.7Gy60Co γ-ray at 5.83mGy/min rate. Peripheral blood cells,superoxide dismutase (SOD) activity and malondialdehyde (MDA) content both in serum and liver,bone marrow DNA content and frequency of micronucleated polychromatic erythrocytes (fMPEs) were determined 24h after irradiation.ResultsCompared with normal control group,the peripheral white blood cells (WBCs) of irradiated mice decreased significantly (P<0.01),and fMPEs increased significantly (P<0.01) after irradiation. Except for 15mg/kg cimetidine group,the bone marrow DNA content was decreased significantly after irradiation (P<0.01,P<0.05). The SOD activity and MDA content in irradiated mice showed no significant difference compared with that of normal mice. Compared with model control group,peripheral WBCs and bone marrow DNA content showed no significant changes in treatment groups. The fMPE of 7.5mg/kg cimetidine group was 0.027‰,which was decreased significantly compared with that of model control group (P<0.01),and the dose reduction factor (DRF) of 7.5mg/kg cimetidine group was 3.338.ConclusionCimetidine has good protective effect on micronucleated polychromatic erythrocytes (MPEs) in mice irradiated by 0.7Gy in single low-dose.
cimitidine; radiation,ionizing; polychromatic erythrocytes; micronucleus tests
R148
A
0577-7402(2015)12-0950-05
10.11855/j.issn.0577-7402.2015.12.03
2015-07-09;
2015-08-13)
(责任编辑:李恩江)
国家科技重大专项课题(2004ZX09J14103-07B)
张俊玲,工学硕士。主要从事辐射防护医学方面的研究
200433 上海 海军医学研究所辐射防护效应研究室(张俊玲、何颖、王庆蓉、李娜、蒋定文、侯登勇、刘玉明、陈伟、刘琼、李珂娴、宗杰、李佳媚、沈先荣)
沈先荣,E-mail:xianrong_sh@163.com
