miRNA-377调控钙通道蛋白在心房颤动中的作用
2015-06-28李龙苏迎李泱杨水祥
李龙,苏迎,李泱,杨水祥
miRNA-377调控钙通道蛋白在心房颤动中的作用
李龙,苏迎,李泱,杨水祥
目的探讨miRNA-377(miR-377)与房颤相关离子通道蛋白的靶向调控关系。方法实验分为过表达组、干扰组、阴性组和空白组。将L型钙离子通道α1C亚单位(CACNA1C)的重组荧光素酶报告质粒与miR-377模拟体及阴性对照共转染于人胚胎肾HEK293细胞,检测各组荧光素酶的相对活性。将miR-377模拟体、干扰体及阴性对照导入大鼠胚胎心肌H9C2细胞,观察其对靶基因的表达和功能调控。结果与阴性组比较,过表达miR-377组CACNA1C荧光素酶相对活性降低31%(0.316±0.006vs0.455±0.008,P=0.009),过表达组及干扰组CACNA1C、CACNB2基因mRNA表达水平无明显变化。miR-377模拟体转入H9C2细胞可抑制CACNA1C蛋白表达(P<0.05),降低L型Ca电流的密度,使其峰值密度从–3.23±0.64pA/pF降至–2.26±0.16pA/pF(P<0.05)。结论CACNA1C基因可能是miR-377的直接靶基因,miR-377可能通过抑制CACNA1C的表达从而降低L型钙电流来参与房颤电重构,有可能成为房颤干预治疗的靶点。
心房颤动;微RNAs;离子通道;钙通道,L型;膜片钳技术
心房颤动(房颤)是心血管疾病患者死亡的重要原因之一[1-2]。房颤是常见的由一系列心脏疾病引起心房重构的终点事件,其本身也能引起心房重构从而促进心律失常的发展[3]。射频消融手术是目前治疗房颤的主要方法之一,但术后复发率仍较高[4]。房颤的发病机制至今尚不清楚,且缺乏有效的早期预警诊断方法。研究表明,微小RNA(microRNAs,miRNAs)参与调控房颤相关的多种基因[5-7]。miRNAs是一类包含21个左右核苷酸的非编码小分子RNA,在转录后的基因调控中发挥重要作用。miRNA通过与mRNA非翻译区完全或不完全结合诱导mRNA降解或阻止其翻译,广泛调控机体的发育和代谢过程[8]。对行射频消融术治疗的房颤患者miRNA表达谱的相关研究发现,房颤患者术前外周血miR-377表达水平相对正常对照上调4.27倍,而其术后表达水平仅为自身术前的1/102.9[9]。为进一步探索miR-377在房颤发病机制中的作用,本研究结合Targetscan等软件预测miR-377的靶基因,并对预测结果采用双荧光素酶报告系统进行验证,应用过表达和干扰等手段在大鼠心肌H9C2细胞中检测CACNA1C等的mRNA和蛋白表达水平,并通过膜片钳技术观察miR-377对L型Ca电流的影响,明确其内源性活性和生理学作用,旨在预测其在房颤发生发展及预后中的调控意义。
1 材料与方法
1.1 材料 人胚胎肾HEK293细胞及大鼠胚胎心肌H9C2细胞(协和细胞中心),DMEM培养基及胎牛血清(Gibco公司,美国),阳离子脂质体Lipo 2000 及Opti-MEM培养液(Life公司,美国),双荧光素酶报告系统(Promega公司,美国)。Has-miR-377模拟体Mimics、干扰体Inhibitor(上海吉玛公司),miRneasy mini Kit(Qiaqen公司,德国),反转录及qPCR试剂(北京TransGen公司),抗CACNA1C小鼠单克隆抗体(ab84814)、抗CACNB2小鼠单克隆抗体(ab93606)(Abcam公司,英国),抗GAPDH小鼠单克隆抗体(TA-08)、辣根过氧化物酶标记的兔抗鼠IgG(北京中杉金桥公司)。
钙电流的细胞外液(mmol/L):NaCl 125、BaCl210.8、MgCl21.0、CsCl 5.4、Glucose 10,Hepes 10、NaOH调定至pH 7.35。钙电流的细胞内液(mmol/L):CsCl 120、MgCl23.0、EGTA 10、Mg-ATP 5、Hepes 5,CsOH调定至pH 7.3。
1.2 方法
1.2.1 靶基因预测 采用在线数据库筛选miR-377的靶基因,取3个主要数据库(Targetscan、miRanda、miRDB)的交集,并结合文献报道选择与房颤电重构相关且得分较高的离子通道基因作为进一步实验的候选基因。
1.2.2 双荧光素酶报告基因检测 电压门控L型钙离子通道α1C亚基(CACNA1C)重组荧光素酶质粒由Invitrogen公司设计合成。将处于对数生长期的HEK293细胞按每孔5×105个细胞接种于6孔板,在细胞覆盖率90%时进行转染实验,转染前更换Opti-MEM培养液。实验分为过表达组、干扰组、阴性组和空白组4组。CACNA1C重组荧光素酶质粒的量为250ng,miR-377模拟体及阴性对照的浓度为60nmol/L,将Lipo 2000与Opti-MEM混合,室温静置30min,共转染至HEK293细胞中,培养4~6h后,更换完全培养液,继续培养至48h后取样检测。弃细胞培养液,用PBS洗3次;每孔加入600μl细胞裂解液,室温摇动裂解15min;将裂解液移至离心管,12 000×g离心30s,将上清转移至干净的离心管;测量皿中加入100μl萤火虫荧光素酶检测试剂Ⅱ;加入20μl细胞裂解液,用移液器混匀,置分光光度计读值,记录数据;加入100μl海肾荧光素激活液(Stop & Glo),混匀,读值并记录数据。
1.2.3 qRT-PCR检测基因的mRNA表达 同上,将m i R-4 2 7 9模拟体、干扰体及阴性对照(浓度60nmol/L)转染至大鼠心肌H9C2细胞,继续培养4 8 h,提取各组细胞总R N A,NanoDrop2000评估各样本的质量,A260/A280在1.8~2.1,A260/A230>1.8为合格。各样本上样1μg,随机反转录为cDNA。CACNA1C上游引物5'-GATGCAAGACGCTATGGGCTATGAG-3',下游引物5'-GCATGCTCATGTTTCGGGGTTTGTC-3',CACNB2上游引物5'-GGACCACTGTTTCTTGCTTG T-3',下游引物5'-GCATGCTCATGTTTCGGGGTTT GTC-3';内参β肌动蛋白上游引物5'-CTGCTGACTT GGCATTAAGA-3',下游引物5'-AAAGAAAGGGTGT AAAACGCA-3'。以对照组第一个样本为参照样本,采用2-ΔΔCt法评估各组相对表达数值。实验重复3次。
1.2.4 Western blotting检测CACNA1C、CACNB2蛋白的表达 提取各组细胞总蛋白,采用BCA法定量,每孔上样60μg,8%分离胶、6%浓缩胶电泳,至梯度缓冲液跑至胶底部停止,4℃ 250mA恒流电转3h,5%脱脂奶粉封闭2h,加入抗CACNA1C小鼠单克隆抗体(1:200稀释)、抗CACNAB2小鼠单克隆抗体(1:500稀释)、内参GAPDH小鼠单克隆抗体(1:1000稀释)4℃孵育过夜,洗膜3次,每次10min,加入辣根过氧化物酶标记的兔抗鼠IgG(1:3000稀释)室温避光孵育50min,洗膜3次,每次10min。增强化学发光法曝光,暗室显影10min,定影1min。读片。
1.2.5 膜片钳技术检测L型钙电流 在全细胞膜片电压钳模式下记录L型钙电流,膜片钳放大器为AXON-700B,信号控制软件为pCLAMP 10.4,玻璃毛坯(GG-17)经微电极拉制仪(Narishige,pp-830)拉制成玻璃电极,电阻为3.0~4.5MΩ,调节三维操纵器进行封接,使封接电阻达1GΩ以上。测定电容时,刺激方案为0.4V/s的斜坡刺激,按公式Cm=I/(dV/dt)计算膜电容(Cm);为消除细胞间误差,电流值以电流密度,即电流幅值与细胞电容的比值(pA/pF)表示。
刺激方案:ICa-LI-V曲线:电压钳模式,钳制电位–40mV,阶跃10mV,–40~+50mV的系列去极化脉冲刺激,持续150ms,求算pA/pF。
1.3 统计学处理 采用SPSS 13.0软件进行统计分析。所有数据均以表示,多组间比较进行方差齐性检验,满足方差齐性采用单因素方差分析,进一步两两比较采用SNK-q检验,如方差不齐采用Kruskal-Walls法分析。P<0.05为差异有统计学意义。
2 结 果
2.1 靶基因预测 以Targetscan为主要软件预测的可能靶基因为:①CACNA1C,此为L型钙通道核心亚基;②电压门控L型钙通道β亚基(CACNAB2),此为L型钙通道辅助亚基。具体数据为:人CACNA1C非翻译区,NM_000719.6,人KCNB2非翻译区,NM_000219.4。含有上述非翻译区的重组荧光素酶质粒交由Invitrogen公司合成。
2.2 双荧光素酶相对活性分析 将含有CACNA1C非翻译区的重组荧光素酶报告质粒与miR-377模拟体及阴性对照共转染于人胚胎肾HEK293细胞48h后,检测荧光素酶的活性。分析发现,与阴性组比较,过表达组相对荧光素酶活性降低31%(0.316±0.006vs0.455±0.008,P=0.009),而干扰组相对荧光素酶活性与阴性组比较差异无统计学意义(0.489±0.003vs0.455±0.008,P=0.094,图1)。
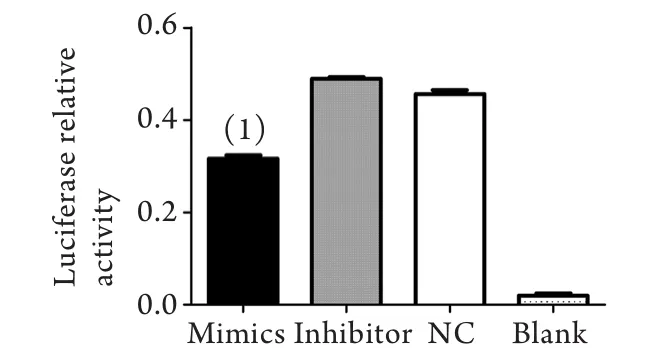
图1 各组萤火虫/海肾荧光素酶相对值Fig.1 Relative activity of firefly/renilla luciferase in each group(1)P<0.05 compared with negative control (NC) group
2.3 miR-377对CACNA1C mRNA表达水平的影响 将miR-377模拟体、干扰体及阴性对照分别转染大鼠胚胎心肌细胞48h后,qRT-PCR检测显示,过表达组CACNA1C mRNA表达水平为0.820±0.058,干扰组为0.898±0.061,阴性组为0.883±0.087,空白组为1.042±0.030。过表达组和干扰组mRNA表达水平与阴性组比较差异无统计学意义(P=0.329、P=0.923);与空白组比较,过表达组mRNA表达水平下调21%(P=0.011),而干扰组mRNA表达水平与空白组比较差异无统计学意义(P=0.099,图2)。
2.4 miR-377对CACNB2 mRNA表达水平的影响将miR-377模拟体、干扰体及阴性对照分别转染大鼠胚胎心肌细胞48h后,qRT-PCR检测显示,过表达组CACNB2 mRNA表达水平为1.177±0.077,干扰组为1.048±0.095,阴性组为1.116±0.097,空白组为0.984±0.090。过表达组和干扰组mRNA表达水平与阴性组比较差异无统计学意义(P=0.637、P=0.739);与空白组比较,过表达组mRNA表达水平上调19%(P=0.006),而干扰组mRNA表达水平与空白组比较差异无统计学意义(P=0.748,图3)。

图2 miR-377对CACNA1C mRNA表达水平的影响Fig.2 Effects of miR-377 on the expression level of CACNA1C mRNA (qRT-PCR) (1)P<0.05 compared with blank group

图3 miR-377对CACNB2 mRNA表达水平的影响Fig.3 Effect of miR-377 on the expression level of CACNB2 mRNA (qRT-PCR) (1)P<0.05 compared with blank group
2.5 miR-377对CACNA1C、CACNB2蛋白表达的影响 将miR-377模拟体、干扰体及阴性对照转染大鼠胚胎心肌细胞48h后,Western blotting检测显示,过表达组CACNA1C蛋白表达水平明显下降,与阴性组和空白组比较差异有统计学意义(P<0.05),干扰组CACNA1C蛋白表达水平增加,与阴性组和空白组比较差异有统计学意义(P<0.05);过表达组CACNB2蛋白表达水平增加,与阴性组和空白组比较差异有统计学意义(P<0.05),干扰组CACNB2蛋白表达水平明显下降,与阴性组和空白组比较差异均有统计学意义(P<0.05,图4)。
2.6 miR-377对L型Ca电流密度的影响 将miR-377模拟体及阴性对照转染大鼠胚胎心肌细胞,采用全细胞膜片钳技术检测L型Ca电流密度的改变,结果显示,当刺激电位为10mV时,ICa-L峰值密度为–3.23±0.64pA/pF,过表达miR-377使ICa-L密度峰值降低至–2.26±0.16pA/pF(n=15,P<0.05)。I-V曲线显示,过表达miR-377后,ICa-L密度降低,尤其以峰值附近为甚,但没有改变峰值电位、翻转电位和I-V曲线形状(图5)。
3 讨 论
近年来研究发现,多种miRNA与房颤心房重构密切相关。Lu等[10]发现,miR-328可下调L型钙通道α亚基,使动作电位时程缩短,促进房颤的维持。miR-26可上调内向整流钾通道,也促进房颤的维持[11],miR-29可降低上调胶原蛋白1A1和3A1,促进细胞外基质的沉积,促进心房结构重构[12]。目前公认miRNA可以指导效应复合物RISC通过两种不同的机制下调靶基因的表达,如miRNA的种子区(5'端2-8nt)与靶基因mRNA 3'端非翻译区完全互补,则降解靶基因mRNA,常见于植物,如果与靶基因mRNA不完全互补,则会引起靶mRNA翻译的抑制,常见于动物[13]。
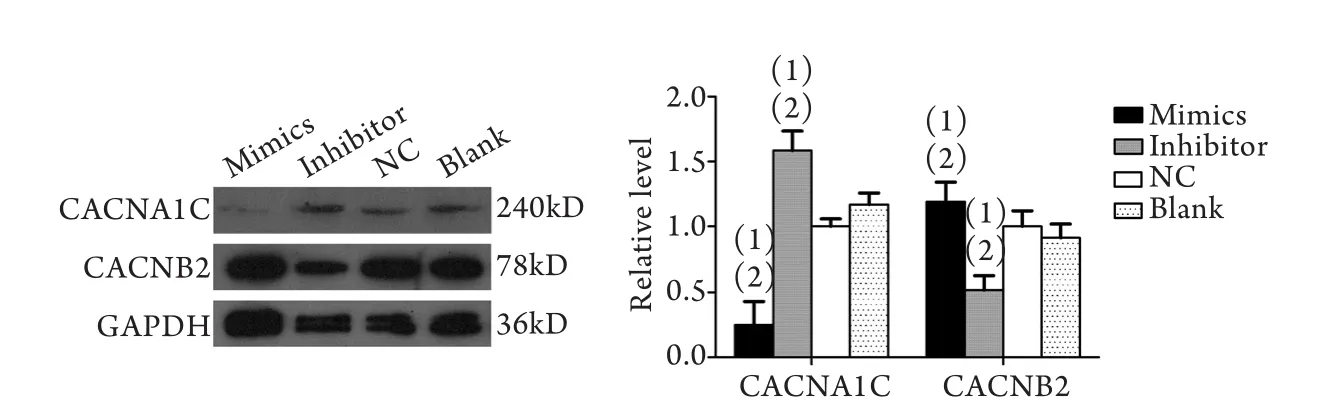
图4 miR-377对CACNA1C、CACNB2蛋白表达的影响Fig.4 Effect of miR-377 on the protein levels of CACNA1C and CACNB2 (Western blotting)(1)P<0.05 compared with blank group; (2)P<0.05 compared with negative control (NC) group

图5 miR-377对大鼠H9C2细胞ICa-L的影响Fig.5 Effects of miR-377 on L-type calcium current of rat's H9C2 cells (Patch clamp)A. Recordings of ICa-Lof rat's H9C2 cells. Currents elicited by 150ms depolarized pulse –40-+50mV. B. Current-voltage relationship of ICa-Lof two groups
本课题组前期研究发现,房颤患者射频消融术前外周血miR-377表达与正常对照组比较明显上调,而术后则明显下降[9],表明房颤射频消融术不仅起到电隔离的作用,而且改变和恢复了调控离子通道蛋白的主要miRNAs表达异常[14],对房颤的电重构起到了离子流逆重构的作用,同时循环miR-377可能成为手术疗效和房颤预后的新靶标。
本研究结合荧光素酶、PCR、免疫印迹和膜片钳技术,探索房颤相关miR-377的靶基因及其功能学作用。双荧光素酶报告系统发现,miR-377过表达组CACNA1C的双荧光素酶活性明显下调,提示miR-377与CACNA1C的非翻译区可结合。CACNA1C编码L型Ca通道的α亚基(核心亚基),与辅助亚基CACNB1作为miR-328的靶基因在房颤中发挥重要作用[10]。另有学者发现,miR-21可通过调节CACNA1C和辅助亚基CACNB2减少ICa-L电流,可能是房颤的重要机制之一[15]。为进一步探索miR-377在心脏中的作用,结合荧光素酶结合实验,本研究将miR-377模拟体导入大鼠胚胎心肌H9C2细胞,结果发现与对照组相比,miR-377过表达组CACNA1C mRNA表达水平无明显改变,蛋白表达水平明显下调,提示miR-377并未影响CACNA1C的转录,而是通过阻止蛋白翻译来发挥作用,这种miRNA转录后调控机制在动物体内常见,与大多数文献报道一致[16]。与对照组相比,miR-377过表达组CACNB2的蛋白水平略上调,机制尚不清楚,一种可能是CACNB2并非miR-377的直接靶基因,miR-377通过其他途径间接促使了CACNB2的表达上调,另一种可能是CACNB2的确是miR-377的靶基因,有文献报道某些miRNA会上调靶基因的表达,这种解释值得商榷。过表达miR-377通过减少Ca通道核心亚基CACNA1C蛋白表达量,使心肌动作电位平台期L型Ca电流密度降低,心房有效不应期缩短,动作电位时程缩短及传导速度减慢,从而有利于房颤的发生发展。
本研究发现一个新的miRNA分子miR-377可能参与房颤调控,并进一步证实其可能通过靶基因CACNA1C发挥作用,未来可能成为房颤的重要干预靶点。虽然本实验证实了miR-377可下调CACNA1C的表达水平,并降低L型Ca电流的密度,但尚有不足,即通过房颤模型观察miR-377对L型Ca电流的改变,另外,虽然发现miR-377在大鼠心肌细胞具有内源性活性,但尚未在人的心房肌细胞得到证实。近年来干细胞技术逐渐成熟,下一步拟考虑选用诱导多能干细胞(iPSCs)制备人心肌细胞,并在房颤动物模型层面进一步观察,为深层次地认识miR-377对于房颤的作用提供依据。
[1]Chahal CA,Somers VK. Risk factors: Sleep apnoea,atrial fibrillation,and heart failure-quo vadis[J]? Nat Rev Cardiol,2015,12(5): 263-264.
[2]Chen AH,Song XD,Yang PZ. Current status and dilemma of radiofrequency ablation for atrial fibrillation[J]. Med J Chin PLA,2015,40(2): 85-91. [陈爱华,宋旭东,杨平珍. 房颤射频消融治疗的现状与困境[J]. 解放军医学杂志,2015,40(2): 85-91.]
[3]Wakili R,Voigt N,Kaab S,et al. Recent advances in the molecular pathophysiology of atrial fibrillation[J]. J Clin Invest,2011,121(8): 2955-2968.
[4]Kaba RA,Cannie D,Ahmed O. RAAFT-2: Radiofrequency ablationvsantiarrhythmic drugs as first-line treatment of paroxysmal atrial fibrillation[J]. Glob Cardiol Sci Pract,2014,2014(2): 53-55.
[5]Qi XY,Huang H,Ordog B,et al. Fibroblast inward-rectifier potassium current upregulation in profibrillatory atrial remodeling[J]. Circ Res,2015,116(5): 836-845.
[6]Zhang Y,Zhao YX,Guo HY,et al. Preliminary study of circulating microRNA expression profiles in patients with auricular fibrillation[J]. Med J Chin PLA,2012,37(3): 195-199. [张瑜,赵月香,郭红阳,等. 心房颤动患者循环microRNAs表达谱的初步研究[J]. 解放军医学杂志,2012,37(3): 195-199.]
[7]Chiang DY,Kongchan N,Beavers DL,et al. Loss of microRNA-106b-25 cluster promotes atrial fibrillation by enhancing ryanodine receptor type-2 expression and calcium release[J]. Circ Arrhythm Electrophysiol,2014,7(6): 1214-1222.
[8]Chiang DY,Zhang M,Voigt N,et al. Identification of microRNA-mRNA dysregulations in paroxysmal atrial fibrillation[J]. Int J Cardiol,2015,184: 190-197.
[9]Zhao S,Yang N,Yue YN,et al. Radiorequency ablation of atrial fibrillation rebalances atrial ion current remolding by regulating miRNAs[J]. Chin J Geriatr Heart Brain Vessel Dis,2015,17(7): 725-731. [赵晟,杨诺,岳语喃,等. 射频消融术改变心房颤动患者外周血微小RNA表达谱[J]. 中华老年心脑血管病杂志,2015,17(7): 725-731.]
[10] Lu Y,Zhang Y,Wang N,et al. MicroRNA-328 contributes to adverse electrical remodeling in atrial fibrillation[J]. Circulation,2010,122(23): 2378-2387.
[11] Nattel S,Harada M. Atrial remodeling and atrial fibrillation: recent advances and translational perspectives[J]. J Am Coll Cardiol,2014,63(22): 2335-2345.
[12] Dawson K,Wakili R,Ordög B,et al. MicroRNA29: a mechanistic contributor and potential biomarker in atrial fibrillation[J]. Circulation,2013,127(14): 1466-1475.
[13] Kim VN,Han J,Siomi MC. Biogenesis of small RNAs in animals[J]. Nat Rev Mol Cell Biol,2009,10(2): 126-139.
[14] McManus DD,Tanriverdi K,Lin H,et al. Plasma microRNAs are associated with atrial fibrillation and change after catheter ablation (the miRhythm study)[J]. Heart Rhythm,2015,12(1): 3-10.
[15] Barana A,Matamoros M,Dolz-Gaiton P,et al. Chronic atrial fibrillation increases microRNA-21 in human atrial myocytes decreasing L-type calcium current[J]. Circ Arrhythm Electrophysiol,2014,7(5): 861-868.
[16] Wang Z,Lu Y,Yang B. MicroRNAs and atrial fibrillation: new fundamentals[J]. Cardiovasc Res,2011,89(4): 710-721.
The role of miR-377 on atrial fibrillation by regulating calcium channel proteins
LI Long1,SU Ying1,LI Yang2,YANG Shui-xiang1*1Department of Cardiology,Peking University Ninth School of Clinical Medicine,Beijing 100038,China
2Institute of Geriatric Cardiology,General Hospital of PLA,Beijing 100853,China
*< class="emphasis_italic">Corresponding author,E-mail: sxyang68@163.com
,E-mail: sxyang68@163.com
This work was supported by Beijing Natural Science Foundation (7083108)
ObjectiveTo explore the effect of targeted regulation of miR-377 on atrial fibrillation (AF)-associated ion channel protein by means of overexpression and interference.MethodsThe study designs 4 groups as follows: overexpression,interference,negative control and blank groups. The recombinant luciferase reporter plasmids,miR-377 mimics and negative control mimics were co-transfected into HEK293 cells,and the relative activity of luciferase in each group was assayed. MiR-377 mimics,inhibitor and negative control mimics were transfected into H9C2 cells to investigate the effect on regulation of target gene expression and function.ResultsThe relative activities of CACNA1C recombinant plasmids luciferase were lower in miR-377 overexpression group than that in negative control group (0.316±0.006vs0.455±0.008,P=0.009). The mRNA levels of CACNA1C and CACNB2 showed no significant difference in overexpression group or interference group compared with that in negative control group. The CACNA1C protein expression was inhibited by miR-377 mimics-transfected H9C2 cells,and L-type calcium current peak density decreased from –3.23±0.64pA/pF to –2.26±0.16pA/pF (P<0.05).ConclusionVoltage-gated L-type calcium channel alpha subunit CACNA1C is probably the direct target gene of miR-377,and it may become a new AF intervening target in future by influencing CACNA1C expression,L-type calcium current as well as AF electrical remolding.
atrial fibrillation; microRNAs; ion channels; calcium channels,L-type; patch-clamp technique
R541.75
A
0577-7402(2015)12-0955-05
10.11855/j.issn.0577-7402.2015.12.04
2015-09-06;
2015-10-19)
(责任编辑:张小利)
北京市自然科学基金(7083108)
李龙,硕士研究生。主要从事心脏电生理方面的研究
100038 北京 北京大学第九临床医学院(李龙、苏迎、杨水祥);100853 北京 解放军总医院老年心血管病研究所(李泱)
杨水祥,E-mail:sxyang68@163.com
