新型大鼠下腔静脉血栓模型的建立及血栓溶解演变过程研究
2015-06-28付健唐博陈以宽孙建明罗文军
付健,唐博,陈以宽,孙建明,罗文军
新型大鼠下腔静脉血栓模型的建立及血栓溶解演变过程研究
付健,唐博,陈以宽,孙建明,罗文军
目的探讨一种新的大鼠下腔静脉血栓模型建立方法,并动态研究静脉血栓溶解的自然演变过程和相关机制。方法SD大鼠48只随机分为实验组和对照组。实验组缩窄下腔静脉管腔面积80%~90%,然后随机分为3组(n=12):A组结扎左肾静脉以下下腔静脉所有属支并以神经生物夹刺激静脉壁诱导血管内皮损伤;B组联合神经生物钳损伤下腔静脉壁;C组联合结扎下腔静脉所有属支。对照组(D组,n=12)为假手术组,仅游离而不缩窄下腔静脉。术后比较各组静脉血栓的长度、重量和管腔面积百分比,确定下腔静脉血栓动物模型的最佳建模方式。另取大鼠30只,按最佳方式建模,术后行下腔静脉造影及血栓HE和Masson染色、ED-1免疫组化染色,动态分析静脉血栓溶解的自然演变过程及参与此过程的细胞类型。结果大体观察结果显示A、B、C组均成功诱导血栓形成,A组血栓长度及重量明显高于B、C组(P<0.01),而B、C组间比较无明显差异(P>0.05),D组无血栓形成。A组静脉血栓占下腔静脉管腔面积明显大于B、C组(P<0.01),确定A组为最佳动物模型组。最佳模型组血栓HE和Masson染色结果显示,随时间推移,血栓溶解过程中新生毛细血管逐渐增多,胶原纤维及细胞外基质成分含量逐渐增加;ED-1染色结果显示血栓溶解过程伴有大量巨噬细胞浸润;静脉造影结果表明下腔静脉血栓自然溶解完全再通需3~4周。结论采用缩窄下腔静脉管腔联合结扎静脉属支并损伤血管壁法诱导形成的大鼠下腔静脉血栓与人类深静脉血栓近似,可作为建立深静脉血栓动物模型的首选方法。大鼠下腔静脉血栓的自然溶解演变过程伴随血管新生,而巨噬细胞在此过程中具有重要作用。
静脉血栓形成;疾病模型,动物;病理过程
静脉血栓栓塞性疾病在世界范围内均有较高的发病率及死亡率,每年约90万人发生静脉血栓栓塞,死亡率高达25%~30%[1-2]。目前国内尚缺乏静脉血栓准确的流行病学资料,而随着诊断意识和检查技术的提高,临床报道的病例数明显增加,但临床治疗效果尚不尽如人意[3-4]。为改变这一现状,势必需要分析静脉血栓的自然溶解过程及相关机制,从而指导临床探索加速静脉血栓溶解再通的有效途径。既往报道建立静脉血栓动物模型的方法有多种,但均存在一定限制和缺点[5],本研究对已报道的建模方式加以改进,试图建立一种新型、高效、稳定的静脉血栓动物模型,使其能更好地模拟人体深静脉血栓形成的病理生理过程,为进一步的实验研究及药物治疗奠定基础。
1 材料与方法
1.1 实验动物及主要试剂 健康成年SD大鼠48只,雄性,体重327.4±41.7g,由重庆医科大学动物实验中心提供;显微外科器械由重庆医科大学附属第二医院外科实验室提供;26G注射器针头购自BD公司;Masson染色试剂盒和二抗生物素标记羊抗鼠IgG试剂盒购自福州迈新公司;兔抗大鼠ED-1单克隆抗体购自Santa Cruz公司;造影剂碘普罗胺购自Bayer公司。
1.2 方法
1.2.1 造模 将48只大鼠随机分为实验组(n=36)和对照组(n=12),实验组再随机分为A、B、C组(各12 只),对照组为D组。实验组参照Brill等[6]的方法加以改进建立下腔静脉血栓模型。大鼠经10%水合氯醛(350mg/kg)腹腔注射麻醉,正中切口进腹,游离下腔静脉并顺血管壁放置26G针头,以4-0丝线于左肾静脉下方同时结扎下腔静脉和针头,小心拔出针头,使下腔静脉缩窄80%~90%。此基础上,A组结扎左肾静脉以下下腔静脉所有属支并以神经生物夹刺激静脉壁诱导血管内皮损伤;B组联合神经血管钳阻断下腔静脉60s,松开30s,不同部位各重复2次以损伤下腔静脉壁;C组联合结扎下腔静脉所有属支。D组同法游离下腔静脉并在左肾静脉下方穿过4-0丝线,缝线打空心结不缩窄下腔静脉,不结扎静脉属支。所有动物术后自由饮水,正常饲养,不使用抗生素。
1.2.2 标本准备 动物处死后沿原腹部切口作梭形切口进腹,解剖左肾静脉以下下腔静脉至左右髂总静脉汇合处,显微剪完整分离下腔静脉,切取左肾静脉以下下腔静脉及其内部的血栓,4%多聚甲醛固定,石蜡包埋、常规切片后行HE、Masson染色及ED-1免疫组化染色。
1.2.3 最佳建模方式的确定 各组造模后,分别于术后1、3、7d处死大鼠,按照上述方法制备血栓标本,根据大体标本分析及血栓面积占下腔静脉管腔面积百分比确定最佳建模方式。
1.2.3.1 血栓大体标本分析 观察下腔静脉的颜色、张力,取材后测定离体血栓的长度及重量,行组间比较。
1.2.3.2 血栓面积占下腔静脉管腔面积百分比的测定 血栓标本行HE染色,从结扎点依次向远端间隔3mm连续切片5张,40倍视野下观察并计算血栓面积占下腔静脉管腔面积的百分比。
1.2.4 血栓溶解演变过程分析 另取SD大鼠30只,按前述筛选出的最佳方式建模,于1、3、7、14、21、28d取血栓标本进行分析。
1.2.4.1 血栓溶解率测算 常规HE染色,从结扎点依次向远端间隔3mm连续切片5张,40倍视野下观察并计算血栓溶解率。血栓溶解率=(管腔面积-血栓面积)/管腔面积×100%。分析血栓溶解率与时间的关系。
1.2.4.2 血栓机化率及毛细血管计数测算 Masson染色将胶原纤维、细胞外基质及血管壁染成蓝色,细胞核呈黑色。采用医学图像分析系统,根据胶原纤维及细胞外基质染色区域占血栓面积百分比计算血栓机化率,同时在40倍光镜视野下行毛细血管计数,分析新生血管情况。
1.2.4.3 ED-1免疫组化分析 血栓标本切片行ED-1免疫组化染色后,在400倍光镜视野下分析参与血栓溶解的细胞类型,病理图像分析系统测算血栓内阳性细胞率。
1.2.4.4 下腔静脉造影分析 造模后解剖大鼠髂静脉,1ml注射器穿刺并缓慢推注造影剂碘普罗胺,行数字减影血管造影(digital subtraction angiography,DSA)并采集图像,观察大鼠下腔静脉血栓的自然再通过程。
1.3 统计学处理 采用SPSS 17.0软件进行统计分析,数据结果以表示,组间比较采用单因素方差分析,进一步两两比较采用SNK-q法,P<0.05为差异有统计学意义。
2 结 果
2.1 动物存活情况及血栓大体观察结果 48只大鼠中46只存活,C组术后1d死亡1只,探查见左侧输尿管及肾脏明显积水,明确为手术误操作结扎输尿管所致,B组术后5d死亡1只,探查见腹腔内大量脓液,确定死亡原因为腹腔感染。A组及D组未见动物死亡。实验组建模后均可见大鼠后肢及臀部肿胀,1d时最明显,随时间推移逐渐减轻,D组大鼠未见后肢及臀部肿胀。术后1d时A组大鼠下腔静脉内充满大量血栓,张力高,呈暗黑色,长度近下腔静脉全长,部分血栓蔓延至双侧髂静脉内,解剖时血栓与静脉壁易分离,血栓完整性好、不易碎裂;B、C组血栓长度不一,均未累计下腔静脉全长,髂静脉内未见血栓,血栓剥离时稳定性较A组差;D组下腔静脉内未见血栓形成。术后3d及7d时实验各组血栓长度均有所减少,但A组血栓长度仍高于其他各组(图1),各组血栓剥离较困难且头端呈淡红色及灰白色,A组血栓质地较韧,而B、C组血栓易碎裂。术后1、3、7d时A组血栓重量均高于B、C两组,差异有统计学意义,而B、C组间比较差异无统计学意义(表1)。
2.2 血栓面积占血管面积的百分比 血栓标本HE染色结果显示,术后1d时A、B、C组血栓面积占下腔静脉管腔面积的百分比分别为95.5%±0.9%、93.6%±1.2%、92.5%±1.1%,3组间比较差异无统计学意义。术后3d及7d时A组血栓面积占下腔静脉管腔面积的百分比分别为85.2%±3.8%、54.6%±4.6%,均明显高于B组(61.6%±4.7%、40.6%±3.1%)及C组(57.8%±3.3%、36.2%±2.9%),差异均有统计学意义(P<0.01),而B、C两组间比较差异均无统计学意义(P>0.05)。D组无血栓形成。2.3 最佳模型组大鼠存活情况及大体观察 根据上述结果,确定A组为最佳模型组。选取30只SD大鼠按照A组方法建模,术后14d死亡1只,探查见肠管明显扩张伴坏死,腹腔内暗红色炎性渗液,确定死亡原因为肠梗阻。大鼠总体存活率为96.7%。大体观察:术后1d至7d结果同前,术后14d至21d大鼠后肢及臀部肿胀明显缓解,28d完全消失。
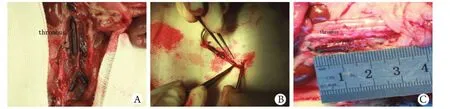
图1 A组下腔静脉血栓大体观察Fig. 1 Gross observation of the inferior vena cava thrombus in group AA. 1day after modeling; B. 3 days after modeling; C. 7 days after modeling
表1 各组下腔静脉血栓长度与重量比较(±s,n=12)Tab. 1 Comparison of the inferior vena cava thrombus length and weight of each group (±s,n=12)
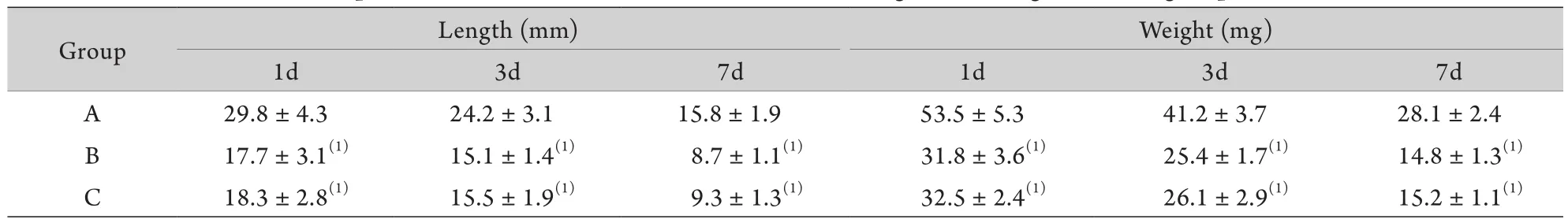
表1 各组下腔静脉血栓长度与重量比较(±s,n=12)Tab. 1 Comparison of the inferior vena cava thrombus length and weight of each group (±s,n=12)
(1)P<0.01 compared with group A
Group Length (mm) Weight (mg) 1d 3d 7d 1d 3d 7d A 17.7±3.1(1) 15.1±1.4(1) 8.7±1.1(1) 31.8±3.6(1) 25.4±1.7(1) 14.8±1.3(1)C 18.3±2.8(1) 15.5±1.9(1) 9.3±1.3(1) 32.5±2.4(1) 26.1±2.9(1) 15.2±1.1(1)29.8±4.3 24.2±3.1 15.8±1.9 53.5±5.3 41.2±3.7 28.1±2.4 B
2.4 最佳模型组静脉血栓HE染色 术后1d血栓充满静脉管腔,形态为层状血栓(图2A),3d时血栓开始收缩,血栓与血管壁间出现裂隙(图2B),7d时血栓体内部、血栓与血管壁之间裂隙扩大,其中可见散在新生管腔样结构形成(图2C),术后14d、21d血栓逐渐溶解,血栓体中央区域可见大量毛细血管,管腔内充满红细胞,血栓机化明显(图2D、E),并于术后28d完全溶解、再通(图2F)。术后1、3、7、14、21、28d时血栓溶解率分别为4.2%±1.1%、13.5%±2.3%、48.6%±5.4%、66.9%±3.1%、82.2%±3.8%、96.3%±2.1%。
2.5 最佳模型组静脉血栓Masson染色结果 光镜观察可见,术后1d及3d时代表胶原纤维、细胞外基质及血管壁的蓝色区域仅限于血栓边缘,胶原纤维含量较低,新生血管少见,随着时间推移,7d至14d后蓝色区域扩大,逐渐累及血栓体大部(图3),21d时血栓机化明显,大量新生血管形成,管腔再通明显,而28d时血栓机化较前减少,血栓近乎完全溶解。术后1、3、7、14、21、28d时下腔静脉血栓机化率分别为1.2%±0.1%、5.4%±1.3%、21.4%±4.9%、31.4%±5.9%、57.5%±12.8%、43.8%±7.8%,毛细血管计数结果分别为1.3±0.2、1.8±0.3、6.4±1.5、19.4±3.3、0.2±0.1、0。
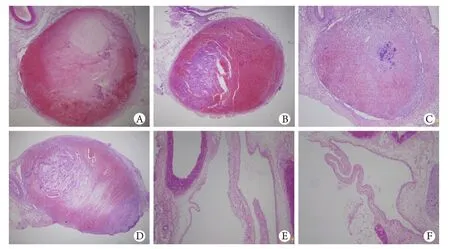
图2 最佳模型组下腔静脉血栓HE染色结果(×40)Fig. 2 HE staining of the inferior vena cava thrombosis in the best model group (×40) A. Day 1; B. Day 3; C. Day 7; D. Day 14; E. Day 21; F. Day 28
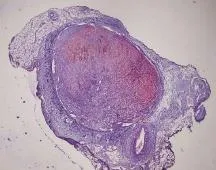
图3 最佳模型组术后7d下腔静脉血栓Masson染色结果(×40)Fig. 3 Masson staining of the inferior vena cava thrombosis in the best model group at day 7 post-operation (×40)
2.6 最佳模型组ED-1免疫组化分析 ED-1免疫组化染色胞质呈棕黄色颗粒者判断为阳性细胞,代表单核巨噬细胞系。建模后3d内阳性细胞多位于血栓体的边缘、血栓体与血管壁间隙区域(图4),7d 至14d血栓体周围阳性细胞明显减少,而血栓体内部阳性细胞较前逐渐增多,21d阳性细胞数达峰值而后快速减少。术后1、3、7、14、21、28d时血栓内阳性细胞率分别为5.7%±0.8%、10.4%±1.2%、23.1%±2.9%、29.5%±2.7%、33.5%±1.7%、 16.3%±0.5%。
2.7 最佳模型组DSA造影结果 术后1d下腔静脉无显影,部分模型对侧髂静脉可显影,说明下腔静脉内全段血栓形成,造影剂经对侧髂静脉反流(图5A);术后3d下腔静脉远端显影,提示血栓远端部分溶解,近端仍闭塞(图5B);术后7d可见下腔静脉显影,管腔呈线样征,造影剂流速加快,未见明显侧支循环,表明血栓部分再通(图5C);术后14d可见侧支循环形成(图5D);术后21d管腔基本再通,但下腔静脉近端造影剂变细,表明下腔静脉近端血栓未完全溶解吸收(图5E);术后28d造影显示下腔静脉完全再通,造影剂回流通畅,周围侧支循环消失(图5F)。
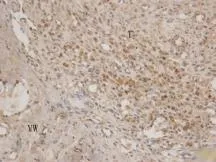
图4 最佳模型组术后3d下腔静脉血栓ED-1免疫组化染色结果(×400)Fig.4 ED-1 immunohistochemistry staining of the inferior vena cava thrombus in the best model group at day 3 postoperation (×400)T. Thrombus; VW. Vein wall
3 讨 论
以往文献报道建立静脉血栓动物模型的方法包括单纯下腔静脉结扎[7]、彩超定位下腔静脉缩窄[8]、凝血酶静脉腔内注射[9]、止血药物输注损伤静脉壁[10]等,这些方法仅通过一或两种途径诱导静脉血栓,存在大鼠死亡率较高,血栓形成不稳定,血栓形态与人体病理状态形成的血栓差异大等缺点,同时这些方法与Virchow提出的静脉血栓形成三大经典因素[5]不相符,未能准确模拟人体内血栓形成的层状结构,相关文献[7-10]也未对动物模型诱导的血栓进行定量分析和动态研究。

图5 最佳模型组下腔静脉DSA造影结果Fig. 5 Imaging of digital subtraction angiography of the inferior vena cava in the best model groupA. No contrast agent in the inferior vena cava at day 1; B. The distal of inferior vena cava developing at day 3; C. The all of inferior vena cava developing at day 7, but the inferior vena cava is stenosis; D. The formation of collateral circulation at day 14; E. The inferior vena cava is fully developed, but the proximal stenosis of the inferior vena cava at day 21; F. The inferior vena cava is fully developed at day 28
本研究依据Virchow理论中的血流淤滞、高凝状态及血管内皮损伤三个血栓形成基本要素设计了实验方案,通过缩窄下腔静脉管径及结扎属支引起血流缓慢,血管夹钳夹静脉壁产生内皮损伤及手术创伤诱导高凝状态来建立动物模型,并对比各独立因素的相互作用。实验结果显示各组建模后1、3、7d下腔静脉血栓诱导成功率均为100%,静脉腔形成的血栓形态为层状血栓,由灰白色血栓头、暗红色血栓体和鲜红色血栓尾3部分组成,不同于其他文献报道中动物模型的单纯血凝块结构[11],这种层状血栓结构更符合人体病理血栓形态结构[12],说明本动物模型建立方式可以很好地模拟人体内血栓形成的自然过程。实验组术后7d内总体生存率为94.4%,表明缩窄下腔静脉管腔后,即使成功诱导血栓也不会发生致死性肺栓塞,对大鼠各生理系统影响极小。各实验组组内比较,A组大鼠下腔静脉血栓无论重量、长度还是血栓面积百分比均高于B、C组,表明联合三种因素诱导的静脉血栓较两种因素诱导的血栓更加稳定、广泛,B、C两组间血栓量结果比较差异无统计学意义,证实血管壁刺激和结扎各属支这两个独立因素对诱导血栓形成作用无明显差异。
我们体会建模过程中需注意以下细节:①合适器械的选择和无菌操作是建模成功的关键,必须具备显微器械等能进行精细操作的器械和无菌操作室;②充分解剖左肾静脉与下腔静脉汇合处,缩窄下腔静脉程度以80%~90%最为合适,既能诱导血流缓慢又不会出现肺栓塞;③结扎双侧腰静脉的同时,必须结扎下腔静脉后壁的各属支(腰静脉和脊静脉),包括左肾以下下腔静脉后壁2~3个属支,结扎后壁属支时应在缩窄下腔静脉之前,否则会使静脉压力增高引起出血;④钳夹静脉壁以诱导内皮损伤次数以4次连续钳夹比较合理,每次1min,间隔30s;⑤注意保护输尿管,以免术后发生肾积水,C组因此出现动物死亡;⑥初次手术裸化左肾静脉以下下腔静脉壁必须充分,以便后续实验取材方便;⑦术后适当给予保暖,可有效降低大鼠死亡率。
静脉血栓溶解机化是个复杂的动态演进过程[13-14]。本研究观察发现大鼠下腔静脉血栓自然溶解过程为3~4周,较人类下肢深静脉血栓溶解机化周期明显缩短[15]。病理图像分析提示术后1d下腔静脉管腔完全阻塞,无明显溶解现象,术后3d血栓长度和重量开始减少,同时血栓中央及血栓与静脉壁内膜之间产生裂隙,说明此时血栓边缘与血液接触的部分被血液内纤溶酶溶解、吸收而收缩,致使血栓内部出现裂隙,但并未见到大量的新生毛细血管,术后7d开始血栓体内可见管腔样结构形成,同时胶原纤维及细胞外基质成分在血栓与血管壁接触部位出现最多,推测血栓机化过程是从病变部位血管壁与血栓相连的部分始发,由血栓周围向血栓中央逐渐发展的,待14d及21d时血栓进一步溶解,机化范围进一步扩散,新生血管内皮细胞进一步增殖,向裂隙迁移覆盖,形成相互吻合再通的新生血管腔,这些血管腔随血流动力学作用而改建形成小静脉,使被阻塞的静脉部分地重建血流,继而发展到28d时血管腔完全融合贯通,最终实现血栓完全再通。对于深静脉血栓机化和再通过程而言,新生毛细血管形成及内皮化过程扮演了重要角色[16]。本课题组前期研究也证实了这一过程[17]。
血栓的机化和再通是由多种细胞因子和细胞参与的动态的、协调的过程[18]。本研究结果显示血栓的细胞组成初期以红细胞为主,随着溶解机化的演进,ED-1阳性的单核巨噬细胞系细胞数开始增多,并与血栓机化进程一致,单核巨噬细胞能通过自分泌和旁分泌基质金属蛋白酶、迁移因子、趋化因子和促血管新生因子如VEGF、bFGF等诱导纤维母细胞的增长及新生内皮细胞的覆盖,最终促使血栓完全机化再通,这与创伤愈合过程中肉芽组织的形成过程非常相似[5]。
综上所述,本研究通过大体观察、病理分析及静脉造影检查等多种方式证实构建的模型能够准确模拟人体内深静脉的层状血栓结构,建模成功率高,死亡率低,可重复性强,血栓形成稳定,可作为建立深静脉血栓动物模型的首选方法。在此基础上我们通过动态观察大鼠下腔静脉产生血栓到血栓自然完全溶解的全过程,发现其自然溶解演变过程伴随血管新生机制,而巨噬细胞在此过程中具有重要作用,为后续深入研究静脉血栓形成的病理生理过程中各因子的相互作用及信号传导通路奠定了实验基础。
[1]Raskob GE, Silverstein R, Bratzler DW,et al. Surveillance for deep vein thrombosis and pulmonary embolism: Recommendations from a national workshop[J]. Am J Prev Med, 2010, 38(4 Suppl): 502-509.
[2]Huang W, Anderson FA, Spencer FA,et al. Risk-assessment models for predicting venous thromboembolism among hospitalized non-surgical patients: a systematic review[J]. J Thromb Thrombolysis, 2013, 35(1): 67-80.
[3]Zhu YY, Di ZG. Management strategy on anticoagulant therapy of venous thrombembolism[J]. Chin J Pract Intern Med, 2013, 33(5): 355-358. [朱妍妍, 翟振国. 静脉血栓栓塞症抗凝治疗管理策略[J]. 中国实用内科杂志, 2013, 33(5): 355-358.]
[4]Li SQ. The new progress of the antithrombotic treatment of the pulmonary thromboembo[J]. Chin J Pract Intern Med, 2013, 33(5): 348-351. [李圣青. 肺血栓栓塞症抗血栓治疗新进展[J]. 中国实用内科杂志, 2013, 33(5): 348-351.]
[5]Diaz JA, Myers Jr DD. Inflammation, thrombogenesis, fibrinolysis, and vein wall remodeling after deep venous thrombosis[M]//Edmo AG, Sthefano AG. Inflammatory response in cardiovascular surgery. London: Springer, 2013. 175-183.
[6]Brill A, Fuchs TA, Chauhan AK,et al. Von willebrand factormediated platelet adhesion is critical for deep vein thrombosis in mouse models[J]. Blood, 2011, 117(4): 1400-1407.
[7]Reyers I, Mussoni L, Donati MB,et al. Failure of aspirin at different doses to modify experimental thrombosis in rats [J]. Thromb Res, 1980, 18(5): 669-674.
[8]Lu G, DeGuzman FR, Hollenbach SJ,et al. A specific antidote for reversal of anticoagulation by direct and indirect inhibitors of coagulation factor Xa[J]. Nat Med, 2013, 19(4): 446-451.
[9]Ji YQ, Zhang ZH, Lu WX,et al. Establishment of rat model of venous thromboembolism[J]. Nat Med J Chin, 89(4): 271-275.[季颖群, 张中和, 陆慰萱, 等. 建立静脉血栓栓塞症大鼠模型的研究[J]. 中华医学杂志, 2009, 89(4): 271-275.]
[10] Gao F, Hu JG, Guan WW. Establishment of SD rat model with deep venous thrombosis and the morphological changes of the veins[J]. Acta Academ Med Jiangxi, 2008, 48(2): 21-25.[高峰,胡建国, 关薇薇. SD大鼠深静脉血栓模型的建立及其静脉壁形态学研究[J]. 江西医学院学报, 2008, 48(2): 21-25.]
[11] Alvarado CM, Diaz JA, Hawley AE,et al. Male mice have increased thrombotic potential: sex differences in a mouse model of venous thrombosis[J]. Thromb Res, 2011, 127(5): 478-486.
[12] Diaz JA, Obi AT, Myers DD,et al. Critical review of mouse models of venous thrombosis[J]. Arterioscler Thromb Vasc Biol, 2012, 32(3): 556-562.
[13] Liu YC, Yang Z, Yuan XR,et al. Comparison of different thrombolysison in acute deep venous thrombosis[J]. J Shandong Univ (Health Sci), 2011, 49(11): 61-63. [刘彦春, 杨植, 袁秀荣, 等. 急性中央型下肢深静脉血栓形成不同溶栓方法的比较[J]. 山东大学学报(医学版), 2011, 49(11): 61-63.]
[14] Fu J, Luo WJ, Sun JM,et al. Expression and significance of platelet-derived growth factor CC during intravenous thrombolysis[J]. Med J Chin PLA, 2013, 38(2): 120-124. [付健,罗文军, 孙建明, 等. 血小板衍生生长因子CC在大鼠静脉血栓溶解过程中的表达及其意义[J]. 解放军医学杂志, 2013, 38(2): 120-124.]
[15] van Rij AM, Hill G, Krysa J,et al. Prospective study of natural history of deep vein thrombosis: early predictors of poor late outcomes[J]. Ann Vasc Surg, 2013, 27(7): 924-931.
[16] Cooley BC.In vivofluorescence imaging of large-vessel thrombosis in mice[J]. Arterioscler Thromb Vasc Biol, 2011, 31(6): 1351-1356.
[17] Chen YK, Jiang XM, Gong JP. Recombinant human granulocyte colony-stimulating factor enhanced the resolution of venous thrombi[J]. J Vasc Surg, 2008, 47(5): 1058-1065.
[18] Wojcik BM, Wrobleski SK, Hawley AE,et al. Interleukin-6: A potential target for post-thrombotic syndrome[J]. Ann Vasc Surg, 2011, 25(2): 229-239.
Reproduction of a new inferior vena cava thrombosis model and study of the evolutionary process of thrombolysis in rats
FU Jian, TANG Bo*, CHEN Yi-kuan, SUN Jian-ming, LUO Wen-jun
Department of Vascular Surgery, Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
*< class="emphasis_italic">Corresponding author, E-mail: nokiatb@126.com
, E-mail: nokiatb@126.com
This work was supported by the National Natural Science Foundation of China (81270398) and the Medical Science Development Foundation of Chongqing Health Bureau (2012-2-053)
ObjectiveTo investigate the reproduction of a new model of thrombosis of inferior vena cava (IVC), and explore the natural process of thrombolysis and its mechanism in rats.MethodsForty-eight SD rats were randomly classified into experimental group and control group. In the experimental group, the lumen of the vena cava was blocked by about 80%-90% with a ligature of IVC below the left renal vein, and then the animals were redivided into three subgroups (n=12, each). In group A, the IVC endothelium was damaged and its tributaries were ligated. In group B, the IVC endothelium was damaged and its tributaries were not ligated. In group C, no damage was done to the endothelium of the IVC but all its tributaries were ligated. A sham-operated group served as control. The length and weight of the vinous thrombus and the percentage of the IVC luminal area were compared after operation to determine the optimum animal model of venous thrombosis. According to the best mode to establish the model, the thrombus specimens were collected and detected by HE and Masson staining, and the ED-1 expressions were examined by immunohistochemical staining after thrombus formation in 30 rats. The natural evolution of intravenous thrombolysis was analyzed dynamically and the cell types involved in this process were observed.ResultsGross observation showed that the experimental group was successfully induced thrombus formation. The thrombus length and weight in group A was significantly higher than thatin group B and group C, and no difference between group B and C. The thrombus area in group A was significantly higher than that in groups B and group C, which identified the group A was the optimal model group of venous thrombosis. In the group reproduced by the best mode of the model, HE and Masson staining results showed that new capillaries and the components of collagen and extracellular matrix increased gradually with the passage of time in the process of thrombus resolution. ED-1 staining indicated a massive infiltration with macrophages during the thrombus resolution. The results of inferior vena cavography showed that natural resolution of the IVC thrombus and complete revascularization needed 3 or 4 weeks.ConclusionsThe morphological changes in venous thrombus induced by narrow lumen combined with ligation and vessel injury of the IVC in rats are similar to those in human being, which could be a preferred method to establish animal model of deep venous thrombosis. The evolution of natural thrombus resolution comprises angiogenesis and the macrophages play an important role in this process.
venous thrombosis; disease models, animal; pathologic process
R364.15
A
0577-7402(2015)08-0610-06
10.11855/j.issn.0577-7402.2015.08.02
2014-11-15;
2015-06-27)
(责任编辑:胡全兵)
国家自然科学基金(81270398);重庆市卫生局医学科研项目(2012-2-053)
付健,医学硕士。主要从事周围血管疾病的基础与临床研究
400010 重庆 重庆医科大学附属第二医院血管外科(付健、唐博、陈以宽、孙建明、罗文军)
唐博,E-mail:nokiatb@126.com
