基于fALFF及ReHo法观察低氧暴露后飞行员静息态脑功能的变化
2015-06-28刘洁张挽时钱龙徐先荣刘明熙孟利民王萍
刘洁,张挽时,钱龙,徐先荣,刘明熙,孟利民,王萍
基于fALFF及ReHo法观察低氧暴露后飞行员静息态脑功能的变化
刘洁,张挽时,钱龙,徐先荣,刘明熙,孟利民,王萍
目的 探讨静息态功能核磁共振成像(rs-fMRI)分数低频振幅(fALFF)和局域一致性(ReHo)方法在低氧暴露后飞行员静息态脑功能评价中的应用价值。方法 30名男性健康飞行员先后接受常压常氧、氧浓度为14.5%的常压低氧暴露,采用fALFF及ReHo方法对受试者低氧暴露前后rs-fMRI数据进行对比分析,观察低氧暴露之后fALFF及ReHo值发生变化的脑区。结果 低氧暴露后,30名飞行员脉搏、血氧饱和度分别为64.0±10.6次/min、92.4%±3.9%,较暴露前(分别为71.4±10.9次/min、96.3%±1.3%)有所下降(P<0.05)。静息态下,30名飞行员低氧暴露后fALFF值降低的脑区包括双侧颞上回、右侧额上回,fALFF值增高的脑区为左侧楔前叶,ReHo值降低的脑区为右侧额上回(P<0.05),未发现ReHo值增加的脑区。结论 低氧暴露对静息态下某些脑区功能活动有明显影响,可能与认知功能变化有关。
缺氧;静息态脑功能;磁共振成像;分数低频振幅;局域一致性
飞行员作为一种特殊职业,在日常工作中常常需要面临和克服各种极端的外界环境,如缺氧、低气压、加速度、温度、噪声、振动、环境照明度改变等[1]。其中,影响较普遍、较明显的是缺氧。氧气是人类新陈代谢及生命活动不可或缺的物质,但在实际工作中,飞行员常常是在“不知不觉”中发生缺氧,极易危及飞行安全,导致飞行事故[2]。以往多采用工效学(神经心理量表)、脑电图测定及脑事件相关电位(ERP)[3-5]等方法评定飞行员急性缺氧时的脑认知能力。本研究应用静息态血氧水平依赖性功能磁共振成像技术(BOLD-fMRI),采用分数低频振幅(fractional amplitude of low frequency fluctuation,fALFF)和局部一致性(regionalhomogeneity,ReHo)两种分析方法来观察低氧暴露对飞行员基础脑活动的影响。
1 资料与方法
1.1 研究对象 2014年3月-2014年8月在空军总医院空勤科进行改装体检的男性飞行员30名,年龄30.6±4.8(24~40)岁,累计飞行时间1328.1±940.1(310~3800)h,均为右利手。除外精神疾患和脑外伤、脑手术等病史,经临床和MRI检查确定为健康者。所有被试者均同意配合完成此项研究,并签署知情同意书。
1.2 研究方法
1.2.1 仪器 使用美国GE公司Discovery MR750 3.0T磁共振成像系统,标准的8通道头线圈。脉搏血氧仪为CMS-50型(秦皇岛市康泰医学系统有限公司)。
1.2.2 低氧条件 采用北京兆格氧气厂以氮气及氧气混合配制而成氧浓度为14.5%的低氧混合气体,低氧装置包括高压气瓶、减压阀门、医用氧气枕及呼吸面罩,每个被试者通过呼吸面罩吸入相当于3000m海拔高度的低氧混合气体,实验前后用脉搏血氧仪监测脉搏及血氧饱和度。
1.2.3 MRI数据采集 采用GE MR750 3.0T磁共振扫描仪,8通道头颅相控阵列表面线圈进行数据采集。在扫描之前用脉搏血氧仪测量并记录被试者的脉搏及血氧饱和度。被试者头先进,仰卧位,头部轴位扫描以听眦线为扫描基线,进行以下序列扫描。
常规扫描:①矢状位T1加权像液体反转恢复序列(T1weighted imaging-fluid attenuation inversion recovery,Sag-T1WI-FLAIR):TR/ TE=2041.7ms/24.0ms,层厚5mm,层间距1.5mm,层数19,视野FOV 24cm×24cm,带宽BW 50kHz,激励次数NEX=1,扫描时间56s;②轴位T2加权像螺旋桨技术(T2weighted imaging-periodically rotated overlapping parallel lines with enhanced reconstruction,OAX-T2WIPropeller):TR/TE=6000ms/101ms,层厚5mm,层间距1.5mm,层数20,视野FOV 24cm×24cm,带宽BW 83.33kHz,激励次数NEX=1.5,扫描时间1min24s;③轴位T2加权像液体反转恢复序列(T2weighted imaging - fluid attenuation inversion recovery,OAX-T2WIFLAIR):TR/TE=8600ms/155ms,层厚5mm,层间距1.5mm,层数20,视野FOV 24cm×24cm,带宽BW 62.50kHz,激励次数NEX=1,扫描时间1min44s。
低氧暴露前静息态fMRI扫描:嘱被试者佩戴眼罩及连接氧气袋的面罩,清醒闭目平静呼吸,安静平卧于检查床,使用泡沫头垫固定头部并最大限度减少头部与身体主动及被动运动,用橡皮耳塞降低噪音。采用梯度回波-平面回波序列,参数TR/ TE=2000ms/35ms,反转角(FA)90°,层厚4.0mm,层数38,FOV 24cm×24cm,矩阵64×64,扫描时间6min50s。
T1WI容积扫描:打开氧气袋阀门,使被试均匀吸入氧浓度14.5%混合气体直至本次实验操作完成为止。采用三维快速扰相梯度回波序列容积成像技术(three dimension- fast spoiled gradient echo-brain volume imaging,3D-FSPGR BRAVO),采集全脑结构像(包含头皮),参数TR/TE=8.2ms/3.2ms,反转角(FA)12°,带宽31.25kHz,层厚1.2mm,共100层,FOV 24cm×24cm,矩阵256×256,扫描时间2min59s。
低氧暴露后静息态fMRI扫描:序列及参数与低氧暴露前静息态fMRI扫描一致。
1.3 磁共振静息态脑功能数据分析 采用DPARSF (http://www.restfmri.net)和SPM8(http://www. fil.ion.ucl. ac.uk)软件包进行磁共振静息态脑功能数据分析。
1.3.1 预处理 静息fMRI数据预处理包括时间校正、头动校正、空间标准化,其中fALFF分析进行空间平滑,而ReHo分析不进行空间平滑。为去除机器的自旋饱和效应和受试者适应环境对数据的影响,将吸氧前和吸氧后的各静息态扫描前10个时间点的图像数据剔除。依据头动校正曲线,将头动平移>2mm和(或)转动>2%的数据剔除(本组30例均符合要求)。将数据空间标准化至MNI(montreal neurological institute)标准空间,重新采样为3mm×3mm×3mm的体素,空间平滑采用6mm×6mm×6mm半高等宽的高斯核进行。
1.3.2 fALFF分析 fALFF分析采用平滑后未滤波数据,对0.01~0.08Hz信号的功率谱行开方计算,得到低频振荡幅度值,相加得总和值,再除以全频段振幅总和值,得fALFF值[6]。
1.3.3 ReHo分析 首先计算出全脑每个体素与其周围相邻的26个体素在时间序列上的相似性,得到该体素的肯德尔和谐系数(Kendall's coefficient of concordance,KCC)。然后以每个体素的KCC值除以全脑所有体素KCC的均值,得到标准化的ReHo值[7]。最后,以一个半高全宽(full-width at half maximum,FWHM)为6mm的各向同性的高斯核对ReHo图进行平滑处理。
1.4 统计学处理 采用XjView(http://www. alivelearn.net/xjview)软件确定对应MNI坐标上有统计意义脑区的具体解剖位置。低氧暴露前后fALFF 及ReHo值比较采用配对t检验,P<0.05(FDR校正)为差异有统计学意义。
2 结 果
2.1 低氧暴露后脉搏及血氧饱和度的变化 30名受试者吸入氧浓度为14.5%氮氧混合气体,由于磁共振设备条件限制,仅能获取低氧暴露前后脉搏及血氧饱和度的变化。经测定,低氧暴露后飞行员脉搏为64.0±10.6次/min,较吸氧前(71.4±10.9 次/min)有所下降,低氧暴露后飞行员血氧饱和度为92.4%±3.9%,较吸氧前(96.3%±1.3%)亦有所下降,差异均有统计学意义(P<0.05)。
2.2 低氧暴露对静息态脑功能的影响 fALFF分析结果显示,低氧暴露后fALFF值降低的脑区包括双侧颞上回、右侧额上回,fALFF值增高的脑区包括左侧楔前叶(表1,图1)。ReHo分析结果显示,低氧暴露后ReHo值降低的脑区仅右侧额上回(P<0.05,FDR校正),未发现ReHo值增加的脑区(图2)。

表1 低氧暴露后fALFF变化的脑区(n=30)Tab. 1 Brain areas of significantly changed fALFF after hypoxia exposure (n=30)

图1 低氧暴露后脑区fALFF变化图Fig. 1 The maps of fALFF changes after hypoxia exposure
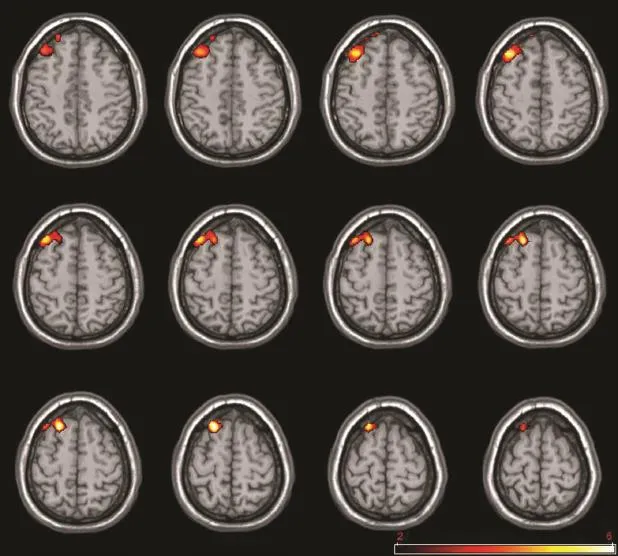
图2 低氧暴露后脑区ReHo变化图Fig. 2 The maps of ReHo changes after hypoxia exposure
3 讨 论
3.1 BOLD-fMRI的概念 血氧水平依赖性功能核磁扫描(BOLD-fMRI)的原理是基于血红蛋白的磁化特性[8],氧合血红蛋白是逆磁性物质而脱氧血红蛋白具有顺磁性,血氧饱和度水平会影响周围水分子的横向弛豫时间,这一变化可通过磁共振T2加权像信号呈现,其中脱氧血红蛋白含量和T2信号负相关,T2信号降低往往伴随着脱氧血红蛋白含量增加[9]。
3.2 静息态BOLD-fMRI分析方法 静息态fMRI 研究获取数据的状态单一,与基于任务态研究中的脑激活图不同,需要特定的数据分析方法。目前,临床应用较多、相对简单的两类静息态BOLD-fMRI数据分析方法包括局部功能活动特性分析方法和线性相关分析方法[10]。前者包括低频振幅(ALFF)、fALFF和ReHo[11],即局部脑区内部慢波振荡的特性分析,用于描述静息态脑局部功能活动特性;后者包括种子相关分析、等级聚类分析及独立成分分析等,即不同脑区之间慢波振荡的同步性分析,用于静息态脑功能连接的数据分析;不同的数据处理方法其侧重性及敏感性有所不同。本研究采用fALFF 和ReHo两种分析方法观察低氧暴露前后飞行员局部脑功能活动变化。
fALFF是一种改良的ALFF方法[6],由于脑脊液静脉血窦和大静脉在0.01~0.08Hz也可表现出较高的低频振荡信号强度,与真正的神经元活动无法区分,而在整个频谱上脑脊液静脉血窦和动静脉在0.01~0.08Hz频段的信号强度只占很小的比例,fALFF通过采用0.01~0.08Hz之间的信号振荡平均强度和整个频段振荡信号的比值,可去除生理噪音的影响,提高检测脑自发活动的敏感度和特异性。ReHo技术通过计算邻近几个体素之间的KCC来衡量某一功能脑区的体素与周围体素时间序列变化的一致性和相似程度,反映局部脑组织的同步性活动,从而间接反映脑功能活动[7]。ReHo体现的是全脑中每个体素与其邻近体素时间序列的同步性,从本质上反映的是体素间时间序列相似性的大小而非活动强度的高低。
3.3 低氧暴露后飞行员静息态fALFF及ReHo值的变化 本研究结果显示,低氧暴露后,飞行员脉搏及血氧饱和度均有所下降,且血氧饱和度维持在92%上下,达到轻度缺氧状态阈值水平[1];应用fALFF方法分析脑自发活动的程度,结果显示低氧暴露后双侧颞上回、右侧额上回脑功能活动较前减弱,左侧楔前叶功能活动较前增强,而应用ReHo方法分析时间序列的一致性,结果显示低氧暴露后右侧额上回局部一致性降低,间接说明该脑区功能活动减弱。
额上回属背内侧前额叶的一部分,在复杂认知控制方面扮演了重要角色,如视觉工作记忆、选择注意、决策、自我表达以及对行为进行监督和及时纠正错误[12-14];颞叶除易受年龄影响之外[15],对缺氧也十分敏感[16]。既往认为颞上回是听觉皮层,随着对脑功能研究的不断深入,发现该脑区还与社会信息的加工、人类和其他哺乳动物的高级认知功能密切相关[17],颞上回功能受损可出现精神、记忆(包括空间和时间记忆)障碍,动物实验结果证明颞上回参与了大鼠记忆和注意信息加工[18]。低氧暴露后这两个脑区功能减弱说明缺氧在一定程度上抑制了飞行员的认知功能。楔前叶位于顶叶内侧,位置较为隐蔽,因而较易被忽视,近年来的脑功能研究发现该脑区广泛参与了人脑的高级认知功能,如视觉空间成像、情景记忆和自我相关信息加工,并且楔前叶和它周围的顶叶后内侧区代谢极为旺盛[19],易受外界环境因素的影响,部分研究结果提示楔前叶可作为急性脑梗死[20]、一氧化碳(CO)中毒[12]患者大脑整体基线功能的监测指标。本研究发现左侧楔前叶在低氧暴露后fALFF值升高,可能是低氧暴露后脑功能调节的代偿性改变。
与以往评价飞行员脑功能活动的方法相比,BOLD-fMRI作为一种新的实验方法具有明显的优越性,如简单、无创、可重复性高,时空分辨率高,一次成像可同时获得解剖图像和功能图像,不仅可以实时观察静息态脑功能活动变化,而且可以准确定位神经元活动变化的脑区,更直观、清晰地显示缺氧时飞行员静息态脑功能活动及功能连接的改变,对以往的神经心理学量表认知评分测试提供了客观依据和补充。
由于实验设备限制,我们无法实时监测整个扫描过程中飞行员的脉搏及血氧饱和度(但从暴露前后的实验数据来看,被试已达到轻度缺氧状态,符合实验条件)。本实验为探索应用更低的氧浓度,模拟更高飞行高度(如6000m高空)研究飞行员静息态脑功能的影响奠定了基础。
本实验结果表明,低氧暴露后部分脑区fALFF、ReHo值较前发生变化,提示低氧暴露影响了飞行员静息态脑功能,为低氧暴露后飞行员认知功能的变化提供了神经影像学方面的证据。BOLD-fMRI技术用于缺氧对飞行员静息态脑功能影响的研究具有广阔的应用前景,可为飞行员脑功能鉴定提供一种新的方法。
[1]Yu ZB. Aerospace physiology[M]. Xi'an: Fourth Military Medical University Publishing House, 2008. 3-6, 79.[余志斌. 航空航天生理学[M]. 西安: 第四军医大学出版社, 2008. 3-6, 79.]
[2]Temme L, Bleiberg J, Reeves D, et al. Uncovering latent deficits due to mild traumatic brain injury by using normobaric hypoxia stress[J]. Front Neurol, 2013, 4: 41.
[3]Han GL. Research about the effects of hypoxia on the cognitive function of human on the plateau[J]. Med J High Alt, 2009, 19(4): 62-64.[韩国玲. 高原低氧对人体认知功能影响的研究[J]. 高原医学杂志, 2009, 19(4): 62-64.]
[4]Chen YS, Xiong DQ, Guo XC, et al. The brain function research progress of pilot in China[J].Chin J Aviat Med, 2005, 16(4): 309-311.[陈勇胜, 熊端琴, 郭小朝, 等. 国内飞行员脑功能研究进展[J]. 中华航空航天医学杂志, 2005, 16(4): 309-311.]
[5]Xie XM, Wen YL. The effect of long-term exposure to low oxygen environment on cognitive function [J]. Med J Chin Public Health, 2008, 24(7): 814-815.[谢新民, 文亚兰. 长期低氧环境暴露对认知功能影响[J]. 中国公共卫生, 2008, 24(7): 814-815.]
[6]Zou QH, Zhu CZ, Yang Y, et al. An improved approach to detection of amplitude of low frequency fluctuation (ALFF) for resting-state fMRI: Fractional ALFF[J]. J Neurosci Methods, 2008, 172(1): 137-141.
[7]Zang Y, Jiang T, Lu Y, et al. Regional homogeneity approach to fMRI data analysis[J]. Neuroimage, 2004, 22(1): 394-400.
[8]Wang YB, Chen XL, Wang F, et al. Intra-operative visualization of primary motor cortex and pyramid tract: implementation and clinical experience[J]. Med J Chin PLA, 2011, 36(7): 694-696. [王宇博, 陈晓雷, 王飞, 等. 初级皮质运动区和锥体束的可视化研究及应用[J]. 解放军医学杂志, 2011, 36(7): 694-696.]
[9]Sørensen A, Pedersen M, Tietze A, et al. BOLD MRI in sheep fetuses, a non-invasive method for measuring changes in tissue oxygenation[J]. Ultrasound Obstet Gynecol, 2009, 34(6): 687-692.
[10]Wang H, Lu J, Li KC, et al. The application of resting-state fMRI data processing[J]. Chin J Med Imaging Tech, 2013, 29(4): 651-654. [王辉, 卢洁, 李坤成, 等. 静息态功能磁共振数据处理方法的应用[J]. 中国医学影像技术, 2013, 29(4): 651-654.]
[11]Zhao BF, Ji DX, Yin JZ, et al. A Plot Study of Resting StatefMRI:Preoperative Localization of Epileptogenic Zone in Epilepsy with Malformations of Cortical Development[J]. Tianjin Med J, 2014, 42(11): 1097-1100, 1155. [赵博峰, 纪东旭, 尹建忠, 等. 皮质发育畸形术前定位致灶的静息态功能MRI初步研究[J]. 天津医药, 2014, 42(11): 1097-1100, 1155.]
[12]Liu DH, Liu DB, Zhang JY, et al. A resting-state functionalmagnetic resonance imaging study of acute carbon monoxide poisoning in humans[J]. Cell Biochem Biophys, 2013, 67(3): 1029-1032.
[13]Peres M, Van De Moortele PF, Pierard C, et al. Functional magnetic resonance imaging of mental strategy in a simulated aviation performance task[J]. Aviat Space Environ Med, 2000, 71(12): 1218-1231.
[14]Michael DF, Abraham ZS, Justin LV, et al. The human brain is intrinsically organized into dynamic, anticorrelated functional networks[J]. Neuroscience, 2005, 102(27): 9673-9678.
[15]Winecoff A, Labar KS, Madden DJ, et al. Cognitive and neural contributors to emotion regulation in aging[J]. Soc Cogn Affect Neurosci, 2011, 6(2): 165-176.
[16]Ruitenberg A, den Heijer T, Bakker SL, et al. Cerebral hypoperfusion and clinical onset of dementia: the Rotterdam Study[J]. Ann Neurol, 2005, 57(6): 789-794.
[17]Zhao X, Xi Q, Wang P, et al. Altered activity and functional connectivity of superior temporal gyri in anxiety disorders: a functional magnetic resonance imaging study[J]. Korean J Radiol, 2014, 15(4): 523-529.
[18]Quirk GJ, Armony JL, LeDoux JE. Fear conditioning enhances different temporal components of tone-evoked spike trains in auditory cotex and lateral amygdala[J]. Neuron, 1997, 19(3): 613-624.
[19]Andrea EC, Micheal RT. The Precuneus:a review of its functional anatomy and behavioural correlates[J]. Brain, 2006, 129(3): 564-583.
[20]Wang H, Lu J, Li KC, et al. Applicating resting-state fMRI fractional amplitude of low frequency fluctuation technique to observe the change of the baseline brain function in patients with cerebral infarction[J]. Chin J Med Imaging Tech, 2010, 26(11): 2041-2044. [王辉, 卢洁, 李坤成, 等.应用静息态功能磁共振成像分数低频振幅技术观察脑梗死患者大脑基线功能的变化[J]. 中国医学影像技术, 2010, 26(11): 2041-2044.]
Changes in resting-state brain function of pilots after hypoxic exposure based on methods for fALFF and ReHo analysis
LIU Jie1, ZHANG Wan-shi1*, QIAN Long2, XU Xian-rong3, LIU Ming-xi1, MENG Li-min1, WANG Ping11Department of Radiology,3Department of Flight Division, Air Force General Hospital, Beijing 100142, China
2Department of Biomedical Engineering, Peking University, Beijing 100871, China
*
, E-mail: cjr.zhangwanshi@vip.163.com
ObjectiveThe objective of this study was to evaluate the basic changes in brain activity of pilots after hypoxic exposure with the use of resting-state functional magnetic resonance imaging (rs-fMRI) and regional homogeneity (ReHo) method.MethodsThirty healthy male pilots were successively subjected to normal and hypoxic exposure (with an oxygen concentration of 14.5%). Both the fALFF and ReHo methods were adopted to analyze the resting-state functional MRI data before and after hypoxic exposure of the subjects, the areas of the brain with fALFF and ReHo changes after hypoxic exposure were observed.ResultsAfter hypoxic exposure, the pulse was 64.0±10.6 beats/min, and the oxygen saturation was 92.4%±3.9% in these 30 pilots, and it was lower than those before exposure (71.4±10.9 beats/min, 96.3%±1.3%, P<0.05). Compared with the condition before hypoxic exposure, the fALFF value was decreased in superior temporal gyri on both sides and the right superior frontal gyrus, and increase in the left precuneus, while the value of ReHo was decreased in the right superior frontal gyrus (P<0.05). No brain area with an increase in ReHo value was found.ConclusionsHypoxic exposure could significantly affect the brain functions of pilots, which may contribute to change in their cognitive ability.
anoxia; resting-state brain function; magnetic resonance imaging; fractional amplitude of low frequency fluctuation; regional homogeneity
R445.2
A
0577-7402(2015)06-0507-06
10.11855/j.issn.0577-7402.2015.06.18
2015-02-11;修顺日期:2015-04-27)
(责任编辑:李恩江)
刘洁,硕士研究生。主要从事磁共振静息态脑功能与脑血流灌注的应用研究
100142 北京 空军总医院磁共振科(刘洁、张挽时、刘明熙、孟利民、王萍),空勤科(徐先荣);100871 北京北京大学生物医学工程系(钱龙)
张挽时,E-mail:cjr.zhangwanshi@vip.163.com
