DKK1蛋白表达与食管鳞癌临床病理特征及预后的关系
2015-06-28吴红波柳家荣吴慧娟赵秀丽陈丽娟穆晓倩胡秀峰邹宏志赵艳秋
吴红波,柳家荣,吴慧娟,赵秀丽,陈丽娟,穆晓倩,胡秀峰,邹宏志,赵艳秋
DKK1蛋白表达与食管鳞癌临床病理特征及预后的关系
吴红波,柳家荣,吴慧娟,赵秀丽,陈丽娟,穆晓倩,胡秀峰,邹宏志,赵艳秋
目的 探讨DKK1在食管鳞癌组织中的表达及其与食管鳞癌临床病理特征和预后的关系。方法 收集2007 年3月-2009年6月郑州大学附属肿瘤医院150例食管鳞癌组织(实验组)及52例切缘正常食管组织(对照组)标本,采用免疫组织化学法检测组织标本DKK1蛋白的表达情况。分析DKK1表达与食管鳞癌患者各临床病理参数及预后的关系。结果 150例食管鳞癌组织中的DKK1阳性表达105例,阳性表达率为70%,52例正常食管组织中DKK1的表达均为阴性。DKK1表达与肿瘤的浸润深度和淋巴结转移相关,与其他临床病理参数无关;DKK1表达阳性组与阴性组3年生存率(分别为37.1%和53.3%)、5年生存率(分别为14.3%和46.7%)差异均有统计学意义(P=0.008、P<0.001)。单因素分析结果显示,DKK1表达、淋巴结转移(pN)及肿瘤浸润深度(pT)与食管鳞癌患者5年生存率有关;多因素分析结果显示,DKK1表达、pN、组织分化程度及pT是影响食管鳞癌患者根治术后预后的独立预测因素(P<0.05)。结论 DKK1在食管鳞癌组织中高表达与食管鳞癌组织的浸润、转移能力有关。DKK1可以作为预测食管鳞癌患者不良预后的分子标记物。
基因,DKK1;食管肿瘤;免疫组织化学;预后
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是我国食管癌的常见组织类型,约占食管癌总发病率的90%。目前,食管癌患者的5年生存率仅为15%~30%,中位生存期约18个月,我国食管癌的发病率仍保持在100/10万以上的较高水平。目前公认的影响食管癌预后的主要因素有病理类型、TNM分期、治疗模式的选择和患者一般状况等方面[1],但由于地域、个体差异及肿瘤的异质性,仅通过上述因素去判断、评估ESCC患者的预后,选择治疗方案是远远不够的。因此,近年来检测ESCC患者分子标记物的表达情况,探寻其与ESCC发生、发展及预后的关系[2-5],成为提高ESCC总体诊治水平的重要课题。
Dickkopf-1(DKK1)基因是一种编码抑制Wnt/ β-catenin信号传导途径的分泌性糖蛋白;DKK1在乳腺癌、前列腺癌及肝癌中的高表达与预后密切相关[6-8];研究表明DKK1蛋白在食管癌组织中呈高表达,并且在4个食管癌细胞系中均有表达,在EC9706细胞中过表达DKK1后能够促进细胞由G0/G1期向S期转变,同时能够增强细胞的侵袭能力[9-10],但目前相关的临床研究报道较少。本研究通过检测中国河南地区食管鳞癌根治性手术术后病理标本DKK1的表达,初步探讨DKK1在ESCC的发生、发展、侵袭和转移中的作用以及DKK1与ESCC患者的预后关系,以期为ESCC的预后判断及个体化治疗提供理论依据。
1 材料与方法
1.1 标本选择 收集河南省肿瘤医院2007年3月-2009年6月收治的食管癌患者基本资料。按入选标准从中筛选根治术后病理证实为ESCC的150例患者的食管鳞癌组织作为实验组,以HE染色病理证实为手术切缘正常食管上皮组织的52例患者作为对照组。入选标准:①食管癌根治术后病理诊断为ESCC的患者;②术后病理分期为0-Ⅲ期;③手术为经左或经右侧开胸,包括经左颈、主动脉弓上或主动脉弓下吻合,常规胸、腹二野清扫淋巴结;④无其他部位原发肿瘤。排除标准:①临床、病理及随访资料不完整;②手术前已行放化疗的患者;③围术期死亡病例;④随访期间已死亡患者且死亡原因不明确病例。
150例患者中,男93例,女57例;年龄41~76岁,中位年龄60岁,其中≤60岁76例,>60岁74例。所有患者根据AJCC 2002版术后病理分期标准pTNM进行分期,其中0-Ⅱ期83例(TisN0M、T1N0M0、T2-3N0M0、T1-2N1M0),Ⅲ期(T3N1M0、T4任何NM0)患者67例;术后病理分期肿瘤浸润深度pT1-2者63例,pT3-4期者87例;术后病理分期中无淋巴结转移者N072例,有淋巴结转移者N178例;组织高分化者48例,中低分化者102例;术后接受过辅助放化疗者48例,未接受辅助放化疗者102例。
1.2 免疫组织化学检测食管癌DKK1的表达 食管癌石蜡切片抗原热修复后,采用免疫组织化学SP法按照说明书进行操作,用PBS代替一抗作阴性对照,已知阳性片作为阳性对照。DKK1一抗(H-120,美国Santa Cruz公司),兔抗人多克隆抗体(SC-25516)、通用型SP免疫组化试剂盒和DAB显色试剂盒为北京中杉金桥生物技术公司产品。染色结果根据阳性细胞染色强度及阳性细胞百分数进行分级[11]。由2名病理科医生采用双盲原则评定。染色DKK1在胞膜或胞质中表达,每张切片检测10个高倍视野,按视野中显色细胞的比例判定,显色细胞数>10%即为阳性,反之为阴性。
1.3 患者临床资料收集及随访 设计食管癌患者随访表。一般资料包括患者住院号、姓名、性别、年龄、联系电话等;随访方式包括电话随访、书信随访及上门随访3种形式,记录病情提供者身份,以考察随访信息是否可靠;出院后治疗情况;是否复发,复发后治疗情况;患者目前的生存情况。如患者已死亡,记录死亡时间及原因;终止随访,如存活则评价患者目前状态。入选病例随访至患者死亡或手术后5年。患者术后生存时间定义为自手术当日至术后满5年,如术后5年内死亡,则按自手术当日至死亡日期截止。
1.4 统计学处理 采用SPSS 17.0统计软件包进行数据分析。DKK1表达与各临床病理参数之间的关系采用χ2检验,DKK1表达阳性组与阴性组生存分析采用Kaplan-Meier法,组间比较采用Log-rank检验,术后5年生存率单因素分析及多因素预后分析采用Cox比例风险模型。P<0.05为差异有统计学意义。
2 结 果
2.1 DKK1蛋白在食管鳞癌及正常鳞状上皮组织中的表达 DKK1蛋白表达产物主要集中在肿瘤细胞胞质中,亦有部分在胞膜表达(图1)。150例样本中DKK1阳性表达共105例,阳性表达率70%,52例正常食管组织DKK1表达均为阴性,差异有统计学意义(P<0.05)。
2.2 DKK1蛋白表达与食管癌患者临床病理特征的关系 有淋巴结转移组DKK1表达阳性62例,阳性表达率为79.5%,无淋巴结转移组DKK1表达阳性43例,阳性表达率为59.7%,差异有统计学意义(P=0.008)。肿瘤浸润深度pT3-4组DKK1表达阳性75例,阳性表达率为86.2%,pT1-2组DKK1表达阳性30例,阳性表达率为47.6%,差异有统计学意义(P<0.001)。DKK1表达与年龄、性别、组织分化程度及病理分期无关(表1)。
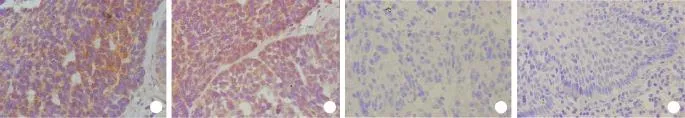
图1 食管鳞状细胞癌及鳞状上皮组织中DKK1蛋白的表达(免疫组化染色,DAB)Fig.1 DKK1 protein expression in ESCC and squamous epithelial tissue (Immunohistochemically staining, DAB)

表1 患者的一般临床资料Tab.1 Clinical features of patients
2.3 DKK1蛋白表达与食管癌患者预后的关系Kaplan-Meier 3年生存分析显示,105例DKK1表达阳性的患者中,死亡66例,3年生存率为37.1%;45例阴性表达的患者中,死亡21例,患者3年生存率为53.3%;Log-rank比较3年总体生存时间差异有统计学意义(P=0.008)。Kaplan-Meier 5年生存分析显示,DKK1阳性组与阴性组5年生存率分别为14.3% 和46.7%,DKK1蛋白表达阳性组与阴性组中位生存期时间分别为36个月和54个月,差异均有统计学意义(P<0.001,图2)。

图2 不同DKK1蛋白表达食管鳞癌患者的生存曲线Fig.2 Kaplan-Meier survival curves of ESCC patients with different DKK1 expression
2.4 5年生存率与食管癌预后的单因素及多因素分析 单因素生存分析结果显示,肿瘤浸润深度pT(HR=2.587,95%CI 1.733~3.861,P<0.001)、淋巴结转移pN(HR=2.671,95%CI 1.806~3.949,P<0.001)以及DKK1表达(HR=2.550,95%CI 1.621~4.011,P<0.001)与5年生存率明显相关,而其他病理参数如性别、年龄等与5年生存率无关(表2)。将肿瘤浸润深度pT、淋巴结转移pN、DKK1表达(分为阳性组和阴性组)三项因素引入Cox模型进行多因素生存分析,结果显示:肿瘤浸润较深pT3-4、有淋巴结转移及DKK1阳性表达是影响食管癌根治术后患者预后的独立因素(表3)。
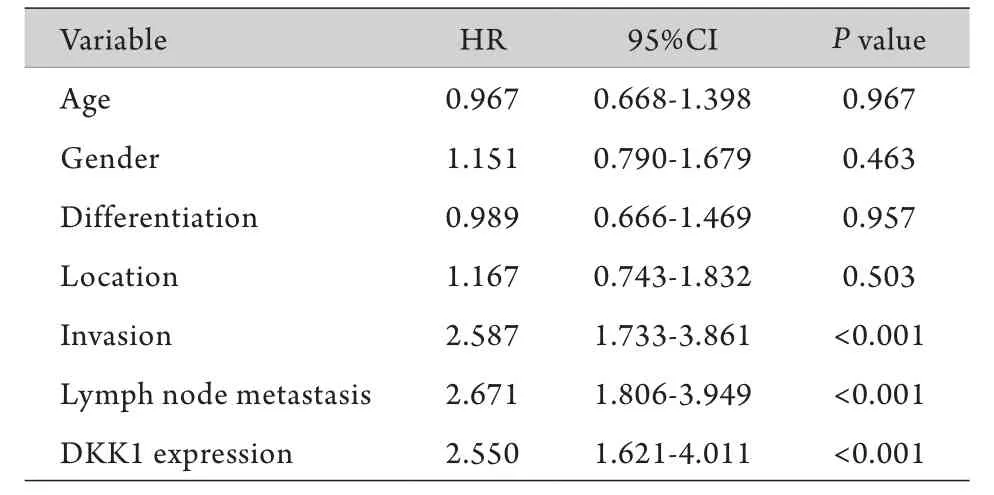
表2 食管鳞癌患者5年生存率影响因素的单因素分析Tab.2 Univariate analyses for 5-years overall survival of ESCC
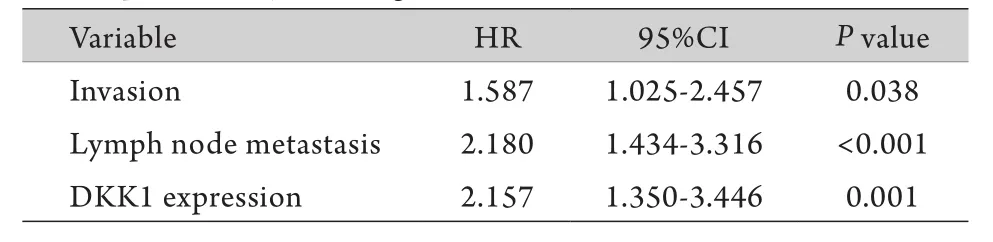
表3 食管鳞癌患者5年生存率影响因素的Cox比例风险模型分析Tab.3 Multivariate analyses for 5-years overall survival of ESCC patients by Cox regression model
3 讨 论
DKK1作为Wnt/β-catenin信号通路的拮抗剂,在许多肿瘤发生、发展过程中起重要作用[12]。DKK1是一种分泌性糖蛋白,可与细胞膜上Wnt受体LRP5和DKK1共受体Kremen1结合,形成内吞小体,从而阻断Wnt信号通路。
D K K 1在不同肿瘤中的表达水平不一。Gonzalez-Sancho等[13]研究发现,结肠癌组织与正常组织相比DKK1呈低表达,Aguilera[14]、Kuphal等[15]研究发现DKK1在恶性黑色素瘤中的表达也是降低的,证实DKK1是通过Wnt信号通路发挥抑制肿瘤的作用。然而在其他很多恶性肿瘤(包括乳腺癌、肺癌、卵巢癌、肝癌、Wilms'瘤、多发性骨髓瘤等)的研究中却发现DKK1为高表达:Wirths等[16]通过消减抑制杂交发现DKK1在人肝母细胞瘤和Wilms'瘤中高表达,在2例肝细胞癌标本中也发现DKK1高表达;Patil等[17]使用DNA微阵列芯片研究肝细胞癌的基因表达模式,也发现DKK1高表达;Forget 等[18]发现DKK1在激素抵抗型乳腺癌细胞(雌二醇激素受体阴性、黄体酮激素受体阴性的乳腺癌细胞)内呈高表达状态;Qian等[19]发现DKK1在多发性骨髓瘤患者的骨髓瘤细胞中高表达。本研究中,实验组150例ESCC组织中有105例DKK1蛋白呈阳性,DKK1阳性表达率达70%(105/150),而对照组52例正常食管切缘组织中DKK1蛋白全部呈阴性表达,两组的DKK1阳性表达率差异有统计学意义,表明在ESCC中DKK1是高表达的。综合上述研究及本研究结果证实,DKK1在不同恶性肿瘤中的表达情况及功能作用存在很大差异。DKK1在人类某些肿瘤中可能扮演Wnt抑制剂的角色,但在某些肿瘤中DKK1可能通过另外未知的途径发挥作用。
本研究在分析150例ESCC患者DKK1表达与临床病理特征关系时发现,有淋巴结转移组DKK1表达阳性62例,阳性表达率为79.4%,无淋巴结转移组DKK1表达阳性43例,阳性表达率为59%,差异有统计学意义(P=0.008)。病理分期pT3-4组DKK1表达阳性75例,阳性表达率为86.2%,病理分期pT1-2组DKK1表达阳性30例,阳性表达率为47.6%,差异有统计学意义(P≤0.001)。DKK1表达与年龄、性别、组织分化程度等临床病理参数无关。肿瘤细胞的浸润深度及有无淋巴结转移很大程度上提示了该肿瘤的侵袭、转移能力,故本研究结果提示DKK1可能参与了食管鳞癌的发生和发展过程,并增强ESCC的浸润、转移能力,促进癌细胞转移,是食管鳞癌发生、发展中重要的分子事件。DKK1 在ESCC中的高表达可能预示ESCC的侵袭、转移能力较强,并进一步预示患者预后不良。日本学者Makino等[20]研究发现DKK1表达与任何临床病理参数均无相关性,这是否与研究样本的临床病理特征差异或地域差异所带来的肿瘤异质性有关,仍有待于进一步加大样本研究证实。
Kaplan-Meier生存分析显示,DKK1表达阳性组与阴性组3年生存率分别为37.1%和53.3%,5年生存率分别为14.3%和46.7%,差异均具有统计学意义。单因素分析发现,肿瘤浸润深度pT、淋巴结转移pN及DKK1表达与ESCC患者5年生存率相关。将肿瘤浸润深度pT、淋巴结转移pN、DKK1表达(分为阳性组和阴性组)三项因素引入Cox模型进行多因素生存分析,结果显示:肿瘤浸润较深pT3-4、有淋巴结转移及DKK1阳性表达是影响食管癌根治术后患者不良预后的独立因素。以上结果与日本学者Yamabuki等[10]、Mikheev等[21]的研究部分一致。这些结果表明与DKK1表达阴性的ESCC患者相比,DKK1表达阳性的ESCC患者生存期短、预后差,因此DKK1有望成为判断ESCC不良预后的新的分子标记物。
综上所述,DKK1在食管鳞癌组织中高表达与食管鳞癌的浸润、转移能力有关。DKK1可以作为预测食管鳞癌患者不良预后的分子标记物。但本研究为回顾性研究,证据的论证强度有限,有待大样本前瞻性随机对照临床研究进一步证实。
[1]Rizk NP, Venkatraman E, Bains MS, et al. American Joint Committee on Cancer staging system does not accurately predict survival in patients receiving multimodality therapy for esophageal adenocarcinoma[J]. J Clin Oncol, 2007, 25(5): 507-512.
[2]Chen WS, Fu ZX, Huang C, et al. Expression of Cripto-1 in esophageal carcinoma and its relationship with epithelialmesenchymal transformation[J]. Med J Chin PLA, 2013, 38(4): 288-291. [陈旺盛, 傅仲学, 黄春, 等. Cripto-1在食管癌组织中的表达及其与上皮间质转化的关系[J]. 解放军医学杂志, 2013, 38(4): 288-291.]
[3]Yu HF, Zhang X, Xu ML, et al. Expression levels and clinical significance of FOXQ1 and E-cadherin in esophageal squamous cell carcinoma[J]. 2015, 43(2): 170-174, 228. [于海峰, 张逊,徐美林, 等. FOXQ1和E-cadherin在食管鳞状细胞癌中的表达及临床意义[J]. 天津医药, 2015, 43(2): 170-174, 228.]
[4]Zhang LC, Wang F, Fan QX. Expressions of TFPI-2 and MMP-9 in esophageal squamous cell carcinoma tissue and their relationship with vasculogenic mimicry[J]. J Jilin Univ (Med Ed) 2014, 40(3): 664-667. [张鲁川, 王峰, 樊青霞. TFPI-2和MMP-9在食管鳞状细胞癌组织中的表达及其与血管生成拟态的关系[J]. 吉林大学学报(医学版), 2014, 40(3): 664-667.]
[5]Li N, Yang W, Wang XS, et al. Expression of GASC 1 protein in esophageal squamous cell carcinoma tissue[J]. J Zhengzhou Univ (Med Sci), 2014, 49(5): 608-611. [李娜, 杨薇, 王新帅, 等. 食管鳞状细胞癌组织中GASC1蛋白的表达及意义[J].郑州大学学报(医学版), 2014, 49(5): 608-611.]
[6]Shen Q, Fan J, Yang XR, et al. Serum DKK1 as a protein biomarker for the diagnosis of hepatocellular carcinoma: a largescale, multicentre study[J]. Lancet Oncol, 2012, 13(8): 817-826.
[7]Zhou SJ, Zhuo SR, Yang XQ, et al. Serum Dickkopf-1 expression level positively correlates with a poor prognosis in breast cancer[J]. Diagn Pathol, 2014, 9(1): 161-164.
[8]Rachner TD, Thiele S, Gobel A, et al. High serum levels of Dickkopf-1 are associated with a poor prognosis in prostate cancer patients[J]. BMC Cancer, 2014, 14: 649-654.
[9]Li SJ, He YZ, Lv BL, et al. Expression and biological role of DKK1 in human esopha-geal cancer[J]. World Chin J Digestol, 2011, 19(20): 2116-2122. [李书军, 和宇峥, 吕宝雷, 等. DKK1在食管癌组织中的表达及其生物学功能[J]. 世界华人消化杂志, 19(20): 2116-2122.]
[10]Yamabuki T, Takano A, Hayama S, et al. Dikkopf-1 as a novel serologic and prognostic biomarker for lung and esophageal carcinomas[J]. Cancer Res, 2007, 67(6): 2517-2525.
[11]Liu SZ, Wang YJ. Expression and significance of far upstream element binding protein 1 in human esophageal cancer[ J]. Med J Chin PLA, 2012, 37(5): 449-451. [刘世政, 王要军. 远端上游元件结合蛋白1在食管癌中的表达及意义[J]. 解放军医学杂志, 2012, 37(5): 449-451.]
[12]Zhou BS, Zhang J, Tao GL. The inhibitory effect of Wnt antagonist Dickkopf-1 (Dkk-1) on transdifferentiation of renal tubular epithelial cells[J]. Med J Chin PLA, 2012, 37(4): 288-292. [周宝尚, 张璟, 陶光利. Wnt阻滞剂Dickkopf-1对肾小管上皮细胞转分化的抑制作用[J]. 解放军医学杂志, 2012, 37(4): 288-292.]
[13]Gonzalez-Sancho JM, Aguilera O, Garcia JM, et al. The Wnt antagonist DICKKOPF-1 gene is a downstream target of betacatenin/TCF and is downregulated in human colon cancer[J]. Oncogene, 2005, 24(6): 1098-1103.
[14]Aguilera O, Fraga MF, Ballestar E, et al. Epigenetic inactivation of the Wnt antagonist DICKKOPF-1 (DKK-1) gene in human colorectal cancer[J]. Oncogene, 2006, 25(29): 4116-4121.
[15]Kuphal S, Bosserhoff AK. Influence of the cytoplasmic domain of E-cadherin on endogenous N-cadherin expression in malignant melanoma[J]. Oncogene, 2006, 25(2): 248-259.
[16]Wirths O, Waha A, Weggen S, et al. Overexpression of human Dickkopf-1, an antagonist of wingless/WNT signaling, in human hepatoblastomas and Wilms' tumors[J]. Lab Invest, 2003, 83(3): 429-434.
[17]Patil MA, Chua MS, Pan KH, et al. An integrated data analysis approach to characterize genes highly expressed in hepatocellular carcinoma[J]. Oncogene, 2005, 24(23): 3737-3747.
[18]Forget MA, Turcotte S, Beauseigle D, et al. The Wnt pathway regulator DKK1 is preferentially expressed in hormone-resistant breast tumours and in some common cancer types[J]. Br J Cancer, 2007, 96(4): 646-653.
[19]Qian J, Xie J, Hong S, et al. Dickkopf-1 (DKK1) is a widely expressed and potent tumor-associated antigen in multiple myeloma[J]. Blood, 2007, 110(5): 1587-1594.
[20]Makino T, Yamasaki M, Takemasa I, et al. Dickkopf-1 expression as a marker for predicting clinical outcome in esophageal squamous cell carcinoma[J]. Ann Surg Oncol, 2009, 16(7): 2058-2064.
[21]Mikheev AM, Mikheeva SA, Rostomily R, et al. Dickkopf-1 activates cell death in MDA-MB435 melanoma cells[J]. Biochem Biophys Res Commun, 2007, 352(3): 675-680.
Relationship between the DKK1 expression and clinicopathological features and prognosis of oesophageal squamous cell carcinoma
WU Hong-bo, LIU Jia-rong, WU Hui-juan, ZHAO Xiu-li, CHEN Li-juan, MU Xiao-qian, HU Xiu-feng, ZOU Hong-zhi, ZHAO Yan-qiu*
Department of Internal Medicine, Henan Cancer Hospital, Affiliated to Zhengzhou University, Zhengzhou 450008, China
*
, E-mail: 13938252350@163.com
This work was supported by the Health Science and Technology Key Projects of Henan Province (200902007), and the Science and Technology Research Projects of Henan Province (142102310437)
ObjectiveTo investigate the expression of DKK1 in the tissues of esophageal squamous cell carcinoma (ESCC) and its relation with the clinicopathological features and prognosis of ESCC.MethodsThe expression of DKK1 were assessed by immunohistochemistry (IHC, SP) in 150 cases of ESCC specimens (collected by the authors from Mar. 2007 to Jun. 2009, experimental group), and 52 specimens of normal esophageal tissue adjacent to the tumor (control group). The relationship between the DKK1 expression and the clinicopathological parameters and prognosis of ESCC patients was analyzed.ResultsIn 150 specimens of ESCC tissues, the positive DKK1 expression was found in 105 specimens, and the positive rate was 70%. No DKK1 expression was detected in 52 cases of normal esophageal tissue. High DKK1 expression was correlated with the depth of tumor invasion and lymph node metastasis, but no correlation with other clinicopathological parameters was found. The 3-year survival rate in positive group and negative group of DKK1 expression was 37.1% and 53.3%, respectively (P=0.008), and the 5-year survival rate was 14.3% and 46.7%, respectively (P<0.001). Univariate analysis revealed that the 5-year survival rate was correlated with DKK1 expression, lymph node metastasis (pN), and the depth of tumor invasion (pT) in ESCC. Multivariate analysis showed that the advanced pT stage (T3-4), degree of differentiation, lymphatic invasion, and DKK1 expression were the independent and significant prognostic factors (P<0.05).ConclusionsHigh expression of DKK1 in ESCC tissues is correlated with the degree of cancer invasion, and its potential of metastasis. DKK1, as a molecular marker, may predict a poor prognosis in patients with ESCC.
genes, dickkopf-1; esophageal neoplasms; immunohistochemistry; prognosis
R735.1
A
0577-7402(2015)06-0467-05
10.11855/j.issn.0577-7402.2015.06.09
2014-10-21;
2015-02-23)
(责任编辑:张小利)
河南省卫生厅医学科技攻关重点项目(200902007);河南省科技厅重点科技攻关项目(142102310437)
吴红波,医学硕士,主治医师。主要从事恶性肿瘤生物治疗的基础及临床应用方面的研究
450008 郑州 郑州大学附属肿瘤医院内科(吴红波、柳家荣、吴慧娟、赵秀丽、陈丽娟、穆晓倩、胡秀峰、邹宏志、赵艳秋)
赵艳秋,E-mail:13938252350@163.com
