T-cadherin在肝细胞癌中的表达及其与肿瘤复发转移的关系
2015-06-28李东良张志强陈少华张世安方坚林小钦张霞江艺
李东良,张志强,陈少华,张世安,方坚,林小钦,张霞,江艺
·临床研究·
T-cadherin在肝细胞癌中的表达及其与肿瘤复发转移的关系
李东良,张志强,陈少华,张世安,方坚,林小钦,张霞,江艺
目的 探讨T-钙黏附蛋白(T-cadherin)在肝细胞癌中的表达及其与肿瘤侵袭转移的关系。方法 收集2010年5月-2011年10月于南京军区福州总医院行手术切除的肝癌患者的新鲜癌组织和癌旁2cm以上肝组织标本,采用免疫组织化学方法观察不同恶性生物学程度以及手术前TNM分期相同,术后1年内出现或未出现复发和(或)转移的HCC患者的癌组织及癌旁组织中T-cadherin基因的表达;采用RT-PCR方法检测T-cadherin基因mRNA的表达情况。结果 肝癌组织中T-cadherin的异常表达率高达46.7%(28/60),明显高于癌旁肝组织6.7%(4/60),两组相比差异具有统计学意义(χ2=24.55,P=0.000)。在高分化与中低分化的HCC患者癌组织中T-cadherin的异常表达率分别为30.0%(6/20) 和35.0%(7/20),两者比较差异无统计学意义(χ2=0.114,P=0.736)。在出现转移的HCC患者癌组织中T-cadherin的异常表达率[75%(15/20)]明显升高,与未出现转移的HCC患者[32.5%(13/40)]相比,差异具有统计学意义(χ2=9.676,P=0.002)。T-cadherin mRNA检测结果显示癌组织T-cadherin表达缺失(高度异常表达),癌旁组织在多数患者中呈正常表达(T-cadherin阳性)。结论 T-cadherin基因在HCC中异常表达,且与肝细胞癌的复发转移密切相关,有可能作为判断HCC预后的预测指标和药物研究靶点。
癌,肝细胞;钙黏着糖蛋白类;复发;肿瘤转移
肝癌是一种隐匿性疾病,一些患者在初次诊断时就已经发生了广泛的浸润或转移,即便还有手术切除机会的患者,术后复发和转移的发生率也较高[1]。针对肿瘤复发、转移的预防和治疗已成为延长患者生存时间的关键因素[2-5]。肿瘤细胞脱离原发病灶、运动能力增强是肿瘤发生转移的先决条件。细胞黏附分子是介导细胞与细胞或细胞与细胞外基质相互联系和结合的一类糖蛋白分子,上皮钙黏附蛋白(truncated-cadherin,T-cadherin)是一种新的非经典黏附分子,以糖基磷脂酰肌醇分子附着于细胞膜上,调节钙介导的细胞黏附、细胞极性并参与细胞间的识别和信号传导等作用[6-7]。有研究表明在缺失T-cadherin的黑色素瘤中使其再表达可抑制瘤细胞的生长及侵袭运动能力[8]。也有研究显示,原发性肝癌(HCC)中的T-cadherin异常表达[9],但T-cadherin与HCC复发和转移的关系尚不明确。本研究探讨T-cadherin基因在肝细胞癌中的表达及其与肝癌恶性分化、侵袭和转移的关系。
1 材料与方法
1.1 材料及分组 收集2010年5月至2011年10月于南京军区福州总医院行手术切除的肝癌患者的新鲜癌组织和癌旁2cm以上肝组织标本,标记后置于液氮罐中速冻,–80℃低温冰箱保存。一部分标本提取基因组,用于RT-PCR检测T-cadherin mRNA的表达,另一部分标本用4%甲醛固定,制备石蜡切块。共选取石蜡组织标本60份,其中在1年随访期间发生复发和(或)转移的HCC患者20例,未发生复发和(或)转移的40例(高分化与中低分化各20例)。两组患者术前肿瘤TNM分期无差异。观察T-cadherin在两组患者癌及癌旁组织中的表达差异。所有患者术前均未接受介入栓塞化疗及其他治疗。
1.2 T-cadherin mRNA表达检测 取约50mg冰冻癌组织或癌旁组织,加入1ml Trizo1(Gibco公司),充分匀浆后按照说明书步骤提取总RNA,按反转录试剂盒(Promega公司)说明书反转录合成cDNA,进行荧光定量RT-PCR反应。PCR扩增所需引物序列见表1。PCR反应条件为:94℃ 5min,57℃ 30s,72℃30s,扩增40个循环。
1.3 免疫组化法检测T-cadherin的定位及表达 临床手术切除标本用常规4%甲醛固定,石蜡包埋,制成3μm连续切片并脱蜡、脱水;置于微波炉内抗原热修复90s暴露抗原;3%H2O2室温下孵育10min阻断内源性过氧化物酶活性;室温下置于0.05% Tween20 (pH7.0)中10min;滴加兔抗人T-cadherin单克隆抗体(1:150,美国Gibco公司),室温下1h;PBS冲洗3min×3;再次放入0.05% Tween 20 (pH7.0)中,室温放置2h;滴加增强剂20min;加羊抗兔二抗(美国Gibco公司),室温下放置30min;PBS冲洗,DBA显色剂显色5~20min;苏木精复染,饱和碳酸锂30s,95%~100%乙醇脱水,吹干,封固,镜下观察并拍照。以PBS代替一抗作为阴性对照进行同步染色。T-cadherin阳性产物主要分布在正常肝组织的肝细胞膜上,为粗细一致的棕黄色颗粒,在细胞质中可有微量表达,在细胞核内无表达。判断标准按Maruyama等[7]的方法,高倍镜(×400)下每个视野计数100个细胞,每张切片数5个视野。观察T-cadherin的定位。细胞膜阳性表达<5%为阴性(–),5%~24%为弱阳性(+),25%~50%为阳性(),>50%为强阳性()。当细胞膜上阴性及弱阳性表达和(或)出现胞质阳性表达>10%及细胞核阳性表达时均判定为异常表达。

表1 PCR反应引物序列Tab.1 The primer sequences of the target genes
2 结 果
2.1 T-cadherin mRNA在肝癌组织和癌旁组织中的表达 RT-PCR检测结果显示,高分化(A)和中低分化(B)癌旁肝组织T-cadherin mRNA均呈强阳性表达,而癌组织T-cadherin mRNA表达缺失。复发转移患者(C)不仅癌组织T-cadherin mRNA表达均呈阴性,且半数患者癌旁组织T-cadherin mRNA表达也呈阴性(图1)。

图1 RT-PCR检测T-cadherin mRNA的表达Fig.1 Expression of T-cadherin mRNA determined by RT-PCR
2.2 T-cadherin蛋白在肝癌组织和癌旁组织中的表达 免疫组化结果显示,癌旁组织中T-cadherin蛋白主要在细胞膜上表达,阳性表达率为93.3%(56/60),缺失及异常表达较少见,仅占6.7%(4/60);肝癌组织中细胞膜T-cadherin阳性表达率降低,为53.3%(32/60),缺失和异常表达明显升高,占46.7%(28/60)。与癌旁组织相比,癌组织细胞膜T-cadherin异常表达,差异具有统计学意义(χ2=24.545,P=0.000,图2)。
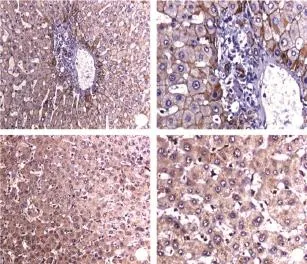
图2 免疫组化检测T-cadherin在癌组织和癌旁组织中的表达(DBA显色)Fig.2 Expression of T-cadherin in cancer tissue and canceradjacent tissue determined by immunohistochemistry (DBA)
2.3 T-cadherin在高分化与中低分化HCC患者癌组织中的表达 两组患者癌组织中T-cadherin细胞膜表达均减弱或消失,部分癌组织可见胞质表达。高分化及中低分化HCC患者T-cadherin异常表达率分别为30.0%(6/20)和35.0%(7/20),两组比较差异无统计学意义(χ2=0.114,P=0.736)。
2.4 T-cadherin在出现或未出现复发和(或)转移患者癌组织中的表达 在出现复发和(或)转移患者癌组织中,T-cadherin的缺失和异常表达率高达75.0%(15/20),在未出现复发和(或)转移患者中,T-cadherin的缺失和异常表达率为32.5%(13/40),其中高分化组3 0.0%(6/2 0),中低分化组为35.0%(7/20)。发生复发和(或)转移组与未发生复发和(或)转移组相比两组差异具有统计学意义(χ2=9.676,P=0.002)。
3 讨 论
T-cadherin是近年来新发现的一个细胞黏附分子,为cadherin超家族中的重要一员[7],与经典的黏附分子的主要区别在于经典cadherin分子由细胞外钙结合区及跨膜区两部分组成,而非经典的黏附分子缺少跨膜区而以糖基磷脂酰肌醇分子附着于细胞膜上,故而命名truncated-cadherin,即T-cadherin(又称CDH13或H-cadherin)。T-cadherin定位于染色体16q24,其cDNA包含一个含714个氨基酸的开放读码框,全长约3842bp[6,10]。T-cadherin有调节钙介导的细胞黏附、细胞形态形成、细胞间识别和信号传导等作用[11]。
近年来已陆续有关T-cadherin在肝癌[9]、结直肠癌[12]、胆囊癌[13]、鳞状上皮细胞癌[14]、膀胱移行细胞癌[15]等出现不同程度异常表达的报道,提示其可能对上皮细胞类型的肿瘤有抑制作用,从而在肿瘤发生过程中扮演重要角色。Chan[9]报道T-cadherin基因在肝细胞癌中的表达下降,能诱导肝癌细胞停滞在G2/M期,被认为是肝癌中的关键抑癌基因。
本研究收集HCC切除标本,通过RT-PCR方法和免疫组织化学方法对比观察T-cadherin在癌组织与癌旁肝组织,高分化与中低分化肝细胞癌及出现复发和(或)转移与未发生复发和/或转移的原发性肝癌患者癌组织中的表达,结果显示T-cadherin基因在癌组织异常表达率较高,而多数患者癌旁组织T-cadherin仍表达正常,进一步证实T-cadherin失活或表达下降在肝癌的发生和发展中可能发挥着一定作用。另外,T-cadherin与肝细胞癌复发和(或)转移的相关性研究较少,本研究还探讨了T-cadherin异常表达与肝癌复发、转移的关系,结果显示发生复发和(或)转移的HCC患者癌组织T-cadherin的异常表达明显高于未发生复发和(或)转移的患者,提示T-cadherin可能在肝癌的复发和转移中也发挥着重要的生物学作用。
本研究结果再次证实T-cadherin与肿瘤的发生、发展有着密切联系。T-cadherin作为细胞黏附分子cadherin超家族成员之一,在人类癌细胞中表达下调,其下调机制与T-cadherin基因启动子甲基化有明显关系。T-cadherin还是一种新的血管生成调节因子,研究表明该分子或许可作为调节异常新生血管生成的治疗性靶点加以开发,以阻止肿瘤新生血管生成的病理过程[16]。检测T-cadherin在肿瘤中的表达情况对指导临床分期以及评价肿瘤预后等有重要意义,对其进一步的深入研究可为肿瘤的诊断和治疗带来新的契机。由于在人类恶性肿瘤中普遍发现的异常甲基化能导致钙黏蛋白介导的细胞黏附系统失活,因此,T-cadherin异常甲基化的检测或许可作为临床筛选高危患者复发或预后的标记而得以应用。
[1]Yang M, Xiao L, Shi XM. A study of antiviral therapy in prevntion of tumor recurrence after curative treatment of hepatocellular carcinoma[J]. Med J Chin PLA, 2010, 35(6): 726-728+732.[杨明, 肖亮, 施晓敏. 抗病毒治疗对预防肝癌根治术后肿瘤复发的作用研究[J]. 解放军医学杂志, 2010, 35(6): 726-728+732.]
[2]Tang ZY. Important issues of cancer metastasis[J]. Chin J Digest Surg, 2014, 13(3): 161-164. [汤钊猷. 癌转移研究的几个重要问题[J]. 中华消化外科杂志, 2014, 13(3): 161-164.]
[3]Lv WP, Zhou KL, Li J, et al. Predictors and prognosis of patientswith advanced stage small hepatocellular carcinoma after hepatectomy[J]. Med J Chin PLA, 2013, 38(1): 44-47. [吕文平,周开伦, 李杰, 等. 晚期小肝癌的临床预测因素及肝切除术预后研究[J]. 解放军医学杂志, 2013, 38(1): 44-47.]
[4]Guo YH, He MY, Liu JW, et al. Expression and clinical significance of miR-155 in hepatocellular carcinoma[J]. J Logist Univ PAPF (Med Sci), 2014, 23(11): 901-904. [郭跃虎, 何明艳, 刘建武, 等. miR-R-155在肝细胞肝癌组织中的表达及临床意义[J]. 武警后勤学院学报(医学版), 2014, 23(11): 901-904.]
[5]Jin SL, Huang ZR, Chen H, et al. The biological difference between CD13+CD133+and CD13–CD133–liver cancer cells and its clinical significance[J]. Med J Chin PLA, 2013, 38(8): 661-664. [金世龙, 黄中荣, 陈华, 等. CD13+CD133+和CD13–CD133–肝癌细胞的生物学差异及临床意义[J]. 解放军医学杂志, 2013, 38(8): 661-664.]
[6]Philippova M, Joshi MB, Kyriakakis E, et al. A guide and guard: the many faces of T-cadherin[J]. Cell Signal, 2009, 21(7): 1035-1044.
[7]Angst BD, Marcozzi C, Magee AI. The T-cadherin superfamily: diversity in form and function[J]. Cell Sci, 2001, 114(pt4): 629-641.
[8]Kuphal S, Martyn AC, Pedley J, et al. H-cadherin expression reduces invasion of malignant melanoma[J]. Pigment Cell Melanoma Res, 2009, 22(3): 296-306.
[9]Chan DW, Lee JM, Chan PC, et al. Genetic and epigenetic inactivation of T-cadherin in human hepatocellular carcinoma cells[J]. Int J Cancer, 2008, 123(5): 1043-1052.
[10] Kipmen-Korgun D, Osibow K, Zoratti C, et al. T-cadherin mediates low-density lipoprotein-initiated cell proliferation via the low-density Ca2+-tyrosine kinase-Erk-1/2 pathway[J]. J Cardiovasc Pharmacol, 2005, 45(5): 418-430.
[11] Ivanov DB, Philippova MP, Tkachuk VA, et al. Structure and functions of classical cadherins[J]. Biochemistry (Mosc), 2001, 66(10): 1174-1186.
[12] Ren JZ, Huo JR. Correlation between T-cadherin gene expression and aberrant methylation of T-cadherin promoter in human colon carcinoma cells[J]. Med Oncol, 2012, 29(2): 915-918.
[13] Adachi Y, Takeuchi T, Nagayama T, et al. Zebl-mediated T-cadherin repression increases the invasive potential of gallbladder cancer[J]. FEBS Lett, 2009, 583(2): 430-436.
[14] Pfaff D, Philippova M, Buechner SA, et al. T-cadherin loss induces invasive phenotype in human keratinocytes and squamous cell carcinoma (SCC) cells in vitro and is associated with malignant transformation of cutaneous SCC in vivo[J]. Br J Dermatol, 2010, 63(2): 353-363.
[15] Lin Y, Sun G, Liu X, et al. Clinical significance of T-cadherin tissue expression in patients with bladder transitional cell carcinoma[J]. Urol Int, 2011, 86(3): 340-345.
[16] Ivanov D, Philippova M, Allenspach R, et al. T-cadherin upregulation correlates with cell-cycle progression and promotes proliferation of vascular cells[J]. Cardiovasc Res, 2004, 64(1): 132-143.
Expression of T-cadherin in hepatocellular carcinoma and its relationship with relapse and metastasis of tumor
LI Dong-liang1, ZHANG Zhi-qiang1, CHEN Shao-hua2, ZHANG Shi-an1, FANG Jian1, LIN Xiao-qin3, ZHANG Xia1, JIANG Yi21Department of Hepatobiliary Medicine,2Department of Hepatobiliary Surgery, Fuzhou General Hospital of Nanjing Command, Fuzhou 350025, China
3Mengchao Hepatobiliary Hospital, Fujian Medical University, Fuzhou 350108, China
This work was supported by the Natural Science Foundation of Fujian Province (2012J01399) and Fuzhou Science and Technology Plan Project (2012-S-157-2)
ObjectiveTo investigate the expression of T-cadherin in hepatocellular carcinoma and its relationship with tumor relapse and metastasis.MethodsThe gene expressions of T-cadherin in hepatocellular carcinoma tissue with different malignancy grades and its matched adjacent tissues were assessed by immunohistochemistry. The samples were obtained from patients both with relapse and/or metastasis, without relapse, and without metastasis within one year post-operation, and they were in the same TNM stage before operation. The mRNA expression of T-cadherin in hepatocellular carcinoma and matched adjacent tissues was assessed by RT-PCR.ResultsThe abnormal expression rate of T-cadherin in hepatocellular carcinoma was 46.67% (28/60), which was significantly higher than that of the adjacent tissue (6.67%, 4/60, χ2=24.55, P=0.000). No difference was observed in the expression of T-cadherin between well-differentiated and poorly differentiated hepatocellular carcinoma tissues (30% vs 35%, χ2=0.114, P=0.736). The abnormal expression rate of T-cadherin in hepatocellular carcinoma in the patients with metastasis elevated to 75% (15/20), while it was remarkably lower in 32.5% (13/40) of the patients who had no metastasis (χ2=9.676, P=0.002). The RT-PCR results showed that the mRNA expression of T-cadherin in hepatocellular carcinoma significantly decreased compared with that of its adjacent tissues.ConclusionsThere is an abnormal expression of T-cadherin in hepatocellular carcinoma, and it is found to be closely correlated to the tumor recurrence and metastasis. Abnormal expression of T-cadherin in hepatocellular carcinoma may be used as a prognostic indicator and drug research target.
carcinoma, hepatocellular; cadherins; recurrence; neoplasm metastasis
R735.7
A
0577-7402(2015)04-0315-04
10.11855/j.issn.0577-7402.2015.04.12
2014-12-25;
2015-02-28)
(责任编辑:熊晓然)
福建省自然科学基金(2012J01399),福州市科技计划项目(2012-S-157-2)
李东良,医学博士,主任医师,教授。主要从事肝胆疾病的基础与临床研究
350025 福州 南京军区福州总医院肝胆内科(李东良、张志强、张世安、方坚、张霞),肝胆外科(陈少华、江艺);350108 福州 福建医科大学孟超肝胆医院(林小钦)
