HS6101不同时间给药对环磷酰胺所致小鼠造血功能损伤的恢复作用
2015-06-28邢爽申星熊国林柳晓兰杨萌代常亮刘晓宇余祖胤
邢爽,申星,熊国林,柳晓兰,杨萌,代常亮,刘晓宇,余祖胤
HS6101不同时间给药对环磷酰胺所致小鼠造血功能损伤的恢复作用
邢爽,申星,熊国林,柳晓兰,杨萌,代常亮,刘晓宇,余祖胤
目的 探讨HS6101(6101)不同时间给药对环磷酰胺(CTX)致小鼠造血功能损伤的恢复作用。方法 103 只5~6周龄雄性ICR小鼠,分为CTX对照组、6101预防组、6101治疗组、6101预防+治疗组共4组。CTX损伤小鼠建模方法为腹腔注射CTX 100mg/kg,1次/d,连续注射3d。6101给药剂量为27μg/只,单次皮下注射0.2ml。6101预防组给药时间为CTX首次注射前1h,6101治疗组给药时间为CTX末次注射后1h,6101预防+治疗组给药时间为CTX首次注射前1h+CTX末次注射后1h,CTX对照组注射生理盐水0.2ml/只。分别于CTX首次注射前1d和注射后3、5、7、9、11、13、15、17d取尾静脉血10μl检测血常规,比较6101各给药组与CTX对照组间的差异。另取30只雄性ICR小鼠,在上述分组基础上增加正常对照组,6只/组,建模与给药方法同上,各组分别于CTX首次注射后4、9d处死3只小鼠,取左侧股骨分离单个核细胞进行骨髓造血祖细胞集落培养,取右侧股骨做常规病理组织学观察。结果 腹腔注射CTX后小鼠外周白细胞、中性粒细胞、淋巴细胞、红细胞和血小板数均迅速减少。6101预防组小鼠外周血白细胞、中性粒细胞和淋巴细胞数最低值明显高于CTX对照组,且其第3天的检测值高于6101治疗组及6101预防+治疗组;6101预防组外周血红细胞在第3、5、7天均明显高于CTX对照组,第3天高于6101治疗组和6101预防+治疗组;6101预防组血小板数第3天时明显高于其他3组,而6101治疗组与6101预防+治疗组则明显低于CTX对照组,血小板开始恢复后6101预防给药促恢复作用更明显。第4天和第9天的骨髓造血细胞集落培养结果显示,6101预防组、治疗组和预防+治疗组的粒巨噬系、巨核系、爆式红系和红系细胞集落数均高于CTX组;第4天骨髓病理组织学观察结果也表明6101各给药组小鼠骨髓组织结构优于CTX对照组。实验中6101治疗组和预防+治疗组小鼠出现死亡(分别为3/18、9/18),可能与其早期血小板数显著降低有关,提示6101不宜在CTX注射后给药。结论 6101于CTX注射前1h给药可明显促进CTX所致ICR小鼠造血功能损伤的恢复。
HS6101;脂肽化合物;环磷酰胺;小鼠;造血系统
细胞保护剂对保障肿瘤患者顺利接受放化疗具有重要作用,但在应用时大多具有很强的给药时效性。例如,氨磷汀(WR-2721)作为广谱细胞保护剂能够减低顺铂、环磷酰胺等化疗药物的毒性[1],但需在化疗前15~30min静脉注射给药[2]。近年来,脂肽类Toll样受体激动剂类的细胞保护剂受到高度关注,但其效应亦明显受给药时间影响[3-4]。HS6101是人工合成的作用于Toll样受体的一种脂肽,与CBLB613属同一类细胞保护剂[4-5],能明显减轻射线引起的小鼠及恒河猴的造血细胞损伤,本课题组前期观察到它对化疗药物损伤的小鼠造血细胞有保护作用,但给药时间对其效应的影响尚不明了。因此,本研究观察了HS6101不同时间给药对化疗药物环磷酰胺所致ICR小鼠造血功能损伤恢复的影响,旨在为确定HS6101的临床给药时间提供实验依据。
1 材料与方法
1.1 药物与仪器 环磷酰胺(CTX)粉针剂为山西普德药业有限公司生产(国药准字号H14023686,批号04130201)。HS6101(6101)白色冻干粉剂为浙江海正药业股份有限公司研制(批号20120903)。小鼠骨髓细胞集落培养基M3434购自加拿大Stem Cell公司。Celltac E MEK-7222K型血细胞自动分析仪购自日本Nihon Kohden公司。
1.2 动物及分组 雄性5~6周龄SPF级ICR小鼠103只,体重20.0±2.0g,购自斯贝福(北京)实验动物科技有限公司,动物质量合格证号SCXK-(京)2011-0004。动物常规饲养于军事医学科学院实验动物中心SPF级小鼠实验室内,动物饲养设施合格证号SYXK-(军)2007-004,适应性饲养3d后进行实验。另30只供骨髓细胞培养与骨髓病理切片观察的动物分笼单独饲养。实验动物分为CTX对照组、6101预防组(-1h)、6101治疗组(+1h)与6101预防+治疗(–1h+1h)组(表1)。骨髓细胞培养与骨髓病理切片用实验动物除上述4组外,增加正常对照组,每组6只。
1.3 化疗药物损伤小鼠模型制备 采用CTX 100mg/kg,1次/d,连续3d腹腔注射建立CTX损伤小鼠模型。
1.4 HS6101给药方法 用1ml无菌注射用水将西林瓶封装(2mg/支)的冻干粉剂HS6101溶解成2.0mg/ml储存液,再以无菌生理盐水将其稀释至135μg/ml,每只小鼠皮下注射0.2ml,各组给药时间见表1。CTX对照组每只小鼠注射0.2ml生理盐水。
1.5 观察指标 每天2次观察小鼠的一般状况。血细胞计数:分别于注射CTX前1d及CTX首次注射后3、5、7、9、11、13、15、17d取尾静脉血10μl检测血常规。骨髓造血祖细胞集落培养:首次注射CTX后4、9d每组各取3只小鼠颈椎脱臼处死,无菌条件下取左侧股骨,RPMI 1640培养液冲洗并分离骨髓单个核细胞进行体外造血祖细胞集落培养,观察骨髓有核细胞形成造血祖细胞集落的能力。骨髓病理切片:首次注射CTX后4、9d,每组各取3只小鼠颈椎脱臼处死,取右侧股骨于Helly's液中固定24h后取出,再于4%甲醛溶液中固定1周,脱钙后行石蜡切片,常规伊红-苏木素(HE)染色,光学显微镜下观察骨髓组织病理学改变。

表1 实验动物分组Tab.1 Group assignment of the experimental animals
1.6 统计学处理 采用SPSS 19.0进行统计分析。计量资料以?±s表示,外周血常规数据采用重复测量的方差分析,造血细胞集落数的组间比较采用单因素k水平的方差分析(One-way ANOVA),两组间的比较采用LSD-t或Dunnet t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 实验鼠一般状况 6101给药后1d起6101治疗组和6101预防+治疗组动物精神状态即较CTX对照组、6101预防组变差,活动减少,眼睛有分泌物且睁眼困难,第3天时症状缓解,基本恢复,且从第5天起出现动物死亡,20d观察期内死发生亡率分别为16.7%(3/18)和50.0%(9/18),CTX对照组及6101预防组动物全部存活。
2.2 外周血白细胞、中性粒细胞和淋巴细胞数的变化 ICR小鼠连续3d腹腔注射CTX后外周血白细胞数迅速下降,CTX对照组、6101预防组、6101治疗组、6101预防+治疗组均于CTX首次注射后3d降至最低,分别为CTX注射前的36%、72%、30%、38%,但6101预防组明显高于其他3组(P<0.01),第5天各组白细胞数开始明显升高,6101各给药组均高于CTX对照组(P<0.05);7d后白细胞数各组间差异无统计学意义(P>0.05);第9天检测值“反跳”达峰值,分别为CTX注射前的336%、261%、265%和284%,第17天检测值基本回落至CTX注射前水平。6101对CTX损伤ICR小鼠外周血中性粒细胞数的影响与白细胞数基本一致。小鼠腹腔注射CTX后外周血淋巴细胞数迅速下降,第3天降至最低,CTX对照组、6101预防组、6101治疗组、6101预防+治疗组分别为CTX注射前的36%、66%、21%、43%,6101预防组明显高于其他3组(P<0.05),第9天升高达峰值,分别为290%、180%、250%和215%,之后回落波动于CTX注射前水平(图1)。
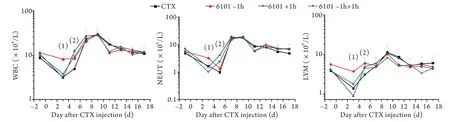
图1 6101不同时间给药对CTX损伤小鼠外周血白细胞、中性粒细胞和淋巴细胞数的影响Fig.1 Effect of the delivery time of 6101 on the peripheral blood leukocyte, neutrophil and lymphocyte count of CTX injured mice
2.3 外周血红细胞数变化 6101预防组红细胞数在注射CTX后第3、5、7天升高,第11天开始回落至CTX注射前水平,第3、5、7天红细胞数均明显高于CTX对照组(P<0.05),第3天高于6101治疗组和6101预防+治疗组,第7天CTX对照组、6101预防组、6101治疗组、6101预防+治疗组红细胞数检测值分别为CTX注射前的86%、107%、113%和120%,6101各给药组明显高于CTX对照组(P<0.05,图2)。
2.4 外周血血小板数变化 腹腔注射CTX后小鼠外周血小板数迅速降低,注射CTX后第3天,6101预防组血小板数明显高于其他3组,而6101治疗组和6101预防+治疗组则明显低于CTX对照组。注射CTX后1周左右血小板数开始恢复,6101预防组第7、9天的血小板数检测值低于CTX对照组,但是第13和15天则明显高于同期CTX对照组;6101治疗组第9、11天检测值低于CTX组,第15天高于CTX对照组,而且第11天和13天的检测值明显低于6101预防组;6101预防+治疗组在第7、11天的血小板检测值低于同期CTX对照组,第13和15天则高于同期CTX对照组。第17天时4组血小板数相当,基本恢复至正常水平(表2)。

图2 6101不同时间给药对CTX损伤小鼠外周血红细胞数的影响Fig. 2 Effect of the delivery time of 6101 on the peripheral blood erythrocyte count of CTX injured mice
表2 6101不同时间给药的CTX损伤ICR小鼠外周血小板数(±s)Tab.2 Platelet count in peripheral blood of CTX injured ICR mice with different time of 6101 treatment (±s)
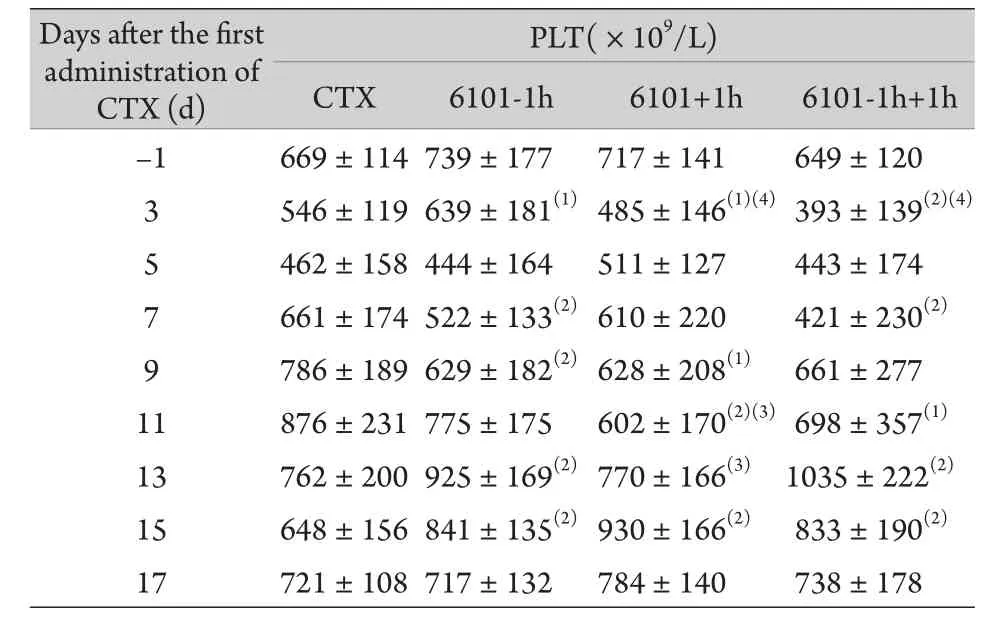
表2 6101不同时间给药的CTX损伤ICR小鼠外周血小板数(±s)Tab.2 Platelet count in peripheral blood of CTX injured ICR mice with different time of 6101 treatment (±s)
(1)P<0.05, (2)P<0.01 compared with CTX group; (3)P<0.05, (4) P<0.01 compared with 6101-1h group
?
2.5 骨髓造血细胞集落数变化 CTX首次注射后4、9d取小鼠股骨骨髓细胞做体外集落形成实验,计数每组各系造血祖细胞集落数。CTX首次注射后第4天,CTX对照组小鼠骨髓造血干细胞形成粒巨噬细胞集落(GM-CFU)、巨核细胞集落(MKCFU)、爆式红系(BFU-E)、红细胞集落(CFU-E)和混合系集落(Mix-CFU)数量均明显低于正常鼠,而6101预防组、治疗组、预防+治疗组的造血细胞集落形成能力均明显改善,特别是对GM-CFU、MKCFU、BFU-E、CFU-E的生成有明显刺激作用。尽管6101治疗组小鼠在给药后8d内死亡未能做培养,但第9天时6101预防组和6101预防+治疗组的GMCFU、MK-CFU、CFU-E和BFU-E集落形成数均高于CTX组,6101预防+治疗组的GM-CFU、MK-CFU和BFU-E集落形成数与正常小鼠相当(图3)。

图3 6101不同时间给药对CTX损伤小鼠骨髓细胞集落数的影响Fig.3 Effect of the delivery time of 6101 on bone marrow cells colony-forming unit (CFU) of CTX injured mice
2.6 骨髓病理组织切片观察 分别在CTX首次注射后第4、9天处死小鼠,取股骨做病理组织切片,光学显微镜下观察发现,第4天时CTX对照组小鼠骨髓细胞数量中等,类型多样,细胞密度局部适中,部分骨髓细胞呈条索状排列,散在空腔内无骨髓细胞,且血窦内充满红细胞。与CTX对照组比较,6101预防组小鼠骨髓细胞数量明显增多,细胞密度大,脂肪和空隙较少,血窦内红细胞较多。6101治疗组小鼠骨髓细胞数量、密度和组织结构基本同6101预防组。与CTX对照组比较,6101预防+治疗组小鼠骨髓细胞数量很多,密度非常大,巨核细胞数量似较少,细胞间空隙很小(图4)。对骨髓病理切片进行综合评分,以正常小鼠骨髓为满分(10分),CTX对照组、6101预防组、6101治疗组和6101预防+治疗组的评分分别为6、8、8、9分,6101预防+治疗组优于其他各组。第9天时,CTX对照组小鼠骨髓细胞数量很多,密度非常高,除局部几处稍大空隙外,骨髓细胞间空隙很小,脂肪细胞和血窦红细胞少。与CTX对照组比较,6101预防组小鼠骨髓细胞数量很多,密度非常高,细胞间空隙很少,脂肪细胞和血窦红细胞少。与CTX对照组比较,6101预防+治疗组小鼠骨髓细胞数量很多,密度非常高,细胞间空隙很少,脂肪细胞和血窦红细胞少。CTX注射后后第9天各组骨髓细胞超常增多,已无法对病理切片进行综合评分。

图4 CTX首次注射后4d小鼠骨髓病理组织切片(HE染色×100)Fig.4 Bone marrow histopathology of ICR mice on day 4 after the first administration of CTX (HE staining ×100)
3 讨 论
HS6101是人工合成的含9肽氨基酸残基的脂肽化合物,属于Toll样受体激动剂,与CBLB613类似,在小鼠体内可刺激诱导生成IL-1β、IL-6、IL-10、IL-12、KGF、G-CSF、GM-CSF、TNF-1α等细胞因子,产生显著的辐射防护作用[4-5],但目前尚未见HS6101促进化疗后造血功能恢复的相关文献报道。鉴于HS6101能刺激体内上述细胞因子的生成,推测其可能促进化疗后骨髓造血功能的恢复。在前期工作中,我们观察到HS6101预防给药对CTX引起的小鼠造血细胞损伤有改善作用。由于肿瘤患者常常会因病情、体质状况或其他原因在化疗后才能接受辅助治疗,或者需要在化疗前后均接受辅助治疗,为了明确给药时间对HS6101作用效果的影响,本实验重点观察了HS6101在首次CTX化疗前1h给药(-1h)、末次CTX后1h给药(+1h)以及CTX前后均给药(-1h+1h)对CTX损伤小鼠造血功能的影响。
本实验结果表明,HS6101于首次注射CTX前1h单次皮下注射给药对CTX所致小鼠造血系统损伤有较好的预防作用,可明显改善化疗药物引起的外周血白细胞、中性粒细胞、血小板、淋巴细胞和红细胞减少,并在一定程度上促进外周血白细胞与淋巴细胞数的恢复。此外,还能减轻CTX引起的造血干细胞增殖分化能力下降并促进其恢复,而且对骨髓造血组织的结构和造血细胞均有改善和保护作用,观察期内该组动物全部存活。6101于造模后1h单次注射或分别在造模前1h与造模后1h各1次注射给药对CTX引起的外周血细胞减少无明显改善作用,但当造血开始恢复后,则可在一定程度上促进小鼠白细胞、中性粒细胞、红细胞和淋巴细胞数的恢复,这与它能够减轻CTX引起的小鼠造血干细胞增殖分化能力下降并改善骨髓造血组织结构、促进造血干细胞分化有关。然而,6101于造模后1h单次注射或分别在造模前1h与造模后1h各1次注射给药对血小板的恢复均无促进作用,相反,似乎有加剧早期血小板减少的趋势,该现象值得关注并有待进一步验证。血小板严重减少会导致死亡,6101治疗组和6101预防+治疗组早期血小板数明显低于CTX对照组和6101预防组可能是前两组动物出现死亡、而后两组动物全部存活的主要原因,该结果提示HS6101不宜于CTX损伤后给药。综合分析本实验结果,我们认为HS6101于首次化疗前1h给药促进CTX损伤ICR小鼠造血功能恢复的效果优于其他两个时间点给药。此外,G-CSF等细胞因子[6-8]或其他辅助治疗药物[9-11]需多次注射或数十天口服给药,而HS6101仅需单次皮下注射给药,具有明显的优势。
化疗药物引起的白细胞和血小板减少等并发症一直是导致肿瘤患者难以顺利足量完成化疗的主要原因,而本研究结果显示,HS6101在首次注射CTX 前1h单次皮下注射给药可明显促进CTX损伤ICR小鼠造血功能恢复,为肿瘤化疗患者的辅助治疗提供了新的选择。
[1]Yang CY, Zhang XG, Zhang TH. Effect of amifostine on lung uptake of paraquat and prevention from lung injury in rats[J]. Med J Chin PLA, 2012, 37(6): 614-617. [阳彩云, 张锡刚, 张天宏. 氨磷汀对百草枯染毒大鼠肺摄取及肺损伤的影响[J].解放军医学杂志, 2012, 37(6): 614-617.]
[2]Culy CR, Spencer CM. Amifostine: an update on its clinical status as a cytoprotectant in patients with cancer receiving chemotherapy or radiotherapy and its potential therapeutic application in myelodysplastic syndrome[J]. Drugs, 2001, 61(5): 641-684.
[3]Burdelya LG, Krivokrysenko VI, Tallant TC, et al. An agonist of toll-like receptor 5 has radioprotective activity in mouse and primate models[J]. Science, 2008, 320(5873): 226-330.
[4]Singh VK, Ducey EJ, Fatanmi OO, et al. CBLB613: a TLR 2/6 agonist, natural lipopeptide of Mycoplasma arginini, as a novel radiation countermeasure[J]. Radiat Res, 2012, 177(5): 628-642.
[5]Hedayat M, Takeda K, Rezaei N. Prophylactic and therapeutic implications of toll-like receptor ligands. Med Res Rev, 2012, 32(2): 294-325.
[6]Cox GN, Chlipala EA, Smith DJ, et al. Hematopoietic properties of granulocyte colony-stimulating factor/immunoglobulin (G-CSF/IgG-Fc) fusion proteins in normal and neutropenic rodents[J]. PLoS One, 2014, 9(3): e91990.
[7]Liu M,Tan H, Zhang X, et al. Hematopoietic effects and mechanisms of Fufang e'jiao jiang on radiotherapy and chemotherapy-induced myelosuppressed mice[J]. J Ethnopharmacol, 2014, 152(3): 575-584.
[8]Skaznik-Wikiel ME, McGuire MM, Sukhwani M, et al. Granulocyte colony-stimulating factor with or without stem cell factor extends time to premature ovarian insufficiency in female mice treated with alkylating chemotherapy[J]. Fertil Steril, 2013, 99(7): 2045-2054.
[9]Wang Q, Dou Y, Zhao J. A comparative study of Bushen Huoxue recipe and Yiqi Buxue recipe on hematopoiesis regulation of myelosuppressin in mice[J]. Modern J Interg Tradi Chin West Med, 2013, 22(26): 2681-2683.
[10] Fang J, Liang C, Wang W, et al. Effects of Momordica charantia extracton the immune function of BALB/c mice[J]. Chin J Food Hygie, 2014, 26(3): 223-226.
[11] Jia L, Xi W, Jin G. Effect of Diyu Shengbai tablets on bone marrow depression induced by cyclophosphamide in mice[J]. Chin J Exp Tradi Med Formul, 2012, 18(18): 251-254.
Effect of the administration time of HS6101 on hematopoietic recovery in ICR mice injured by cyclophosphamide
XING Shuang1, SHEN Xing1, XIONG Guo-lin1, LIU Xiao-lan1, YANG Meng1, DAI Chang-liang2, LIU Xiao-yu2, YU Zuyin1*1Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China
2Zhejiang Hisun Pharmaceutical Co., Ltd, Taizhou, Zhejiang 318000, China
*
, E-mail: yuzy79@163.com
This work was supported by the Military Key Technology Research and Development Program in the Major Drug Discovery of PLA (2010ZX09401)
ObjectiveTo explore the effect of the administration time of HS6101 on hematopoietic recovery in ICR mice injured by cyclophosphamide (CTX).MethodsOne hundred and three male ICR mice were divided into 4 groups: CTX control, HS6101 prevention, HS6101 treatment, and HS6101 prevention+treatment groups. CTX was intraperitoneally injected into the ICR mice at a dose of 100mg/(kg.d) for three consecutive days to establish a chemotherapeutics-injured model. HS6101 at a dose of 27μg/mouse in 0.2ml was subcutaneously injected into the mice 1h before the first administration of CTX in HS6101-preventiongroup, 1h after the last administration of CTX in HS6101 treatment group, and both at 1h before the first administration and 1h after the last administration of CTX in HS6101 prevention + treatment group. Physiological saline was subcutaneously injected into the mice in CTX control group (0.2ml/mouse). 10μl peripheral blood was collected from the caudal vein for WBC, neutrophil lymphocyte, RBC and platelet counts on day -1, 3, 5, 7, 9, 11, 13, 15, 17 with the MEK-7222K cell analyzer, and the cell count was compared between HS6101 treatment mice and CTX control mice. Another 30 male ICR mice were used for bone marrow colony forming unit (CFU) assay and bone marrow histopathological examination, and they were assigned into normal control, CTX control, HS6101 prevention, HS6101treatment and HS6101 prevention + treatment groups (each n=6). On the day 4 and day 9 after CTX injection, mice were sacrificed and bone marrow cells were collected from the left femur for mononuclear cell (MNC) isolation. 1×104MNCs were planted in 1.0ml mouse CFU culture medium M3434 and cultured in incubator with the temperature of 37℃, and 5% CO2for 7 days. After that, granulocyte macrophage-colony-forming unit (GM-CFU), megakaryocyte colony forming unit (MK-CFU), mixture-colony-forming unit (Mix-CFU), burst-forming unit-erythroid (BFU-E) and colony-forming unit-erythroid (CFU-E) were counted. Then the right femur was taken for histopathology examination.ResultsAfter CTX injection, counts of WBC, neutrophils, lymphocytes, RBC and platelets of all the mice decreased rapidly. However, the nadirs of WBC, neutrophils and lymphocytes counts in HS6101 prevention group were higher than those in CTX control group, and the counts on day 3 were higher than those in HS6101 treatment group and HS6101 prevention+ treatment group. On day 3, RBC count in HS6101 prevention group was the highest. It was higher on day 5 and day 7 than that of mice in CTX group. In addition, the platelet count in HS6101 prevention group was also the highest on day 3, although that in HS6101 treatment group and 6101 prevention + treatment group was lower than CTX control group. Bone marrow colony forming unit assay showed that the counts of GM-CFU, MK-CFU, BFU-E and CFU-E in all the HS6101 treatment mice were significantly higher than those in CTX control mice. On day 4, histopathological examination of bone marrow from HS6101-treated mice displayed more intact architecture compared with CTX control mice. Three of eighteen (3/18) mice died in HS6101 treatment group, and nine of eighteen (9/18) died in HS6101 prevention + treatment group, suggesting that HS6101 should not be administered after CTX injection.ConclusionAdministration of HS6101 at 1h before giving CTX could significantly promote hematopoietic recovery in ICR mice injured by CTX.
HS6101; lipopeptides; cyclophosphamide; mice; hematopoietic system
R322.2
A
0577-7402(2015)04-0303-06
10.11855/j.issn.0577-7402.2015.04.10
2014-07-11;
2015-02-22)
(责任编辑:李恩江)
军队“重大新药创制”科技重大专项课题(2010ZX09401)
邢爽,理学博士,助理研究员。主要从事急性放射病实验治疗方面的研究
100850 北京 军事医学科学院放射与辐射医学研究所(邢爽、申星、熊国林、柳晓兰、杨萌、余祖胤);318000 浙江台州 浙江海正药业股份有限公司(代常亮、刘晓宇)
余祖胤,E-mail:yuzy79@163.com
